Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Взаимодействия пептидов с клеточной мембраной
Взаимодействие регуляторных пептидов с рецепторами и фосфолипидами
Концепция специфических рецепторов на клеточной поверхности была выдвинута Паулем Эрлихом в начале XX в. Для объяснения специфичности рецепторов использована модель “ключ—замок”, ранее разработанная Фишером для селективного ферментного катализа. Нужно отметить, что пространственное совпадение элементов типа “ключ—замок” — очень устойчивый алгоритм воображения, основанный на бытовых навыках. Огромный экспериментальный материал электроэнцефалографии практически ничего не прибавил к этой механической модели. При моделировании взаимодействия регуляторных пептидов с мембранными рецепторами предполагается, что определенный участок рецептора зеркально и комплементарно соответствует структуре лиганда (Говырин, Жоров, 1994). Внешние участки некоторых рецепторов частично сходны с вариабельной частью молекулы у-глобулина, поэтому на схемах их изображают в виде вилочек. На основании этой же модели предполагается, что некоторые синтетические пептиды могут частично комплементарно совпадать с Fc-участком иммуноглобулинов, возбуждая аллергическую реакцию организма.
Наиболее детально исследована специфичность регуляторных пептидов, вызывающих высвобождение гистамина из тучных клеток кишечника (Jasani et al., 1979). Сравнение активности пептидов в широком диапазоне размеров и вариаций аминокислотных последовательностей (в том числе различных фрагментов АКТГ) с активностью дегранулирующего пептида показало только, что для проявления активности необходимо присутствие в цепи блока с четырьмя щелочными аминокислотными остатками и амидированного С-конца пептида. Но все варианты были на 2—4 порядка менее активны, чем природный дегранулятор. Иными словами, широкий спектр регуляторных пептидов может стимулировать выделение гистамина из тучных клеток, но каждый из них действует только в определенном диапазоне концентраций.
Более современный подход к изучению пептидной регуляции заключается в том, чтобы установить каскад последовательных взаимодействий, в результате которого меняются конформации как липидных, так и пептидных компонентов мембраны и в клетку поступает соответствующий информационный сигнал. Оказалось, что некоторые пептидные регуляторы ингибируют или активируют ферменты, находящиеся на поверхности или вблизи поверхности клеточной мембраны.
В частности, ряд пролинсодержащих пептидов, которые являются фрагментами пищевых белков (IY, VW, IW, VAP, ІКР, LRP, 1RP и др.), ингибирует мембранный фермент, который преобразует ангиотензин-І в ангиотензин-II и инактивирует брадикинин (Yamamoto, 1997). Эта цинк-содержащая пептидаза находится на мембранах эндотелиальных клеток сосудов и нейроэпителиальных клеток. Ее самый сильный ингибитор найден среди пептидов змеиных ядов — pyrEKWAP. Пищевые пептиды являются конкурентными ингибиторами и определяют заметное антигипертензивное действие молочнокислых продуктов, так как именно молочнокислые бактерии, гидролизуя казеин, высвобождают эти ингибиторы. Таким образом, регуляторное действие этих пептидов определяется ингибированием мембранного фермента.
Другой пример: фактор роста фибробластов (полипептид из 140 аминокислотных остатков) активирует фосфолипазу Ср, в результате чего резко возрастает концентрация инозитола-1,4,5-трифосфата (вторичный мессенджер) в цитозоле. Это сопровождается ионотропным ответом миокарда. Таким образом, действие ростового фактора сводится к временному повышению активности ряда гидролаз и изменению заряда и потенциала плазматической мембраны из-за гидролиза фосфолипидов (Tappia et al., 1999).
Эти наблюдения подтверждают данные о значительной роли фосфолипидов в саморегуляции клетки, так как они являются предшественниками молекул-мессенджеров (диацилглицерина, фосфатидовой кислоты, церамидов), действующих как на поверхности клетки, так и в цитозоле, активируя систему G-протеина и последующих реакций (Morris, 1999).
Среди регуляторных ферментных реакций, модифицирующих фосфолипиды мембраны, отмечены не только гидролиз, но и фосфорилирование инозина GMP-зависимой киназой, связанной с тропонином Т (Yuasa et al., 1999). Известно, что “головка” фосфатидилинозина может связывать до трех групп фосфата, что резко повышает локальную плотность отрицательных зарядов. Изменение распределения зарядов на мозаичной поверхности плазматической мембраны само по себе может быть сигналом, передаваемым мембраной внутрь клетки или соседним клеткам в местах плотного контакта.
Необходимо отметить важную роль сиаловой кислоты, которая является концевым звеном гликозидной части многих мембранных рецепторов и детерминант и имеет постоянный отрицательный заряд. Кроме того, она входит в состав гликосфинголипидов плазматической мембраны нейронов и синаптической мембраны и принимает участие в процессе выделения нейротрансмиттеров. Процесс возбуждения мозга также происходит с участием сиаловых кислот. Целый ряд возрастных патологий мозга, в том числе болезнь Альцгеймера (БА), сопровождается общим снижением уровня сиалсодержащих ганглиозидов и цереброзидов (Reutter et al., 1982).
Для объяснения особенностей воздействия нейропептидов и ядов на тучные клетки кишечника, в результате которого высвобождается гистамин, была предложена модель безрецепторной активации системы G-белка (Mousli et al., 1990). Было отмечено, что активность исследованных амфифильных пептидов и нейротоксинов (все они имеют блоки щелочных аминокислотных остатков) подавлялась низкими концентрациями кальция, гидрофобными четвертичными аминами и не проявлялась, если клетки были предварительно десиализированы нейраминидазой. Все это свидетельствует об участии отрицательно заряженных групп на поверхности тучных клеток в связывании регуляторных пептидов.
Как уже указывалось, для сохранения нативной структуры и активности мембранных белков необходимо присутствие мембранных фосфолипидов. Поэтому вещества, изменяющие состав и свойства фосфолипидного бислоя, тем самым влияют на функциональные свойства мембранных белков. Например, локально действующие анестетики разрушают структуру липидного бислоя, что приводит к нарушению функций натриевых каналов. По-видимому, опиоидные пептиды могут аналогично действовать на клеточную мембрану.
В известной мере эти факты уравнивают возможности мембранных пептидных рецепторов и фосфолипидов селективно воспринимать изменения внешней среды, соответственно менять собственную конформацию и передавать информацию об этом не только внутрь клетки, но и соседним клеткам по системе контактов бислойных клеточных мембран. Поэтому в настоящее время интенсивно развиваются флуоресцентные и колориметрические методы исследования межмолекулярных взаимодействий регуляторных пептидов с фосфолипидными мембранами (Добрецов, 1989; Kolusheva et al., 2000).
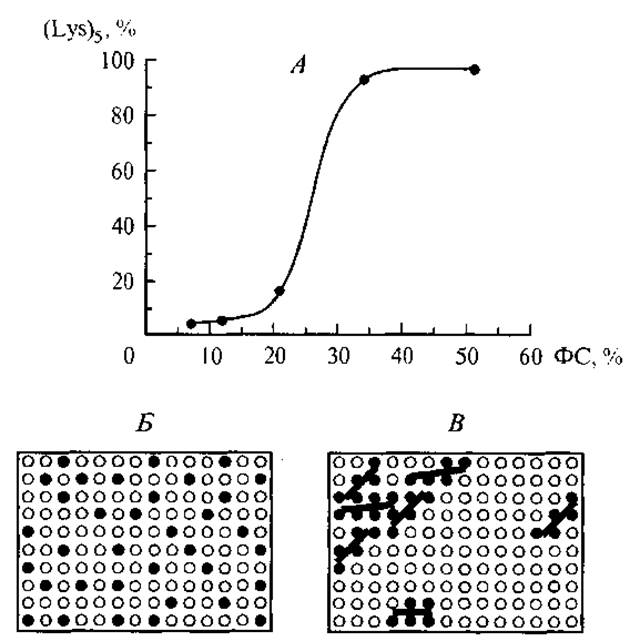
Рис. 10. Зависимость связывания пентализина с поверхностью фосфолипидной мембраны от содержания в ней фосфатидилсерина (А) и переход от равномерного распределения фосфатидилсерина (Б) к кластерам пентализин—фосфатидилсерин (В).
Относительно недавно было исследовано взаимодействие щелочного олигопептида (пентализина) с модельной фосфолипидной (ФХ/ФС) мембраной при разных концентрациях кислого фосфатидилсерина в ее составе (Denisov et al., 1998), как показано на рис. 10. Нелинейный характер графика определяется изменением самоассоциации заряженных групп ФС на поверхности мембраны и кооперативным эффектом при адсорбции пептида. Если при отсутствии пептида отрицательно заряженные группы фосфатидилсерина равномерно распределены по поверхности из-за взаимного отталкивания, то сорбция положительно заряженного олигопептида собирает их в кластеры, нарушая равномерное распределение по поверхности. При малых концентрациях фосфатидилсерина это нарушение невелико (начальный участок), но при увеличении концентрации повышается селективность связывания олигопептида. Очевидно, что при этом в области кластеров меняется и локальная поляризация мембраны.
При установлении межмолекулярных связей “пептид—полярный слой фосфолипидов” соблюдается полярная (заряд-заряд) комплементарность участников, не характерная для специфических взаимодействий пептидных цепей друг с другом.
При исследовании связывания более высокомолекулярных пептидов с липосомами, содержащими фосфатидилглицерин, было показано, что цитохром С и щелочной полипептид гистон Н1 конкурируют за связывание с фосфолипидной мембраной, а полилизин К19 наиболее прочно связывается с кислыми фосфолипидами (Rytomaa, Kinnunen, 1996).
Жидкокристаллическая структура мембраны позволяет индивидуальным фосфолипидам свободно двигаться в слое и выстраиваться в форму, комплементарно соответствующую распределению зарядов регуляторного пептида. Рабочая гипотеза заключается в том, что в некоторых случаях регуляторному пептиду нет необходимости проникать в клетку, так как ему достаточно перестроить и фиксировать комплементарный по зарядам фосфолипидный кластер на поверхности двойного слоя мембраны. А поскольку фосфолипидный состав клеточных мембран разных тканей существенно различается (см. табл. 10), то и структура регуляторного пептида должна быть тканеспецифичной.
Следует отметить, что независимо от механизма воздействия лиганда на мембрану связывание пептидов с рецепторами или с группами фосфолипидов, вызывающее изменение свойств мембраны, описывается одинаковыми уравнениями. Простейший случай взаимосвязи концентрации пептида (С) и отклика системы на полученный сигнал (R) можно представить кооперативной изотермой:
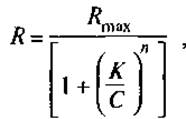
где Rmax — максимальный отклик, соответствующий насыщению рецептора; К — константа связывания; n — параметр кооперативности.
При таком подходе клеточные рецепторы до некоторой степени уподобляются ферментам, а лиганды — субстратам, поскольку их соединение влечет за собой определенную реакцию, т. е. отклик (Волькенштейн, 1981). Для случая, когда кооперативность отсутствует, т. е. n = 1, и взаимодействие лиганда осуществляется с единичными рецепторами, это уравнение идентично уравнению Михаэлиса—Ментен для ферментной кинетики. В случае положительной кооперативности взаимодействия (n > 1) результирующий отклик системы на сигнал возрастает. Принято считать, что это происходит из-за взаимодействия мембранных рецепторов друг с другом. Примером могут служить высокочувствительные хеморецепторы ракообразных, различающие запахи аминокислот и пептидов (Belli, Rechnitz, 1989). Эти рецепторы расположены на окончаниях дендритов нервных клеток. Чувствительность хеморецепторов голубого краба к запаху аминокислот обнаруживается при концентрации 10-5 М и определяет дальнейшее поведение краба. Предполагается, что после взаимодействия хотя бы одного рецептора с единичным лигандом кооперативный отклик всех рецепторов вызывает локальную деполяризацию мембраны нервной клетки и соответствующий потенциал действия. Чувствительность мембранного рецептора к изменению состояния соседа определяется интегрирующими свойствами бислойной липидной мембраны, в которой располагаются гидрофобные части рецепторов; при этом значения показателя степени п могут достигать нескольких единиц.
Рецепторы некоторых сенсорных клеток, которые располагаются в эпителии сенсорного органа, функционируют на границе с внешней, в частности с воздушной, средой (например, обонятельные клетки, волосковые клетки слухового аппарата). Они имеют значительно более сложное строение, чем хеморецепторы, функционирующие в гуморальной среде. Собственно рецепторные клетки всегда ориентированы по нормали к внешней границе органа. Они окружены поддерживающими клетками, и в их апикальной части расположены специальные мембранные структуры — реснички и ворсинки. Например, на обонятельных нейронах расположено 6—8 модифицированных ресничек, и предполагается, что на их кончиках имеются хеморецепторы запахов.
Однако особенность восприятия запаха состоит в его векторном характере, т. е. воспринимается направление источника сигнала. По-видимому, определенную роль в этом играет морфология клеточных мембран в апикальной части сенсорной клетки. Реснички, микроворсинки и волоски на окончаниях обонятельных, вкусовых и вестибулярных сенсорных клеток напоминают антенную решетку из вибраторов и щелей (Начала физиологии, 2001). Известно, что разность фаз колебаний, возбуждаемых в одинаковых, но объединенных определенным образом элементах, обеспечивает восприятие сигнала в виде направленного луча. Кроме того, дополнительный эффект пространственной ориентации происходит из-за взаимодействия колебаний двух разных типов на границе разделе двух сред: воздушной и значительно более плотной среды сенсорного органа. Механические колебания, в частности звуковые, распространяются в газовой фазе как продольные волны, а в жидкости — как поперечные. В результате их взаимодействия на границе сенсорного органа могут возникать механические толчки и биения (Иваницкий, Деев, 2001). Реснички на волосковых клетках внутреннего уха воспринимают не только звуковую частоту, но и эти биения, которые вынуждают их поворачиваться в сторону источника звука. Изменение ориентации ресничек немедленно воспринимается нейроном, который передает электрический сигнал исполнительному органу. Электрофизические свойства клеточной мембраны позволяют ей транслировать локальное и даже точечное изменение своего потенциала через жидкокристаллическую структуру липидов с высокой скоростью и со значительным усилением. Это возможно при условии, что периодическое изменение емкости липидного бислоя (ведущий параметр) соизмеримо с частотой возбуждающего сигнала (Рабинович, Трубецков, 1984).
По-видимому, из-за сложного строения сенсорных рецепторов многие сенсорные клетки не способны делиться: их деградация или разрушение восполняются за счет стволовых клеток (расположенных вблизи сенсорных клеток), которые при необходимости развиваются как новая сенсорная клетка (Alberts et al., 1994).
Можно предполагать, что таким образом сенсорные органы осуществляют клеточную адаптацию. Если внешняя среда является источником слишком сильного раздражения, разрушающего клеточные рецепторы, то из стволовых клеток сенсорного органа развиваются новые сенсорные клетки, рецепторы которых сохраняют чувствительность к малым изменениям раздражающего фактора на фоне постоянного высокого уровня внешнего раздражения (Richardson, 1993).
Для большинства дифференцированных тканей, клетки которых способны делиться, обновление рецепторов происходит не только при делении клетки, но и в процессах внутриклеточной рециркуляции хеморецепторов в составе везикул. При этом клетка, адаптированная к высоким концентрациям определенного лиганда, может формировать хеморецепторы с повышенной чувствительностью к очень малым изменениям этих высоких концентраций.
Таким образом, эффекты ультрамалых доз отнюдь не являются парадоксальными в кооперативных системах. В традиционной фармакологии эти закономерности описываются функцией насыщения “доза—отклик”. Однако биохимическая интерпретация такой зависимости в области ультрамалых концентраций требует определенной осторожности, так как концентрация рецепторов, взаимодействующих с лигандом, не учитывается в уравнении, приведенном на с. 130. Традиционно предполагается, что концентрация рецепторов значительно меньше концентрации специфических лигандов и соответственно реакцию можно описать уравнением первого порядка. В тех системах, где концентрация или активность лигандов может быть измерена независимым биохимическим и одновременно биологическим методами, линейной корреляции между ними, как правило, не наблюдается. В частности, при сравнении активности нейраминидазы по гидролизу олигомерного субстрата с ее активностью по гидролизу рецепторов эритроцитов между ними наблюдается нелинейная зависимость. В этом случае, как и в реакции гемагглютинации эритроцитов вирусами гриппа и при многих других биологических взаимодействиях, измеряемых на определенном отрезке времени, титр реакции (отклик) связан с аналитической концентрацией реагента логарифмическим законом (Шатаева и др., 1978). Это свидетельствует о том, что реакции, возбуждаемые реагентом при воздействии на клетку, могут иметь не кооперативный, а каскадный (цепной) характер.
Латеральная подвижность фосфолипидных элементов плазматической мембраны и их чувствительность к распределению положительно заряженных групп в окружающей среде предопределяют их уязвимость для внешней молекулярной агрессии. Большинство пептидных антибиотиков и токсинов используют именно эти механизмы для нарушения клеточной проницаемости. В частности, стрептолизин О (пептидный токсин) при пикомолярных концентрациях присоединяется к холестерину плазматической мембраны и образует кольцевую структуру (пору) с диаметром 30 нм (Palmer et al., 1998). Этот процесс завершается истечением содержимого клетки наружу и ее гибелью. Аналогично действуют пептиды-антибиотики дефенсины и протегрины, содержащие в структуре избыток лизина и аргинина (Кокряков, 1999).
Активность пептидных антибиотиков определенным образом зависит от компонентного состава цитоплазматической мембраны и от трансмембранного электрического потенциала клетки-мишени. В составе бактериальных мембран присутствует большое количество кислых фосфолипидов (фосфатидилглицерола и кардиолипина), которые практически отсутствуют в мембранах эукариотических клеток. Эти фосфолипиды являются не только маркерами, но и центрами связывания пептидных антибиотиков животного происхождения, в частности дефенсинов и протегринов, за счет сильных ион-ионных связей, которые устанавливаются по кооперативному механизму аналогично концентрационной зависимости, представленной на рис. 10, А. Кроме того, известно, что мембранный потенциал бактерий в 1.5—2 раза выше, чем у мембран эукариотических клеток. Так что пептидные антибиотики с высоким содержанием лизина и аргинина могут проникать в клетку через мембрану путем электрофореза, подобно тому как это описано для микробных антибиотиков полимиксина В и грамицидинов (Франклин, Сноу, 1984).
Интересно отметить, что ряд протегринов и цекропинов имеют вблизи N-конца триптофан: KW, RW, GW, SW, KW, RRW. В то же время обнаружено, что присоединенный к липосоме пептид определенной структуры, состоящий из 11 аминокислотных остатков и с остатком триптофана на N-конце, может “протащить” липосому в цитоплазму по механизму слияния мембран. Аналогично организован механизм проникновения в клетку вирусной частицы (Pecheur et al., 1998).
Таким образом, взаимодействие пептидов разных классов с цитоплазматической мембраной осуществляется по нескольким механизмам и обеспечивает различные функции клетки, но при этом обнаруживается ряд общих структурных закономерностей. В соответствии со своим строением регуляторные пептиды могут проявлять многообразную активность:
1) непосредственно воздействовать на клеточный рецептор, устанавливая межмолекулярные связи с участками пептидной цепи рецептора, которая в результате активируется, меняет конформацию и транслирует сигнал о состоявшейся связи в плазматическое пространство;
2) воздействовать на бислойные структуры мембраны, устанавливая ион-ионные связи с полярными головками фосфолипидов, меняя при этом их взаимное расположение, поляризацию и мембранный потенциал, что является сигналом для внутриклеточных мессенджеров;
3) внедряться в структуру липидного бислоя с помощью ароматических и щелочных аминокислотных остатков вблизи N-конца, изменяя проницаемость мембраны по отношению к ионам и растворителю и нарушая целостность мембраны;
4) активировать мембранные ферменты — гидролазы и трансферазы, меняющие соотношение положительных и отрицательных зарядов на поверхности клеточной мембраны, и инициировать таким образом каскад химических и электрохимических трансмембранных реакций;
5) играть роль агонистов (действовать синергетически) при активации мембранных белков (ферментов и рецепторов) другими веществами-метаболитами; не исключено, что тканеспецифическое действие регуляторных пептидов класса цитомединов определяется именно их ролью агонистов при модуляции специфических функций дифференцированных тканей.