Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Взаимодействие пептидов с хроматином клеточного ядра
Компонентный состав и строение хроматина
Ядро эукариотической клетки — самая крупная внутриклеточная структура. Содержимое ядра заключено в ядерную оболочку, состоящую из двух липидных бислойных мембран — внутренней и внешней. Расстояние между ними составляет 20—30 нм, это так называемое перинуклеарное пространство. В ядерной оболочке имеются фиксированные сквозные поры (нуклеопоры), которые соединяют внутреннее пространство ядра с цитоплазмой. В области нуклеопор внешняя и внутренняя бислойные мембраны ядерной оболочки соединяются. Стенки нуклеопор организованы особыми полипептидами — нуклеопоринами. Диаметр нуклеопор составляет 50—80 нм, их площадь занимает приблизительно 10 % всей поверхности ядерной оболочки (Кагава, 1985). Через эти поры в ядро входят белки и выходят рибонуклеопротеиновые комплексы. Собственно рибонуклеиновая кислота самостоятельно не покидает ядро.
Внутренняя поверхность ядерной мембраны выстлана волокнистым слоем белка ламина, в котором различается упорядоченная решетка микротрубочек, соединяющих нуклеоплазму с внутренней ядерной мембраной.
Внутреннее пространство клеточного ядра заполнено хроматином — сетью двойных спиральных цепей дезоксирибонуклеиновой кислоты, с которой ассоциированы ядерные белки, управляющие основными процессами в клеточном ядре: репликацией ДНК, репарацией ее поврежденных участков и транскрипцией генетической информации с ДНК на матричную РНК. Весовое соотношение ядерных белков и ДНК в хроматине приблизительно 1:1.
Главный компонент хроматина — высокомолекулярная ДНК — жесткоцепная макромолекула полиамфолитного типа, мономерные звенья которой соединены фосфодиэфирными связями. ДНК хроматина характеризуется молекулярной массой в диапазоне от 20 кДа до 40 ГДа. Синтез ДНК (репликация) проходит в результате присоединения 5'-фосфатной группы нуклеотида к 3'-гидроксильной группе предыдущего дезоксирибонуклеотида. Таким образом, цепь ДНК, если она не кольцевая, имеет векторную ориентацию от 5'-конца к 3'-концу (последовательность оснований так и записывается); на 5'-конце расположена группа —РО(ОН)2 на 3'-конце — гидроксильная группа.
Строение цепи ДНК может быть представлено следующей схемой:
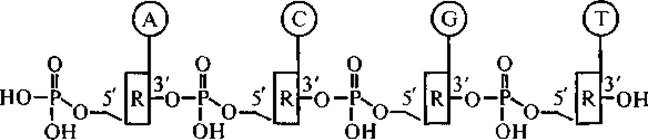
где R — остатки дезоксирибозы, а А, С, G и Т — нуклеиновые основания аденин, цитозин, гуанидин и тимин соответственно (Зенгер, 1987).
В двойных спиралях ДНК каждого вида организмов сохраняется последовательность комплементарных друг другу пар оснований А—Т и G—С, так что одна цепь, называемая кодирующей (смысловой), фиксируется встречной, некодирующей цепью. При этом две цепи ДНК при образовании правой двойной спирали имеют взаимно противоположную ориентацию (Van Holde, 1988).
В начале 50-х годов, т. е. на ранних этапах изучения двойной спирали ДНК, предполагали, что ее геометрическая структура регулярна и соседние нуклеотидные пары повернуты друг относительно друга на 36°, т. е. на один полный оборот спирали приходится 10 пар оснований. Более точная кристаллография ДНК с определенной последовательностью оснований показала, что каждая последовательность имеет характерную нерегулярность — наклоны пар оснований друг относительно друга непостоянны, а это приводит к локальным изгибам спирали. Один оборот двойной спирали ДНК имеет длину приблизительно 3.4 нм. Это усредненные величины для гетерогенной смеси ДНК. Вообще говоря, двойную спираль ДНК не следует рассматривать как однородный стержень. В ее структуре наблюдаются систематические, зависящие от нуклеотидной последовательности модуляции, которые важны при нуклеиново-пептидном узнавании (см. раздел 3.2). При этом узнавании может происходить изменение вторичной спиральной структуры ДНК с образованием петель, крестообразных структур и узлов (Arnott et al., 1983).
Фосфорилированная углеводная часть ДНК выполняет структурные функции и обеспечивает конформационные перестройки макромолекулы, тогда как линейная последовательность пуриновых и пиримидиновых оснований вдоль цепи ДНК содержит и сохраняет определенную генетическую информацию. На поверхности двойной спирали ДНК различают большую и малую канавки, которые расположены вдоль макромолекулы между двумя цепями ее фосфоэфирных связей.
В ряде случаев возможны случайная химическая модификация нуклеотидных оснований или их выщепление из цепи ДНК. В частности, наиболее уязвимы для случайной модификации звенья цитозина. На рис. 11 представлены примеры спонтанного гидролиза цитозина и его модификации под действием ДНК-метилтрансферазы. Более того, от протонирования цитозина зависит образование ряда неканонических структур ДНК (Н-формы), которым приписывают определенную роль в регуляции функционирования генома. Было показано, что на этот процесс влияет существование локальной области более низкого pH в непосредственной близости от цепи ДНК при физиологических условиях (Иванова и др., 1998).
Для защиты генетической информации от случайных повреждений в хроматине функционирует система ферментов, восстанавливающих последовательность оснований поврежденной цепи ДНК в соответствии с последовательностью комплементарной (неповрежденной) цепи.
Из-за отсутствия 2'-гидроксильной группы у дезоксирибозы фосфодиэфирная связь ДНК значительно более устойчива к щелочному гидролизу, чем аналогичные связи в рибонуклеиновых кислотах. Меньшая устойчивость цепей РНК сочетается с более высокой регуляторной активностью ее мономеров. Аденозин (аденин рибозид) и гуанозин (гуанин рибозид) являются регуляторными молекулами и широко распространены в клетках всех типов. Аденозин — мощный регулятор передачи физиологических сигналов в центральной и периферической нервной системе, клетки которых содержат специфический рецептор. Он может ингибировать или стимулировать высвобождение нескольких нейротрансмиттеров, включая ацетилхолин и катехоламины.
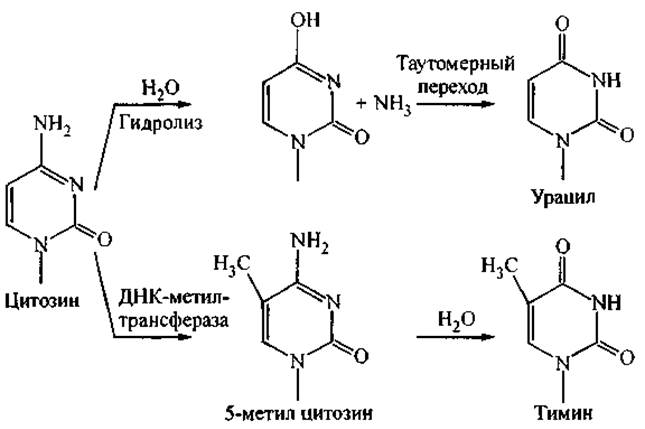
Рис. 11. Возможные природные модификации цитозина.
Как известно, одна аминокислота кодируется последовательностью в цепи трех нуклеотидных остатков — кодоном. Однако это кодирование вырожденное, так как большинство аминокислотных остатков определяется более чем одним кодоном. Передача этой информации исполнительным рибосомальным структурам и преобразование ее в форму аминокислотной последовательности осуществляются поэтапно. Путем транскрипции последовательность нуклеотидов с некодирующей цепи ДНК копируется на мРНК, которая становится в соответствии с комплементарностью оснований копией смысловой последовательности кодирующей цепи ДНК.
Трансляция этой информации (перевод последовательности нуклеотидов с мРНК в последовательность аминокислотных остатков пептидной цепи) происходит на рибосомах в процессе пептидного синтеза. Таким образом, все полипептиды, синтезируемые в клетке, содержат в преобразованном виде генетическую информацию, накопленную и сохраненную предыдущими поколениями организмов. Эта информация является программой, определяющей свойства и функции данного организма, в том числе механизмы его саморегуляции.
Два базовых конформационных состояния ДНК различимы даже при оптическом микроскопировании: это упорядоченные хромосомы и диспергированная сеть хроматина. Хромосомная конформация и упаковка ДНК возникают на этапе деления клетки и обеспечивают репликацию ДНК. Состояние диспергированного хроматина характерно для интерфазы дифференцированной клетки, во время которой осуществляются репарация поврежденных участков ДНК и транскрипция генетической информации.
В настоящее время строение ДНК, генетический код и механизм рибосомального синтеза пептидов детально изучены. Следует только дополнительно подчеркнуть роль межцепной и межмолекулярной комплементарности нуклеиновых кислот, которая обеспечивает точную передачу молекулярной информации и имеет фундаментальное значение для репродукции живых систем.
Рассмотрим особенности химического строения ДНК, которые обеспечивают диапазон ее межмолекулярных взаимодействий с низкомолекулярными метаболитами. Макромолекула ДНК представляет собой полиэлектролит, сильно и неравномерно гидратированный. Аминогруппы нуклеиновых оснований являются хорошими акцепторами протонов и при установлении водородной связи в кислой области приобретают положительный заряд. Гидроксильные группы фосфата имеют рКа ниже 2.0 и в физиологических условиях всегда отрицательно заряжены. Гидратация нуклеиновой кислоты играет важную роль в конформационной организации ДНК (А, В и С конформации) и в структуре растворителя вблизи поверхности макромолекулы, особенно со стороны ее большого желобка. В соответствии со своей амфолитной природой ДНК взаимодействует с ионами электролитов, так что при увеличении ионной силы раствора наблюдаются изменения как молекулярного объема и степени гидратации ДНК, так и спирализации (степени закрученности) ее цепей. Важное регуляторное значение имеет локальное взаимодействие ДНК с поливалентными или комплексообразующими металлами. Щелочноземельные и переходные металлы взаимодействуют с кетогруппами пиримидиновых оснований, комплексы платины способны образовывать внутримолекулярные сшивки с локальным нарушением двухспиральной структуры ДНК, кальций и магний взаимодействуют с гидроксильными группами фосфата. Все это многообразие взаимодействий лежит в основе нескольких подвижных уровней структурной организации ДНК в хроматине. Комплексообразование ДНК с соединениями платины лежит в основе цитостатической и противоопухолевой активности препаратов на основе Pt (II) (Bloomfield, 1997).
Для нормального функционирования хроматина часть фосфатных групп ДНК всегда должна быть связана с ионами кальция и магния. Оказалось, что эти ионы обеспечивают взаимодействие ДНК с другими классами биологически активных регуляторов — фосфолипидами и кислыми пептидами. Они нейтрализуют взаимное отталкивание отрицательно заряженных групп этих компонентов и фосфатных групп ДНК и служат мостиками для их межмолекулярного связывания. В частности, ДНК в присутствии кальция образует комплексы с фосфатидилхолином, фосфатидилэтанолами- ном и сфингомиелином (Хусайнова и др., 1999). С одной стороны, ДНК в комплексе с фосфолипидами частично расплетается и становится более доступной для действия эндонуклеазы. С другой стороны, эти комплексы ДНК имеют палочкообразную форму и проявляют выраженную липофильность. Так, они вызывают слияние липосом, т. е. играют роль “фузогена” при взаимодействии с клеточной мембраной и могут транспортировать через липидный бислой фосфолипиды и кислые пептиды (Кувичкин, 2000). В хроматине обнаружены не только липиды, но и их комплексы с белками. Иммунохимическим анализом в активном хроматине гепатоцитов обнаружены аполипопротеины, содержащие белки с молекулярной массой 28 и 14 кДа (Панин и др., 1992).
Определенное регуляторное значение имеет комплексообразование ДНК по механизму интеркаляции, при котором плоские ароматические и полициклические молекулы встраиваются в двойную спираль между соседними парами оснований, что приводит к блокированию процесса транскрипции. Такой механизм лежит в основе связывания ДНК с профлавином, акридином, бромистым этидием и некоторыми другими противоопухолевыми антибиотиками. Однако возможен и другой путь блокирования: выраженные кислотные свойства ДНК обеспечивают ей прочные межмолекулярные взаимодействия с полиаминами и щелочными пептидами. Например, олигопептидный антибиотик нетроксин, содержащий реакционноспособные аминогруппы и обладающий антивирусной и противоопухолевой активностью, селективно связывается с А—Т-парами оснований, располагаясь в малой канавке двойной спирали В-конформации ДНК. Рентгеноструктурный анализ обнаружил высокую степень электростатической комплементарности нетроксина с фосфатными группами спиральной ДНК (Wainer et al., 1982).