Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Взаимодействие пептидов с хроматином клеточного ядра
Межмолекулярные взаимодействия регуляторных пептидов и ДНК
Взаимодействия между белками и нуклеиновыми кислотами осуществляются на всех этапах репликации и экспрессии ДНК, а также в ходе многочисленных процессов клеточной саморегуляции.
Анализ строения полипептидного каркаса и его боковых групп показал, что существуют четыре потенциально возможных типа взаимодействий между пептидами и нуклеиновыми кислотами (Claud, 1971; Hippel, McGhee, 1972; Nucleic acid-protein recognition, 1977):
1) солевые связи между фосфатными и положительно заряженными боковыми группами аминокислотных остатков (лизина, гуанидиновой группы аргинина и протонированным остатком гистидина);
2) водородные связи между фосфатными группами, нуклеотидами, углеводными частями нуклеиновых кислот, протон-донорными и протон-акцепторными группами пептида;
3) стэкинг-взаимодействия между боковыми группами остатков ароматических аминокислот (триптофана, тирозина, фенилаланина, гистидина) и нуклеотидами по механизму, аналогичному интеркаляции;
4) гидрофобные взаимодействия 5-метил цитозина и тимина с неполярными боковыми группами пептидов.
Энергия представленных четырех типов взаимодействия уменьшается в том порядке, в котором они перечислены. Однако при рассмотрении таких систем необходимо учитывать, что все эти взаимодействия осуществляются в комплексе.
ДНК обладает высокой реакционной способностью взаимодействия с полипептидами и полиаминами. Большое внимание уделено изучению комплексообразования ДНК с протаминами. Эти пептиды располагаются на поверхности двойной спирали так, что положительные заряды соседних боковых групп смотрят в разные стороны и одновременно связываются с фосфатными группами обеих цепей двойной спирали ДНК (Зенгер, 1987). Было показано, что при таких взаимодействиях происходит ассоциация комплексов в надмолекулярные структуры, причем большое значение имеет распределение гидрофобных групп полипептида вдоль цепи. Подробные кристаллографические исследования структуры этих комплексов проводились с целью моделирования взаимодействия ДНК с гистонами.
Гистоны представляют собой эволюционно консервативные одноцепочечные пептиды щелочной природы, содержащие большое количество лизиновых и пролиновых остатков и выполняющие в хроматине структурные функции. ДНК, содержащая около 200 пар оснований, и октамер, состоящий из четырех типов гистонов (Н2А, Н2В, Н3, Н4), образуют нуклеосому, которая является структурной единицей хроматина (McGhee, Felsenfeld, 1980). По форме нуклеосомы напоминают диски с диаметром 11 нм и толщиной 5.7 нм, расположенные на цепях ДНК “как птички на проводах”. В среднем 146 пар оснований связаны в форме суперспирали блоком из восьми гистоновых молекул (коровая частица) и таким образом защищены от транскрипции. Между нуклеосомами находится 50—150 пар оснований (линкерная ДНК), доступных для транскрипции (Van Holde, 1988).
Все остальные полипептидные и белковые компоненты хроматина обычно называют негистоновыми белками. Их количество достигает 500, включает десятки ферментов, полимеразы, репрессоры, активаторы и 15—20 полипептидов, структура которых недостаточно изучена. Кроме того, из нуклеоплазмы выделены компоненты, участвующие в поддержании пространственной структуры хроматина, белки внутриядерной фибриллярно-гранулярной сети, в том числе актин, тропонин, тубулин, ДНК-релаксирующие белки и нуклеопорины.
Следует отметить большие методические трудности при изучении межмолекулярных взаимодействий ДНК с пептидами. Эти трудности связаны с известной диспропорцией в развитии методов изучения высокоочищенной ДНК и ее комплексов с пептидами. С одной стороны, крупная макромолекула ДНК легко может быть визуализирована, ориентирована в электрическом поле, расположена в желобке на стеклянной поверхности и разрезана в определенной точке нуклеазой. Все эти манипуляции проводятся под контролем атомно-силовой и туннельной микроскопии и напоминают молекулярную хирургию (Yuqiu et al., 1992). С другой стороны, разработка методов отделения полипептидов от ДНК при сохранении их нативности далека от завершения. Как правило, для разделения используют методы экстракции, комплексообразования с полиэтиленимином, фракционного осаждения и переосаждения полипептидов (Burgess, 1991). Пептиды, специфически связанные с ДНК, с большим трудом от нее отделяются и часто при этом быстро теряют свою
специфическую активность. Например, известно, что тканевый гомеостаз регулируется механизмом отрицательной обратной связи с участием кейлонов, которые вырабатываются в зрелых и дифференцированных клетках. Эти тканеспецифические ингибиторы клеточной пролиферации выделяются из препаратов ДНК фракционным спиртовым осаждением (Балаж, Блажек, 1982). Кейлоны, как и цитостатики, могли бы быть использованы в качестве антибластомных средств. Однако полученные препараты высокоочищенных кейлонов нестабильны, что затрудняет не только их медицинское использование, но и изучение в модельных системах (Романов и др., 1984).
В принципе процесс транскрипции может быть инициирован за счет снятия гистоновой блокировки (Dynlacht, 1997). Значительную роль в этом механизме играет убиквитин. Уже давно было замечено, что ядерный белок А24 состоит из двух полипептидов — гистона Н2А и убиквитина, которые связаны между собой ковалентной связью (Gold-knopt et al., 1980). Удаление гистона Н2А из нуклеосомы по механизму убиквитинизации (аналогично удалению мембранных рецепторов) и его транспорт к протеосомам являются первым этапом подготовки данного участка ДНК к транскрипции (Boarends, 1999).
Кроме собственно убиквитина в хроматине обнаружено целое семейство убиквитин-подобных регуляторных пептидов, которые контролируют конформацию ДНК на разных этапах транскрипции и, ингибируя топоизомеразу, предотвращают повреждение ДНК (Suzuki et al., 1999; Мао et al., 2000).
В хроматине функционирует также механизм “рецепторного” включения транскрипции. Собственная система рецепторов хроматина представляет собой прочно связанные с ДНК ядерные белки, конформация которых зависит от присутствия специфического лиганда. Их называют лиганд-зависимыми факторами транскрипции. При отсутствии лиганда ядерный рецептор является репрессором. При связывании специфического лиганда этот рецептор меняет свою конформацию и активирует транскрипцию (если нет другого репрессора). Такие ядерные рецепторы обнаружены и исследованы для витамина А, тироксина и стероидных гормонов (Horlein et al., 1995).
Гистоны и негистоновые белки хроматина регулируют клеточный цикл на всех этапах — от деления до завершения существования дифференцированной клетки. Нормальное
соотношение между делящимися и покоящимися клетками — митотическое равновесие в постоянно функционирующих органах и тканях поддерживается тканеспецифическими факторами транскрипции. В рамках рассматриваемой проблемы саморегуляции мы остановимся только на механизмах пептидной регуляции транскрипции.
Транскрипция каждого гена контролируется его регуляторной областью, расположенной вблизи сайта, с которого начинается транскрипция в направлении от 5'- к 3'-концу. Эта область представляет собой участок двойной спирали ДНК и комплементарно связанные с ним регуляторные пептиды. Иными словами, регуляторные области генов представляют собой нуклеопротеиновые комплексы (НПК). В состав НПК входят белки двух типов: репрессоры (они предотвращают транскрипцию гена) и факторы транскрипции, которые включают транскрипцию (Jacob, Monod, 1961). Эти белки осуществляют контроль за экспрессией генов и синтезом белков, необходимых клетке на данном этапе существования, не расплетая двойной спирали ДНК. Как оказалось, для пептидных факторов транскрипции (ФТ) нет необходимости внедряться во внутренние области двойной спирали, так как на ее внешнюю поверхность экспонированы протон-донорные, протон-акцепторные и гидрофобные группы каждой пары оснований.
При формировании двойной спирали пары оснований G—С и С—G устанавливают три водородные связи внутри двойной спирали, а пары А—Т и Т—А — только две. В то же время пары G—С и С—G экспонируют на поверхность большой канавки две протон-донорные группы, а пары А—Т и Т—А — дополнительно гидрофобную СН3-группу тимина. Особое значение имеют группы метилированного цитозина (рис. 11). Они присутствуют в повышенной концентрации на участках ДНК, обозначаемых обычно как CpG-островки (CpG-islands) (Antequera, Bird, 1993). Длина этих участков достигает 1000 пар оснований (т. е. длиннее экзонов и короче интронов). Они расположены в регуляторных областях вблизи 5'-конца генов. Эксперименты показали, что метилированная ДНК значительно сильнее связывает пептиды (Bird, 1992). По-видимому, метальная группа 5-метил цитозина (тС) вносит свой вклад в конфигурацию характерного сайта узнавания и в энергию связывания пептидного фактора транскрипции с ДНК.
Как мы увидим дальше, именно метрика расположения водородных связей и гидрофобных групп на поверхности большой канавки двойной спирали определяет селективное связывание регуляторных пептидов и ДНК (Alberts et al., 1994).
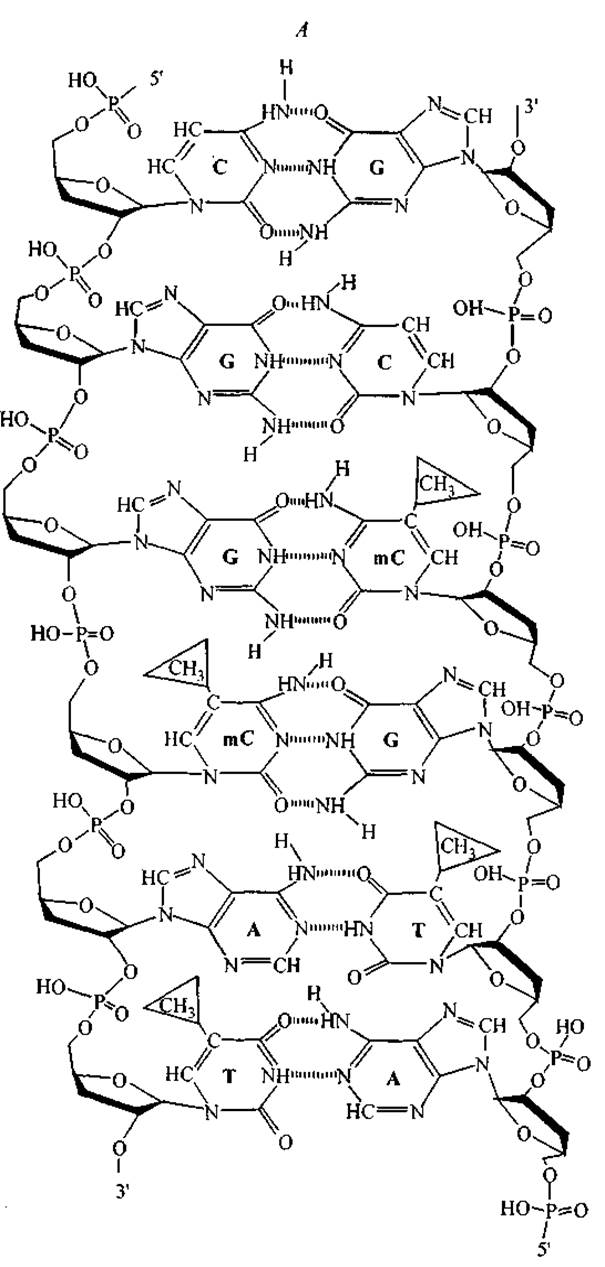
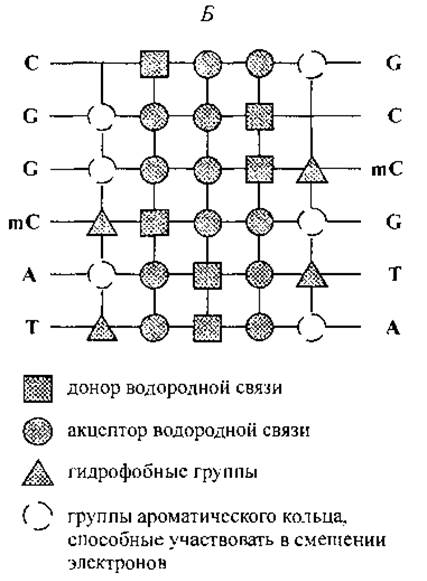
Рис. 12. Взаимное расположение функциональных групп комплементарных нуклеотидов в сечении двойной спирали ДНК (А) и комбинация функциональных групп, экспонированных на поверхность вдоль большой канавки двойной спирали последовательности CGGmCAT (Б).
На рис. 12 представлены схемы объединения А—Т, G—С и G—mС нуклеотидных пар и характерное расположение функциональных групп по поверхности большой канавки двойной спирали для последовательности кодирующей цепи CGGmCAT. Рис. 12, Б иллюстрирует тот факт, что каждая последовательность нуклеотидов образует уникальный орнамент (характерное расположение) функциональных групп на поверхности большой канавки двойной спирали. Замечательно то, что на поверхность экспонированы функциональные группы нуклеотидов, принадлежащих как кодирующей, так и некодирующей цепям ДНК. Расположение этих групп составляет основу для специфического межмолекулярного “узнавания” участка ДНК пептидными ФТ, т. е. регуляторными пептидами хроматина.
В первую очередь регуляторные функции выполняют полипептиды, которые отвечают за локальные изгибы и скручивание цепей ДНК. Они узнают специфические сайты по характерному расположению водородных связей и гидрофобных групп в большой канавке двойной спирали и устанавливают сильные ион-ионные взаимодействия с фосфатными группами ДНК. Все это приводит к большим торсионным напряжениям макромолекулы, в результате чего жесткие участки цепи ДНК могут изгибаться. Именно эти изменения локальной структуры переводят ДНК из состояния репрессии в состояние активации, т. е. готовности к транскрипции (Tang et al., 2000). Последующий этап раскручивания двойной спирали для транскрипции возникает только при взаимодействии ДНК с пептидами, принадлежащими высокоподвижной группе (HMG). Эти полипептиды имеют неоднородную структуру, состоящую из глобулярных доменов и развернутых участков полиглутаминовой и полиаспарагиновой кислот (до 22 аминокислотных остатков). В отличие от более щелочных пептидов они способствуют раскручиванию спирали и расплетанию двухцепочечной ДНК (Van Holde, 1988). По-видимому, в этой системе межмолекулярного взаимодействия решающую роль играет не столько взаимное отталкивание отрицательно заряженных фосфатных групп ДНК и карбоксильных групп полипептидов, сколько установление сильных водородных связей карбоксильных групп пептида с атомами азота нуклеиновых оснований (Luisi et al., 1998).
Исследования структур многочисленных ФТ, функционирующих в хроматине, еще далеки от завершения. Ранее было показано, что специфические сайты связывания пептидных ФТ представляют собой короткие последовательности на спирали ДНК продолжительностью до 20 пар оснований. Это основная деталь генетического “выключателя”. Сотни таких последовательностей известны для различных регуляторных белков (Mitchell, Tjian, 1989). Например, участок ДНК, определяющий транскрипцию гена секреторного протеина Sp-1, содержит последовательность GGGCGG. Схема, представленная на рис. 12, Б, позволяет построить для этой последовательности макет расположения функциональных групп на поверхности двойной спирали, а также представить вероятную аминокислотную последовательность пептидного фактора транскрипции, комплементарного такому расположению.
Для существующей в природе высокой специфичности взаимодействия транскрипционных факторов с двойной спиралью ДНК недостаточно простого комплементарного связывания пептида в большой канавке ДНК. Большое значение имеют конформация и пространственная ориентация сайта связывания, а также соответствие расположения гидрофильных, гидрофобных и донорно-акцепторных областей обеих макромолекул. В экспериментальных исследованиях было показано, что в хроматине существуют белковые факторы, которые вызывают изменение конформации ДНК для последующего связывания регуляторных пептидов с промотерными участками и активации транскрипции генетической информации. Это так называемые архитектурные факторы хроматина (Wolffe, 1994). В связи с тем что взаимодействие пептидов с нуклеиновыми кислотами регулирует состояние ДНК в хроматине и физиологическое состояние клетки, во многих работах было исследовано влияние такого комплексообразвания на подвижность комплексов (Katan-Khaykovich, Shaul, 1998), активность ферментов (Bell et al., 1997) и физические характеристики макромолекул, такие как стабильность комплексов и изменение температуры плавления двухспиральной цепи (Cattau et al., 1969; Tanatani et al., 1998).
Наиболее изученные структурные мотивы пептидных факторов транскрипции состоят из геометрических последовательностей “спираль—изгиб—спираль” и “спираль—петля—спираль” (helix—turn—helix), в которых спиральные участки пептидной цепи развернуты друг относительно друга на 120°. Пептидная цепь, как правило, имеет форму правой спирали, даже если она не имеет а-спиральной конформации. При этом предполагается, что часть пептидной цепи, возможно петля, укладывается в большую канавку ДНК (Harrison, 1991). Двойная спираль ДНК также закручена вправо. Поэтому при контакте этих макромолекул их поверхности могут плотно прилегать друг к другу.
Другим структурным вариантом сайта связывания факторов транскрипции является участок цепи с “лейциновой застежкой” (basic leucine zipper), состоящий из двух основных боковых последовательностей, образующих а-спираль, который селективно связывается с нуклеотидным октамером 5'ATTTGCAT3'. Очевидно, что при этом гидрофобные группы лейцина взаимодействуют с гидрофобными группами СН3 тимидина (Alberts et al., 1994; Leonard et al., 1997).
Известен также тип пептидных структур “узнавания” специфических сайтов ДНК для инициирования транскрипции, состоящий из а-спирали и ß-складки, связанных ионом цинка и сопряженных с последовательностью аминокислотных остатков С—С и Н—Н. Эта структура связывается с последовательностью нуклеотидов GGG, причем в связывании участвуют остатки аргинина и гистидина (Coleman, 1992).
Однако предлагаемые к настоящему времени модели “узнавания” представляют собой вариации соответствий геометрических структур на поверхности контакта “ДНК— пептид”. Пока нет четко установленных соответствий между последовательностью нуклеотидов сайта связывания и аминокислотной последовательностью регуляторного пептида — ФТ (Pabo, Sauer, 1992). Можно только предполагать, что модуляция генетической активности клеток под действием олигопептидов группы цитомединов определяется их сайт- специфическим связыванием с промотерными участками ДНК хроматина (Морозов, Хавинсон, 1985).
Кроме пептидов, связанных с промотерными участками ДНК, известны пептиды, которые контролируют посттранскрипционные процессы с участием вновь синтезированной мРНК. Отмечено, что их аминокислотная последовательность содержит многочисленные повторы дипептидного блока КН (до 15 на молекулу), хотя дополнительных исследований для уточнения, какие именно специфические сайты на цепи мРНК отвечают за связывание этих блоков, не проводилось (Adinolfi et al., 1999).
За последнее десятилетие достигнуты определенные успехи в области исследования молекулярных механизмов, определяющих различия между нормальным и патологическим делением клеток. В разных культурах клеток обнаружено семейство факторов деления, которые действуют подобно убиквитину, но при этом контролируют длину теломеров (Tanaka et al., 1999). Теломеры — это концевые структуры ДНК в хромосоме, в основе функционирования которых лежит способность гуанозина образовывать самоассоциаты. Теломеры представляют собой специализированные ДНК-полипептидные комплексы. Они защищают хромосомы от сшивания конец в конец и от действия эндонуклеаз. Некоторые авторы считают, что теломеры могут служить также для узнавания гомологичных хромосом в процессе мейоза. Длина теломеров неодинакова на разных стадиях клеточного цикла и в разных тканях, однако она укорачивается при каждой репликации. Поэтому клетка может делиться только ограниченное число раз. На конце теломеры имеют подвешенный (не спаренный) участок G-обогащенной цепи ДНК. На базе этого “хвостика” с участием теломеразы инициируется синтез второй нити, в результате которого сохраняется длина хромосомы (Ильичева, Флорентьев, 1992). Предполагалось, что теломераза, т. е. ДНК-полимераза, участвующая в образовании теломеров, может значительно продлить жизнь клетки, увеличивая число ее нормальных делений. На культуре ткани было показано, что введенная теломераза обладает способностью поддерживать постоянную длину теломерных участков, в результате чего клетки приобретают способность к неограниченному, но не злокачественному размножению. Однако дополнительные эффекты — неполная репликация теломеров и торможение репарации цепей главной последовательности ДНК — вызывают сомнение в том, что только с помощью одной теломеразы можно решить проблему продолжительности жизни клетки (Егоров, 1999).
Нормальный жизненный цикл клетки после последнего деления завершается апоптозом — организованной деструкцией клетки. Возможен также некроз — патологическое разрушение и разложение элементов клетки под действием внешних факторов — инфекции, отравления, остановки метаболизма или механического повреждения.
Нормальный апоптоз протекает как упорядоченный процесс под контролем генетической программы. Основным регулятором апоптоза у млекопитающих явялется ген bcl-2, активная экспрессия которого тормозит развитие апоптоза (Хавинсон, Кветной, 2000). Апоптотический процесс начинается в клеточном ядре с характерной конденсации и фрагментации хроматина с последующей фрагментацией ядерной мембраны, так что каждый фрагмент хроматина оказывается упакованным в мембранную оболочку. На протяжении этой фазы плазматическая мембрана не повреждена и в цитоплазме изменений не наблюдается. Затем начинается сегрегация цитоплазмы и внутриклеточных органелл, так что их части оказываются заключенными в мембранные везикулы, и клетка исчезает. Такое саморазрушение не сопровождается выделением токсинов и экономит цитоплазматический материал для дальнейшего использования. По-видимому, оставшиеся от клетки везикулы могут быть поглощены по механизму эндоцитоза популяцией окружающих клеток, в том числе дочерних (Re et al., 1994). В этой последовательности событий заключается принципиальное отличие апоптоза от некроза, при котором компоненты мембраны, ядра и цитоплазмы подвергаются глубокому гидролизу, а освобожденные из лизосом ферменты токсически действуют на окружение гибнущей клетки, так что все продукты некроза должны быть удалены из организма (Куций и др., 1999). При некрозе возможна не только гибель клетки, но и гибель целого органа или организма. Возрастная инволюция ключевых органов и тканей приводит к нарушению контроля за физиологической гибелью клеток и, как следствие, увеличивается число некротизированных клеток (Хавинсон, Кветной, 2000). В настоящее время оценка количества клеток, входящих в апоптоз, является значимой в медицинской практике при клинико-иммунологическом обследовании (Ярилин и др., 2000).