Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Взаимодействие пептидов с хроматином клеточного ядра
Модельные и природные нуклеопротеиновые комплексы
Помимо того что молекула ДНК представляет собой способ хранения генетической информации, она, как было показано в разделах 3.1 и 3.2, является макромолекулой с особыми физико-химическими характеристиками и обладает уникальными регуляторными свойствами. В частности, известно, что в клетках и тканях ДНК способна проходить через клеточную и ядерную мембраны (Simon, 1992). После этого макромолекула может быть расщеплена специфическими нуклеазами, а ее фрагменты способны принять участие в регуляции некоторых процессов клеточного цикла. Например, биологическая активность фрагментов ДНК была использована при создании иммуномодулятора Деринат, который представляет собой 1.5%-ный раствор высокоочищенной натриевой соли нативной ДНК (дезоксирибонуклеат натрия) из молок осетровых рыб, деполимеризованной ультразвуком и растворенной в 0.1%-ном водном растворе хлорида натрия (Урсова, 2000).
Повышение способности биоактивных макромолекул проникать сквозь клеточные мембраны составляет одну из важных задач современной биотехнологии и медицины. Трудности, связанные с преодолением мембранного барьера клеток, ограничивают возможности направленного транспорта лекарств, генетической трансформации клеток, регуляции внутриклеточных процессов экзогенными белковыми факторами (Марьянович, Поляков, 1991). Одним из подходов к преодолению подобных трудностей является комплексообразование биологически активных веществ с полимерами, которое препятствует деградации белковых факторов гидролитическими ферментами либо придает им недостающие свойства для проникновения в клетку. Нуклеиновые кислоты удовлетворяют всем требованиям, необходимым для полимеров-носителей, и в первую очередь обладают биосовместимостью (Панарин, 1989). При образовании Интерпол и электролитных комплексов (ИПЭК) нуклеиновых кислот с линейными синтетическими поликатионами происходит кооперативное связывание электростатически комплементарных цепей, сопровождающееся экранированием заряда фосфатных групп нуклеиновой кислоты, которое приводит к формированию гидрофобного участка в макромолекуле. Число и протяженность таких участков задаются степенью полимеризации блокирующего поликатиона и составом поликомплекса. Для проявления биологической активности нуклеиновой кислоты необходимо ее специфическое узнавание белками-регуляторами и ферментами. Далеко не всегда образование ИПЭК приводит к потере возможности такого распознавания. Например, проведенные исследования показали, что поли-N-этил-4-винил-пиридиний бромид, связанный с ДНК, не препятствует ее специфическому узнаванию. Поликатион перемещается по цепи ДНК с одних участков на другие, открывая места для рестрикции. Эксперименты по оценке эффективности трансформации указывают на перспективность применения таких комплексов для генной инженерии (Кабанов и др., 1989).
В то же время чужеродная ДНК может встраиваться в геном других клеток и изменять набор продуктов эндогенного белкового синтеза. В ряде работ (Кабанов, Кабанов, 1994; Дебабов, 1997) определены перспективы использования этого свойства для ДНК-вакцинации и генотерапии, а также для доставки генетического материала в клетку. Однако до настоящего времени в полной мере не исследованы свойства ДНК как поверхностно-активного вещества. Эти исследования могли бы прояснить механизмы проникновения макромолекул таких размеров через цитоплазматическую мембрану и обосновать с точки зрения коллоидной химии возможность введения экзогенной информации в геном клетки.
Для направленной доставки чужеродного генетического материала в клетку без повреждения ее мембраны было предложено использовать ИПЭК инсулин-поли-L-лизин-ДНК (Розенкранц и др., 1990). Инсулин является лигандом, который специфически узнает рецептор на поверхности клетки, а поли-L-лизин обеспечивает его нековалентную связь с ДНК. Такой конъюгат обеспечивает селективную и целенаправленную доставку чужеродного генетического материала в клетки млекопитающих и растений посредством рецептор-опосредованной интернализации (эндоцитоза). Была также доказана эффективность этого метода трансфекции и показана целесообразность его применения in vivo.
Изучение селективности связывания ДНК с модельными неспецифическими белками, которые различаются кислотно-основными свойствами и не являются типичными компонентами клеточного ядра, представляет интерес для понимания свойств ДНК как полимера-носителя, на базе которого формируются нуклеопротеиновые комплексы с различными физиологическими свойствами. Нами было проведено изучение количественных закономерностей и механизмов образования подобных комплексов в модельных системах (Ряднова и др., 2000а); были исследованы закономерности связывания ДНК из селезенки, крупного рогатого скота с глобулярными белками, которые различаются кислотно-основными свойствами: пепсином (рК = 2.0), инсулином (рК = 5.4), кортексином (рК = 9.5), цитохромом С (рК = 10.6) и протамином (рК = 11.5). В физиологических условиях суммарный заряд этих белков варьировал от 36- для пепсина до (30—32)+ для протамина. Несмотря на то что ДНК несет отрицательный суммарный заряд на своей поверхности, в интервале ионной cилы от 0.1 до 0.5 н наблюдается образование устойчивых нуклеопротеиновых комплексов ДНК со всеми исследованными белками. Причем при комплексообразовании не происходит “расплетания” двухцепочечной молекулы нуклеиновой кислоты, о чем бы свидетельствовал гиперхромный эффект — резкое увеличение поглощения в УФ-области при длине волны 260 нм. На рис. 13 представлена хроматография и рехроматография комплекса ДНК—инсулин на сефадексе G-150 при ионных силах раствора 0.3 и 0.5 н. На хроматограмме регистрируются два пика. Первый пик выходит c объемом задержки колонки, второй пик — с объемом, значительно превышающим объем задержки свободного белка, не связанного в комплекс. На рехроматограмме (рис. 13, Б) высокомолекулярной фракции обнаруживается только пик нуклеопротеинового комплекса, что свидетельствует о его устойчивости даже при повышенной ионной силе раствора (Шатаева и др., 1999).
Во всех исследованных системах процесс комплексообразования проходил по кооперативному механизму, но в каждом случае стехиометрия и прочность связывания ДНК с белками зависели от концентрационного соотношения компонентов в комплексе и от природы белка (Ряднова и др., 2000а).
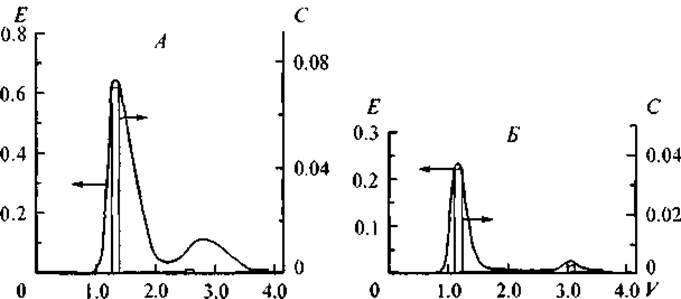
Рис. 13. Гель-хроматография комплекса ДНК—инсулин (Sephadex G-150).
А — гель-хроматография исходного раствора, ионная сила 0.3 н; Б — рехроматография первого пика хроматограммы комплекса ДНК—инсулин, ионная сила 0.5 н. Е — оптическая плотность при длине волны 260 нм; V — относительный объем выхода; С — концентрация белка (мг/мл).
Как уже отмечалось, нуклеиновые кислоты очень перспективны для использования в качестве полимерных носителей биологически активных веществ с целью защиты последних от ферментативного гидролиза и облегчения их достави к органу- или клетке-мишени. Нами была исследована устойчивость комплексов ДНК с инсулином, пепсином и кортексином к гидролизу ДНКазой и трипсином. Оказалось, что эти ферменты не разрушают комплексы и не гидролизуют белок, связанный в комплекс. Это, безусловно, свидетельствует о перспективности применения комплексов ДНК с белками и пептидами для создания пероральных лекарственных форм препаратов, обладающих регуляторными функциями.
Известно, что конформация ДНК является важным фактором как для реализации генетической программы клетки, так и для проникновения экзогенной ДНК в ядро. В ряде работ было показано, что при взаимодействии ДНК с щелочными белками класса гистонов происходит компактизация макромолекулы, степень которой зависит от весового соотношения ДНК/гистон (Мартынкина и др., 1991, 1998). Нами также было показано, что процесс комплексообразования ДНК зависит от исходного количественного соотношения компонентов в растворе и определяет степень (плотность) заполнения молекулы ДНК белком. В свою очередь степень заполнения определяет морфологию образующихся нуклеопротеиновых комплексов (НПК). На рис. 14 представлены изменения характеристической вязкости растворов ДНК от плотности заполнения жесткоцепной макромолекулы ДНК глобулярными молекулами белка. Очевидно, что при увеличении плотности заполнения ДНК белком характеристическая вязкость растворов НПК уменьшается. Предельные значения характеристической вязкости НПК при максимальном заполнении ДНК глобулярными белками очень близки для всех исследованных систем. Однако процессы компактизации ДНК при ее постепенном заполнении белками, различающимися кислотно-основными свойствами, идут по-разному. В частности, при взаимодействии ДНК с инеулином происходит постепенное уплотнение структуры комплекса, затем образование конфигурации “ожерелье”, аналогичной обнаруженной при взаимодействии ДНК с гистонами (Киселева и др., 1998). По-видимому, именно компактизация структуры комплекса ДНК—инсулин обеспечивает его устойчивость при увеличении ионной силы раствора и действии гидролитических ферментов. В связи с тем что получение новых лекарственных форм инсулина является насущной проблемой эндокринологии (Власов и др., 1988; Валуев и др., 1998), представляется целесообразным продолжение исследований комплексов ДНК—инсулин и изучение биологической активности инсулина, включенного в НПК.
При связывании ДНК с цитохромом С процесс компактизации протекает намного интенсивнее. Уже при низких концентрациях белка образуются нелинейные структуры типа “ожерелье”, так как щелочная природа боковых групп цитохрома С облегчает его локальные многоточечные взаимодействия с фосфатными группами ДНК. Поэтому при взаимодействии ДНК с цитохромом С не возникает надмолекулярных структур НПК.
В случае образования комплекса ДНК с пепсином (самым кислым из всех исследованных белков) снижение характеристической вязкости НПК наблюдается уже при невысоком содержании белка в системе. Очевидно, что вопрос о механизме образования комплексов ДНК с кислыми белками требует дальнейших исследований и расширения методических подходов, так как именно кислые регуляторные белковые факторы хроматина участвуют в расплетании двойной спирали ДНК (Ряднова и др., 2000а).
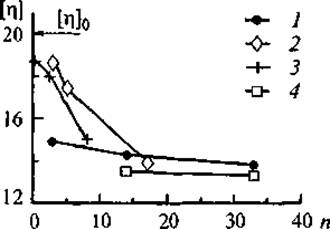
Рис. 14. Зависимость характеристической вязкости ДНК [η] (дл/г) и ее комплексов от количества связанного белка.
[η]о — свободная ДНК; нуклеопротеиновые комплексы; 1 — ДНК—цитохром С, 2 — ДНК—инсулин, 3 — ДНК—пепсин, 4 — ДНК—кортексин. n — среднее количество молекул белка, связанных с молекулой ДНК.
Исследование концентрационных закономерностей формирования модельных комплексов ДНК с белками и оценка их устойчивости в физиологических условиях позволяют экстраполировать эти закономерности на природные НПК, выделенные из разных тканей. Применение модельных или природных НПК в медицинских целях для коррекции функций поврежденных или стареющих тканей облегчается из-за высокой устойчивости этих препаратов к действию гидролитических ферментов желудочно-кишечного тракта.
Перспективность проведенных в этом направлении исследований подтверждается эффективностью природных НПК, выделенных из различных органов и тканей, — цитаминов, применяемых в медицинской практике для коррекции физиологических нарушений отдельных функций организма, в частности при ослаблении иммунитета и памяти в результате стресса и физических нагрузок (Морозов и др., 2000а; Хавинсон и др., 2001г).
Технологический прием, положенный в основу получения природных нуклеопротеиновых комплексов, состоит в том, чтобы в условиях мягкого щелочного гидролиза клетки сохранить структурные элементы хроматина, в которых эндогенные регуляторные пептиды естественно объединены и связаны с соответствующими специфическими участками ДНК. Одновременно на стадии экстракции протекает частичный гидролиз линкерных участков ДНК сопутствующими эндогенными ДНКазами. Продукты такого гидролиза (олигомеры) отделяются на стадии осаждения НПК.
Присутствие гликолипидных и фосфолипидынх компонентов мембран в препаратах, полученных на первом этапе выделения, затрудняет растворимость комплексов. Делипидизация препаратов с помощью хлороформа, который является универсальным растворителем для всех классов липидов (лецитинов, цефалинов и сфингомиелинов), увеличивает растворимость НПК и улучшает качество хроматографического анализа состава этих комплексов (Препаративная биохимия липидов, 1981).
В зависимости от типа ткани, из которой выделены НПК, составы препаратов различаются соотношением белков и липидов. Содержание нуклеиновых кислот практически одинаково во всех препаратах, поскольку клетки всех дифференцированных тканей организма содержат одинаковый набор хромосомных нуклеиновых кислот.
Для оценки устойчивости полученных природных препаратов НПК по отношению к ферментативному гидролизу в желудочно-кишечном тракте использовали энзиматическую обработку этих комплексов. Как и в случае модельных НПК, после ферментативной обработки природных НПК в их высокомолекулярной фракции сохраняются полипептиды, прочно связанные с ДНК. Это является косвенным подтверждением того факта, что подобранные условия разрушения клетки и клеточного ядра на стадии получения препаратов НПК позволяют сохранить устойчивые элементы структур хроматина. Методами хроматографического анализа в препаратах НПК головного мозга обнаружены белки с молекулярными массами в области 20—24 кДа, которые, по-видимому, могут быть идентифицированы как кислые белки группы BASP, локализованные в синаптической области нейронов (Mosevitsky et al., 1994). Кроме того, во всех природных препаратах НПК содержатся низкомолекулярные пептиды — аналоги цитомединов (Кузник и др., 1995).
Проведенные физико-химические исследования послужили основанием для использования природных НПК в качестве пероральных лекарственных форм и пищевых добавок (Ряднова и др., 20006).