Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Спеціальна частина
Алкалоїди
Біогенні аміни та протоалкалоїди
У рослинах при дисиміляції амінокислот (декарбоксилюванні) і при розкладанні білків або алкалоїдів утворюються так звані біогенні аміни. Відповідно амінокислоти, з яких починається біосинтез алкалоїдів, називають алкалоїдогенними.
Назва «амін» походить від слова аміак. Це похідні NH3, у яких атоми водню заміщені на органічні радикали. Аміни мають основний характер, що обумовлено наявністю в атомі азоту неподіленої пари електронів. Приєднуючи протон, вони утворюють солі. У залежності від кількості радикалів (—R) аміни поділяють на первинні, вторинні і третинні. Похідними амінів є четвертинні амонієві солі, в яких атом азоту чотирьохвалентний. Основність залежить від природи і кількості радикалів, які бувають однаковими і різними. Первинні аміни мають менш лужний характер, аніж вторинні. У третинних амінів основність зменшена внаслідок просторових ускладнень.
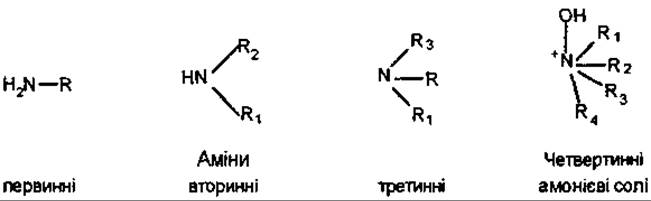
У залежності від будови аміни поділяють на аліфатичні (алкіламіни) ароматичні. До перших належать, наприклад, аміноспирти (аміноалкоголі, гідрооксиаміни), до других — амінофеноли. Відомі також циклічні аміни, наприклад, піперидин, хінуклідин. Більшість алкалоїдів є третинними амінами; незначна кількість відноситься до вторинних амінів і похідних четвертинних амонієвих основ.
Аліфатичні аміни — це основи, що за силою наближаються до NH3 (властивості основ обумовлені вільною парою електронів поблизу атома N). З водою аліфатичні аміни дають гідроксиди алкіламонію, що мають сильно лужну реакцію. Ароматичні аміни — значно слабші за основу, внаслідок сполученості неподіленої пари електронів азоту з електронами ароматичного ядра. При взаємодії з мінеральними кислотами аміни утворюють солі (наприклад, R—N+H3 СІ-).
За агрегатним станом аміни бувають кристалічні, рідкі і газоподібні. На відміну від алкалоїдів, аміни звичайно легко розчинні у воді і погано розчинні в органічних розчинниках. Деякі з них, наприклад, первинні аміни, переганяються з водяною парою. Подібно до алкалоїдів, третинні аміни і четвертинні солі дають забарвлення з реактивом Драгендорфа; первинні і вторинні реагують з розчином нінгідрину й утворюють характерні забарвлення. Ці реакції використовують для ідентифікації амінів на паперових та тонкошарових хроматограмах.
Аліфатичні аміни у відповідних дозах вражають нервову систему, порушують проникність стінок кровоносних судин, клітинних мембран і функції печінки з розвитком дистрофії. Ароматичні аміни викликають утворення метгемоглобіну, який пригнічу є нервову систему. Деякі ароматичні аміни — канцерогени, що викликають рак сечового міхура у людини.
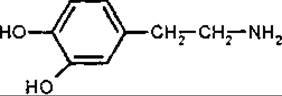
Аміни присутні у багатьох видах лікарської рослинної сировини, але їх не відносять до головних діючих речовин. Аміни містить трава ефедри — Herba Ephedrae, трава грициків — Herba Bursae pastoris, трава козлятника — Herba Galegae, трава буквиці — Herba Betonicae, трава собачої кропиви — Herba Leonuri тощо. Путресцин і кадаверин знайдені у маткових ріжках (Secale cornutum), грибах, беладонні (Atropa belladonna), блекоті (Hyoscyamus spp.), дурмані (Datura spp.). У паростках сої (Glycine hispida) міститься кадаверин, у маткових ріжках (Secale cornutum) і пагонах омели білої (Viscum album) — тирамін, у маткових ріжках, томатах (Solanum lycopersicum), шпинаті (Spinacia spp.) й екстракті з дріжджів — гістамін. У багатьох квітках міститься ізоаміламін, що утворюється внаслідок декарбоксилювання лейцину, й ізобутиламін — з валіну. Треба мати на увазі токсичну і наркотичну дію певних амінів при фармакологічній характеристиці лікарської рослинної сировини.
Алкіламіни і четвертинні амонійні сполуки
Диметиламін — летючий біогенний амін; міститься у грибах, квітках глоду Crataegus spp. (Rosaceae), є також продуктом розпаду холіну.
Триметиламін — дуже поширений біогенний амін; виявлений у грибах і рослинах, утворюється також при розпаді холіну. Диметиламін і триметиламін є продуктами гниття риби і мають відповідний запах.
Коламін — рідкий маслянистий біогенний амін, що утворюється при декарбоксилюванні серину. Дуже поширений у рослинному світі як складова частина деяких фосфоліпідів (кефалінів), входить до складу лецитину. У вільному стані міститься у глоді.
![]()
Коламін
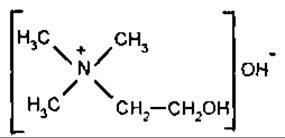
Холін
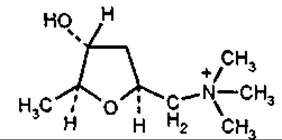
Мускарин
Холін (триметилетаноламін) — важлива біологічна сполука, відноситься до четвертинних амінів. Є складником лецитинів, що належать до фосфоліпідів. Міститься в тканинах рослин, тварин, людини (особливо багато в нервовій тканині і м’язах), переважно у складі клітинних мембран. Холін є в траві собачої кропиви (Leonurus cardiaca), оплоднях квасолі (Реrісаrрiun Phaseoli), насінні олійних рослин, буряках, у яєчних жовтках тощо. Добова норма холіну для дорослої людини 500-1000 мг. Холін у їжі може бути частково замінений на метіонін. Як лікувальний засіб застосовують при захворюванні печінки. Похідне холіну — холін-хлорид належить до вітамінів групи В.
Ацетилхолін — природна речовина, хімічний передавач нервового збудження у холінергічних синапсах. Синтезується в живих організмах з холіну й оцтової кислоти за участю ензиму холінацетилтрансферази і розкладається під впливом холінестерази. Міститься у грибах, рослинах, наприклад, у грициках (Capsella bursa pastoris, Brassicaceae), кропиві (Urtica dioica, Urticaceae) тощо.
Мускарин — четвертинний амін. Відомий здавна як складник отруйного червоного мухомора Amanita muscaria. Ліки з гриба використовують у гомеопатії при атеросклерозі, невралгії та зниженні загального тонусу. Отруйний мускарин міститься також у деяких пластинчастих грибах видів іноцибе (рос. волоконница) (Inocybe patouillardii, I. fastigiata), сироїжці блювотній (Russula emetia) тощо.
Фенілалкіламіни
ß-Фенілетиламін — фізіологічно активна речовина, бактерицид, репелент проти гризунів; ідентифікований в омелі білій (Viscum album, Loranthaceae) і видах глоду (Crataegus spp., Rosaceae). Серед природних і синтетичних похідних фенілетиламіну є сполуки з дуже високою біологічною активністю (симпатоміметичні засоби, психостимулятори, анорексигени тощо).
Дофамін (3,4-діоксифенілетиламін) — важлива фізіологічно активна речовина, відноситься до катехоламінів, є проміжним продуктом у біосинтезі норадреналіну з тирозину. Дофамін — це специфічний нейромедіатор для дофамінових рецепторів. Крім того, дофамін — попередник меланіну, норадреналіну й адреналіну. Зниження кількості дофаміну у нервовій тканині призводить до паркінсонізму. Дофамін міститься у саротамнусі віниковім — дерезі (Sarothamnus scoparius, Fabaceae), бананах (Musa sapientium, Musaceae). Біогенетичним прекурсором дофаміну є L-ДОФА (3,4-дигідроксифенілаланін).
![]()
ß-Фенілетиламін
L-ДОФА
Дофамін
Адреналін [1-(3.4-дигідроксифеніл)-2-метиламіноетанол] — надзвичайно фізіологічно активний гормон мозкової тканини надниркових залоз, який видобувають із залоз великих тварин або синтезують хімічно. L-ізомер у 15 разів активніший за D-адреналін. При взаємодії з адренорецепторами викликає звуження дрібних кровоносних судин, підвищення артеріального тиску, посилення роботи серця, розслаблення мускулатури бронхів і кишечника. При емоційних навантаженнях, особливо у стресовій ситуації, м’язових перевантаженнях, зниженні рівня цукру кількість адреналіну у крові різко зростає, що забезпечує адаптацію організму до нових умов. Адреналіну гідрохлорид і гідротартрат застосовують у медицині при захворюваннях серцево-судинної системи, шоковому стані, отруєннях, алергічних захворюваннях, астматичних нападах тощо.
Адреналін
Норадреналін
Норадреналін [1-(3,4-диоксифеніл)-2-аміноетанол], утворюється з дофаміну, подібно до якого є медіатором нервового збудження у симпатичній нервовій системі. Активує аденілатциклазу. що запускає механізм розщеплення глікогену і ліполіз. За судинозвужуючою активністю сильніший за адреналін, але спазмолітична дія його слабша; менше впливає на обмін речовин (не підвищує рівень цукру в крові). У мікрокількості міститься у бананах, картоплі. померанці (Citrus aurantium, Rutaceae). Норадреналіну гідротартрат застосовується у медицині.
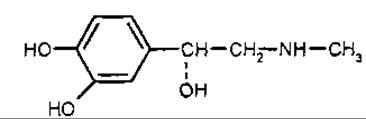
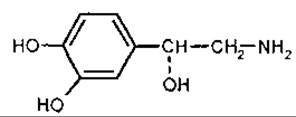
L-ефедрин [1-феніл-2-метиламінопропанол-1] — субстанція, яку традиційно відносять до екзоциклічних алкалоїдів. Біогенетично походить від фенілацетилкарбінолу. Ефедрин був відкритий у 1887 р. японським хіміком Нагаті. У 1893 р. німецький хімік Мерк відкрив псевдоефедрин. Ізомери ефедрину знайдено в ефедрі (Ephedra spp., Ephedraceae), родині Celastraceae. тисі ягідному (Taxus baccata, Тахасеае) тощо. Ефедрин має два асиметричні атоми вуглецю, тому існують чотири оптично активних ізомери ефедрину та два рацемати. Найбільш важливе медичне значення має еритро-ізомер ефедрину та псевдоефедрин (правообертаючий треоізомер). Ефедрин збуджує адренореактивні системи та викликає звуження судин, прискорення роботи серця, підвищення артеріального тиску, розширення бронхів, зіниць, гальмування перистальтики кишок, підвищення обміну речовин тощо. На дихальний центр ефедрин діє збудливо. Препарати ефедрину застосовують як адреноміметичні засоби, що наближаються до впливу адреналіну, але викликають триваліший ефект.
D-норпсевдоефедрин (катін) — головний алкалоїд листя східно-африканської рослини ката — арабський чай (Catha edulis, Celastraceae). Листя кати в арабських країнах і Африці використовують як збуджуючий засіб і допінг. Дія пов’язана з наявністю катіну, який є інгібітором МАО (моноамінооксидази) і має властивості збудливі й ейфоричні. Кетон катінон діє відповідно і навіть сильніше.
![]()
L-Ефедрин
![]()
О-Норпсевдоефедрин (катін)
Капсаїцин (ваніліламід 7-метилоктен-5-ової кислоти) вперше отриманий у 1875 р. з плодів перцю (Fructus Capsici), потім синтезований. Біохімічними попередниками капсаїцину є валін і лейцин. Традиційно капсаїциноїди відносять до протоалкалоїдів, незважаючи на те, що це аміди, які мають фізико-хімічні властивості фенольних сполук. Вони розчинні у лугах, утворюють феноляти, а не солі за амідним угрупуванням. При спалюванні порошку перцю виділяється їдкий дим, який індійці використовували як «задушливий газ» у бою.
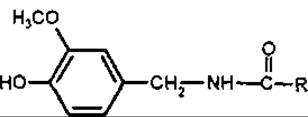
Капсаїциноїди
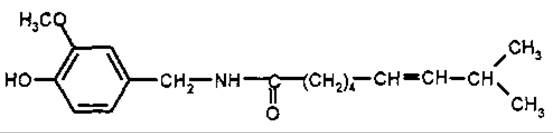
Капсаїцин
Капсаїциноїди подразнюють дихальні шляхи і викликають печію шкіри при концентрації меншій за 0,0004 мг/л, що обумовлено подразненням больових і термічних рецепторів. Гострий смак капсаїциноїдів відчувається навіть при розведенні 1:100 000; вони викликають апетит, виділення травних соків, посилюють перистальтику. В останніх публікаціях є довідки про імунотропну дію капсаїциноїдів.
Мескалін — біогенний амін з галюциногенними властивостями; міститься у деяких кактусах, наприклад Anhalonium lewinii (пейотль) і Opuntia spp., Cactaceae. З лікувальною метою не використовують.
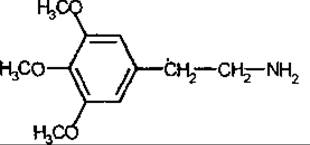
Мескалін
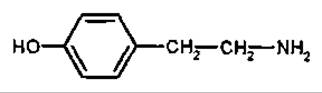
Тирамін
Тирамін — біогенний амін, що виникає при декарбоксилюванні амінокислоти тирозину, має будову, що нагадує адреналін. Встановлена наявність тираміну у грициках (Capsella bursa pastońs, Brassicaceae), омелі білій (Viscum album, Loranthaceae).
Індолакліл аміни
Триптамін — біогенний амін, що утворюється при декарбоксилюванні амінокислоти триптофану. Ця амінокислота відіграє важливу роль у біогенезі алкалоїдів як один із прекурсорів. Триптамін знайдений у кропиві дводомній (Urtica clioica, Urticaceae) і деяких грибах.
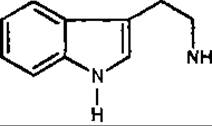
Триптамін
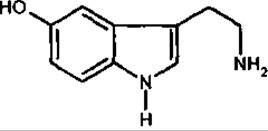
Серотонін
Серотонін (5-гідрокситриптамін) походить з триптофану. Належить до гормоноподібних біогенних амінів. Серотонін взаємодіє з рецепторами пре- і постсинаптичних мембран, є медіатором збудження у центральній нервовій системі, впливає на тонус судин, збільшує кількість тромбоцитів крові, підвищує стійкість капілярів, бере участь у регулюванні функцій травної, видільної й ендокринної систем. Його антагоніст на рівні постсинаптичних мембран — диетиламід лізергінової кислоти (LSD). З порушенням обміну серотоніну пов’язують дію галюциногенів (наприклад, диетиламіду лізергінової кислоти). Адипінат серотоніну застосовується у медицині. У мікродозах серотонін вилучений з бананів і кропиви.
Похідні гістидину та гуанідину
Гістамін — продукт декарбоксилювання гістидину. Це дуже сильний судинозвужуючий агент і медіатор алергічних реакцій, у значних кількостях звільнюється з депо при травматичному шоку і в зоні запалення.
Гуанідин походить з гістидину і біогенетично пов’язаний з пуриновою основою гуаніном. Знайдений у деяких рослинах родини бобових — горошку посівному (Picia sativa), сої (Glycine soja) тощо. Це структурний фрагмент нуклеїнових кислот, яєчного аргиніну, стрептоміцину, фолієвої кислоти тощо. Характер його дії на організм подібний до гістаміну. Деякі похідні гуанідину мають бактерицидні і фунгіцидні властивості.
![]()
Гуанідин
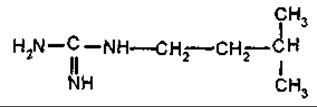
Галегін
Галегін — похідний гуанідину, діє гіпоглікемічно, що обумовлює цукрознижуючу активність козлятника (Galega officinalis, Fabaceae).
Сферофізин [1-гуанідино-4-(ізоамілен-1-іл-аміно)-бутан] — основна фармакологічно активна сполука сферофізи солонцевої (Spherophysa salsula, Fabaceae), що виділена у 1944 р. співробітниками О. П. Орєхова. Алкалоїд блокує н-холінореактивні системи вегетативних гангліїв. Вироблявся промисловістю як гіпотензивний і матковий засіб.
У деяких рослинах амінокислоти в процесі біосинтезу повністю метилюються і перетворюються на бетаїни. Це внутрішньосольові форми сполук, які містять карбоксильну групу і четвертинний атом азоту. Загальну назву отримали від простішого представника, що утворюється з гліцину — бетаїну (CH3)3N+CH2COO-. Бетаїн гліцину виділений з буряка (Beta vulgaris), триптофану (гіпофарин) — з південноамериканської рослини еритрину (Erythrina hypaphorus), проліну (стахідрин) — із рослин родів каперці (Capparis), чистець (Stachys), лагохілус (Lagochilus) і буквиця (Betonica), з листків лимонових та апельсинових дерев тощо. Біогенетично стахідрин може утворюватися також з L-орнітину, тому лікарські рослини, що містять його, будуть розглянуті у розділі «Істинні алкалоїди — похідні піролідину».
Таким чином, в окрему групу протоалкалоїдів виділяють фізіологічно активні аліфатичні, фенольні, циклічні, поліциклічні карболінові сполуки, що містять азот за межами кілець. Протоалкалоїди називають ще алкалоїдами без гетероциклу, або екзоциклічними алкалоїдами.
Колхіцинові алкалоїди (трополонові алкалоїди) налічують близько 30 сполук, які утворюються головним чином, шляхом n,nr- сполучення похідних а-фенілаланіну та а-тирозину.
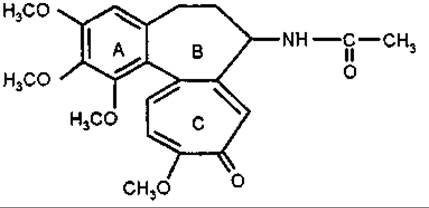
Колхіцин
Молекули колхіцинових алкалоїдів складаються з трьох конденсованих кілець, одне з яких (кільце С) є трополоном, а кільце В — гідрованим трополоном. З використанням мічених атомів було доведено, що трополонове кільце утворюється із залишку а-тирознну шляхом поширення циклу. Колхіцин не можна назвати типовим алкалоїдом, бо він є нейтральною сполукою.
Похідні відрізняються гідрокси-, метокси-, метилендигідроок- сигрупамиу кільці А і метоксигрупами кільця С. Аміногрупа кільця В первинна, або містить замісники — метильну (колхамін), ацетильну (колхіцин) та інші групи. Трополонове кільце легко трансформується в ароматичне.
Колхіцинові алкалоїди мають антимітотичну активність. Колхамін менш токсичний за колхіцин. Обидві сполуки є каріопластичними отрутами, блокують поділ клітин на стадії метафази і тому можуть затримувати розвиток злоякісної тканини. Вони також пригнічують лімфо- та дейкопоез. Раніше колхіцин і його саліцилат застосовували як болетамувальні засоби при подагрі і суглобовому ревматизмі. Колхіцин використовують у селекції для отримання поліплоїдних форм рослин.