Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Фрагментация белковых цепей - Ферментативная фрагментация
Наиболее часто для ферментативного расщепления белков на фрагменты используются пищеварительные ферменты млекопитающих. Такие, например, как трипсин, химотрипсин и некоторые другие. В отличии от амино- и карбоксипептидаз, которые действуют на концевые аминокислоты пептидных цепей и получили название экзопиптидаз, трипсин, химотрипсин и другие аналогичные ферменты расщепляют пептиды во внутренних звеньях цепи. Их называют, поэтому, эндопептидазами.
Все эти ферменты не обладают абсолютной специфичностью к природе расщепляемой связи, но в тщательно подобранных условиях они расщепляют все же предпочтительно определенные связи, т.е. проявляют так называемую.
“сайт-специфичность”. Данные по специфическому гидролизу петидных цепей некоторыми ферментами приведены в табл. 2.1.
Таблица 2.1 Специфическая активность некоторых ферментов при расщеплении пептидных цепей.
|
Протеазы с высокой специфичностью |
||||
Фермент |
рН |
Основной тип гидролиза |
Побочный тип гидролиза |
Не затрагиваемые связи |
Трипсин |
7-9 |
Лиз-↓-Х, Арг-↓-Х, |
Лиз-Про |
|
Тромбин |
8 |
Арг-↓-Х (Х=Гли, Ала, Вал, Цис, Арг, Асп |
||
Протеаза V8 из Staphylococus aureus (S.aureus) |
4 и 7.8 |
Глу-↓-Х |
Асп-↓-Х |
Глу-Про Гли-Глу |
Клострипаин |
7.7 |
Арг-↓-Х |
Лиз-↓-Х |
|
Протеаза, из подчелюстной желзы мыш |
7.5 8 |
Арг-↓-Х |
Арг-Вал Арг-Арг |
|
Протеаза A.mellea |
8 |
Лиз-↓-Х |
Арг-↓-Х |
Х-Про |
Протеаза myxobacter AL1 |
9 |
Х-↓-лиз |
||
Постпролинспецифичная протеаза |
7.5 8 |
Про-↓-Х |
Про-Про |
|
|
Протеазы с широкой специфичностью |
||||
Химотрипсин |
7-9 |
Н-↓-Х (Н=Тир,Фен,Три,Лей) |
Н-Про |
|
Термолизин |
7-8 |
Х-↓-Н (Н=Вал,Лей,Иле,Фен,Тир,Три) |
Х↓*Н-Про |
|
а-Протеаза Crotalus Atrox |
7.5-8 |
Х4-Н (Н=Вал,Лей,Иле,Фен,Тир,Три) |
||
Пепсин |
2 |
Х↓Н↓Y, X↓Глу↓Y (H=ароматический или объемный алифатический остаток) |
||
Папаин |
5 7.5 |
Фен-Х↓Y. Идет гидролиз и некоторых других пептидных связей. |
||
Эластаза |
7-9 |
N-↓-Y (N=небольшой нейтральный или гидрофобный остаток Сер,Ала,Гли,Вал,Лей) |
||
а-Литическая протеаза |
7-8 |
N-↓-Y (Аналогично эластазе) |
||
Подбор оптимальных условий для ферментативного гидролиза сводится в общем случаю к оптимизации:
> состава буфера;
> соотношения фермент: субстрат;
> температуры;
> времени проведения процесса.
Буферные системы. Обычно используют легко летучие буферные смеси. Например 1% бикарбонат аммония и 100 мМ N-этилморфолилацетат.
Соотношение фермент: субстрат - на уровне 1:50-100.
Температура - в большинстве случаев -20-37∘С. Только два фермента - термолизин и протеаза из миксобактерий сохраняют высокую активность при температурах > 40∘С.
Продолжительность гидролиза, как правило, 2-4часа. Если связь трудно расщепляемая увеличивают время до 16-24 ч.
Торможение ферментативной реакции гидролиза по истечению заданного промежутка времени можно осуществить путем:
> замораживания;
> изменения рН среды;
> введением специфичных ингибиторов.
Протеолитические ферменты подразделяются на три основных класса:
> сериновые протеазы;
> сульфгидрильные протеазы;
> металлоферменты.
Специфическими ингибиторами сериновых протеаз являются диизопропилфторфосфат (ДФФ) и фенилметилсульфофторид (ФМСД).
Последний предпочтительнее, поскольку ДФФ высоко токсичен.
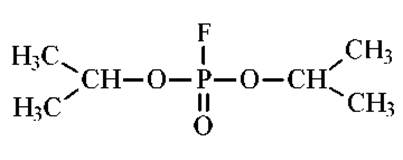
Сульфгидрильные протеазы ингибируются избытком алкилирующих агентов, например, иодуксусной кислотой. Металлоферменты ингибируют хелатирующими добавками. Это может быть в частности, этилендиаминтетрауксусная кислота (ЭДТА).