Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Осмос и мембранное равновесие
Многие биологически важные свойства белков в растворах связывают с большими размерами их молекул. Они не диффундируют через некоторые мембраны, пропускающие воду и низкомолекулярные соединения. Это позволяет используя, например, целлофановые мембраны, отделять белки от низко молекулярных примесей. Процесс такого разделения называется диализом. Большинство биологических мембран также непроницаемы для белков.
Если раствор белка отделить от дистиллированной воды полупроницаемой (проницаемой для воды и др. небольших молекул и непроницаемой для белка) перегородкой (мембранной) то молекулы воды начнут диффундировать через мембрану в раствор белка. Низкомолекулярные соединения наоборот, устремятся через мембрану в резервуар с водой. Это явление называется осмосом. В его основе лежит стремление любой термодинамической системы к выравниванию химических потенциалов во всех своих частях.
Рассмотрим этот вопрос более подробно. По определению, химический потенциал (μi) отдельного вещества или компонента смеси (термодинамической системы) в любом агрегатном состоянии - есть частная производная от свободной энергии Гиббса (G) по количеству (концентрации) этого компонента при постоянстве всех естественных параметров для G:
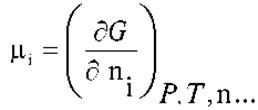
Иными словами химический потенциал - это парциальная мольная функция состояния. Очень важно уяснить, что химический потенциал по сути своей есть обобщенная сила. Он позволяет предсказать в каком направлении будет происходить обмен энергией или веществом между двумя термодинамическими системами или частями одной и той же термодинамической системы. Это направление всегда одно и то же: от системы с большой величиной μi к системе с меньшим μi. Точно так же как в механическом случае: в направлении от большей к меньшей механической силе.
С позиций химического потенциала легко понять и явление осмоса. Обратимся для этого к рис. 2.9.
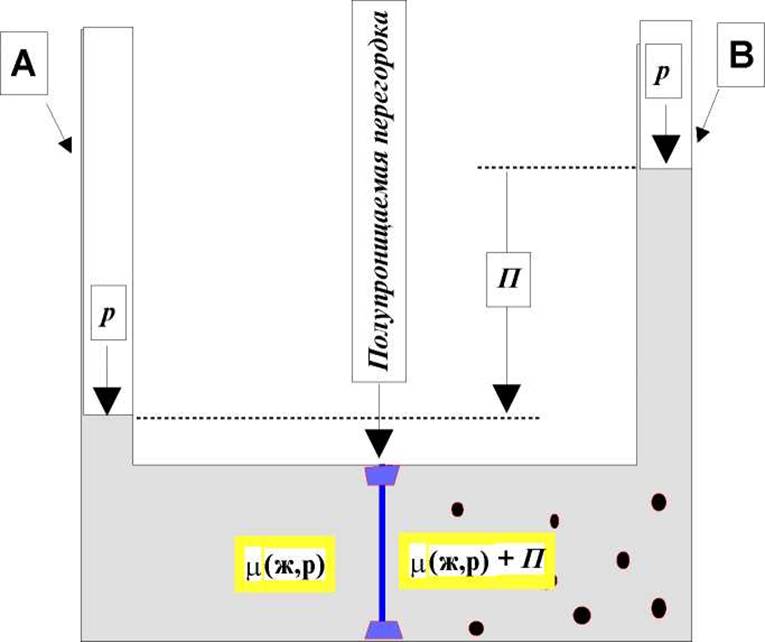
Рис. 2.9 Состояние осмотического равновесия в разделенной полупроницаемой перегородкой системе растворитель: раствор. р - атмосферное и П - осмотическое давление
Пусть в левом колене, разделенного полупроницаемой перегородкой сосуда (рис. 2.9) находится чистый растворитель. В правом - разбавленный раствор вещества, молекулы которого не могут проникать через мембрану. Они изображены темными шариками. Рис. 2.9 иллюстрирует состояние равновесия, когда уровни жидкости в левом (А) с чистым растворителем и правом (В) с раствором коленах различны из-за появившегося осмотического давления - П. Чуть позже мы скажем о нем. В исходном же состоянии, когда осмотическое давление П отсутствует величина химического потенциала растворителя в левой части сосуда определяется только свойствами самого растворителя его количеством и внешним (атмосферным) давлением - р. В правой части сосуда химический потенциал растворителя будет несколько меньше по той причине, что парциальное содержание его в растворе меньше, чем в чистом веществе. Стремясь выровнять величины химических потенциалов по обе стороны полупроницаемой перегородки молекулы растворителя начнут диффундировать через мембрану из левой части сосуда в правую. В результате, уровень жидкости в колене (В) начнет подниматься, создавая дополнительное давление - P. Это и есть осмотическое давление, за счет которого повышается величина химического потенциала растворителя в правой части сосуда. Осмотическое давление будет увеличиваться до тех пор, пока величины химических потенциалов растворителя не станут равными по обе стороны мембраны. Это состояние и изображено на рис. 2.9. С этого момента скорости диффузии молекул растворителя через полупроницаемую перегородку слева направо и наоборот станут равными. Осмотическое перекачивание растворителя прекратится. Не вдаваясь в детали явления осмоса отметим, что величина осмотического давления со стороны разбавленного раствора на полупроницаемую перегородку не зависит от природы растворенного вещества, а определяется только его концентрацией. Этот закон описывается уравнением Вант-Гоффа, которое по форме и сути совпадает с уравнением состояния идеального газа:
![]()
где ns, R, T, V - число молей растворенного вещества, универсальная газовая постоянная, температура и объем раствора соответственно.
Это уравнение выражает очень простое и практически важное свойство осмотического давления, суть которого в следующем. Растворенное и непроникаемое через полупроницаемую мембрану вещество создает в разбавленных растворах такое же по величине осмотическое давление, как если бы оно находилось в газовой фазе и занимало объем равный объему раствора. Иными словами, растворитель в явлениях осмоса - это вакуум в идеальных газофазных системах.
Явление осмоса используется практически всеми клетками и клеточными органеллами. Кроме того, оно лежит в основе ряда методов экспериментального исследования белков, в частности определения их молекулярной массы.