Принципы структурной организации белков - Г. Шульц 1982
Ковалентная структура белков
Ансамбли цепей
Функциональные и структурные домены
Общее положение о функциональной форме белка, получаемой путем синтеза полипептидной цепи на рибосомах и последующего спонтанного свертывания, с которого был начат разд. 1.1, нуждается в значительной детализации. В этой главе обсуждается ряд важных биологических фактов и явлений, позволяющих уточнить это представление.
Основная идея, заключающаяся в том, что один структурный ген* отвечает одной полипептидной цепи, эквивалентной одному функциональному звену [74], требует уточнения. В настоящее время представляется нерациональным отождествлять полипептидную цепь с функциональной единицей. Начиная с 1969 г. [75], появилось большое число данных, указывающих [76], что основной единицей следует считать «домен», а не полипептидную цепь и что все остальные категории следует сводить к этому базису.
Функциональные домены и функционально автономные области полипептидной цепи. Домены были впервые обнаружены при выявлении корреляции генной и полипептидной структур [77]. Домены представляют собой субобласти полипептидной цепи (закодированные в субобластях структурного гена), которые автономны в том смысле, что они обладают всеми характеристиками всего глобулярного белка. Многие такие субобласти были обнаружены как продукты неполного протеолиза [76]. Это означает, что индивидуальные субобласти часто можно выделить из полипептидной цепи без потери ими их свойств.
* В высших организмах менее 10 % общей нуклеотидной последовательности структурного гена, так называемые структурные зоны [78, 79], кодируют белок. Исследования генов, кодирующих глобин, овальбумин, а также некоторые белки SV40 и вируса полиомы, подтверждают мозаичный характер эукариотического структурного гена. Нуклеотидные последовательности ДНК, которые транслируются в аминокислотные последовательности, не монотонны по строению, а прерываются участками нетранслирующейся ДНК. Первичная матрица РНК содержит внутренние области, которые должны быть затем исключены, и окончательная мРНК представляет собой «перекроенный» продукт (см. краткий обзор [78]).
Значимость представления о доменах наиболее очевидна для некоторых ферментов, участвующих в биосинтезе His и Тrр (разд. 9.4). В этом случае функция белка требует большого числа доменов. Оказалось, что эту функцию могут независимо выполнять домены, которые расположены или на одной полипептидной цепи, или на отдельных полипептидных цепях, связанных невалентными силами, или на совершенно разных цепях.
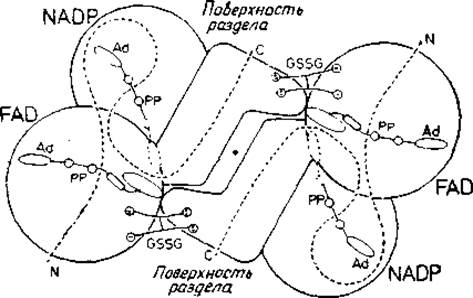
Рис. 4.1. Схема димерного фермента глутатионредуктазы.
Каждая субъединица состоит из трех доменов; одни из них присоединяет FAD (флавинаденнидинуклеотид), другой присоединяет NADP (никотинамидадениндинуклеотидфосфат), третий образует поверхность раздела. Общий ход полипептидной цепи показан пунктирной линией. Кофакторы FAD и NADP присоединяются в вытянутых конформациях. Субстрат глутатион (GSSG) помещается между субъединицами. Каждый активный центр образован четырьмя доменами [124].
Структурные домены — геометрически обособленные образования. Поскольку описанные выше субобласти идентифицируются по наблюдаемым свойствам цепи (например, лигандприсоединяющая или ферментативная активность), они представляют собой «функциональные домены» [76]. По мере развития структурного анализа белка было показано, что функциональные домены состоят из одного или более «структурных доменов». Структурные домены были обнаружены при изучении многих трехмерных белковых структур, в частности глутатионредуктазы (рис. 4.1). Это геометрически обособленные образования с молекулярной массой около 20 000. Почти все глобулярные белки можно подразделить на такие субобласти. По-видимому, большинство функциональных доменов с молекулярной массой свыше 20 000 состоят из более чем одного структурного домена. «Активный центр» такого функционального домена обычно расположен на границе двух структурных доменов.
Белки могут конструироваться с использованием модульных систем. Важная роль структурных доменов как основных единиц следует из сравнения трехмерных белковых структур. В разных белках встречаются одни и те же структурные домены, обнаруживаемые по характеристическому свертыванию цепи. Типичными примерами повторения структурных доменов являются домены иммуноглобулина (рис. 4.2), NAD-связывающий домен (рис. 5.17, б) или ТIМ-полость (рис. 5.17, д), имеющаяся в триозофосфатизомеразе и пируваткиназе [80].
Подразделение глобулярных белков на структурные домены приблизительно одинаковой величины и присутствие одинаковых структурных доменов в разных белках привели к гипотезе, согласно которой большинство белков сконструировано как модульные системы из структурных доменов в качестве модулей (см. также разд. 9.4.). В соответствии с такой гипотезой не следует придавать слишком большого значения всей полипептидной цепи, а концентрировать внимание на функциональных и, насколько возможно, структурных доменах. Соответственно, основная концепция [74] должна быть приведена к следующему виду: «одна полипептидная цепь = один или несколько функциональных доменов, один функциональный домен = один или несколько структурных доменов».