Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Структурные домены
Корреляция между близко расположенным в последовательности остатками
Структурные домены четко ограничены на картах электронной плотности. Анализ карт электронной плотности, рассчитываемых в ходе рентгеноструктурного анализа, показал, что многие белки состоят из нескольких глобулярных областей, довольно слабо связанных между собой. Эти области, четко ограниченные на картах распределения электронной плотности, получили несколько неопределенное название «структурные домены». Очевидно, что определение домена весьма нестрого и здесь может возникать много спорных ситуаций. Среди глобулярных белков четко определенные домены были обнаружены в иммуноглобулинах. Схематически они изображены на рис. 4.2, в; в этом случае домены располагаются вдоль полипептидной цепи, как жемчужины в ожерелье.
Остатки, далеко отстоящие по цепи, обнаруживают тенденцию к удаленному расположению и в трехмерной структуре. Как видно из рис. 4.2, в, полипептидную цепь можно разделить на несколько последовательно расположенных участков, которые принадлежат последовательно расположенным доменам [248]. Таким образом, остатки, которые в цепи находятся далеко друг от друга, оказываются значительно удаленными и в пространстве. Этот принцип соблюдается во всех глобулярных белках, состоящих из четко определенных доменов (табл. 5.2). Иначе говоря, доменная структура указывает на высокую степень «корреляции между близко расположенными по цепи остатками», расстояние между остатками в цепи коррелирует с их расстоянием в пространственной структуре.
Наличие корреляции между близкими в цепи остатками способствует выявлению структурных доменов. Такой способ был количественно оценен для химотрипсина, деление которого на два домена не очень ясно проявлялось на карте электронной плотности. В качестве критерия была избрана сумма всех величин, обратных расстояниям между парами остатков, которые разделены 6—25 остатками в цепи:
![]()
Результаты приведены на рис. 5.14, а. Два пика с минимумом между ними указывают на наличие двух областей, в которых остатки, близкие по цепи, в результате процесса свертывания оказались сближенными друг с другом и в пространстве. Эти области следует классифицировать как домены. Сравнение с трехмерной структурой химотрипсина показывает, что каждый домен содержит одну из показанных на рис. 5.17, г ß-структур.
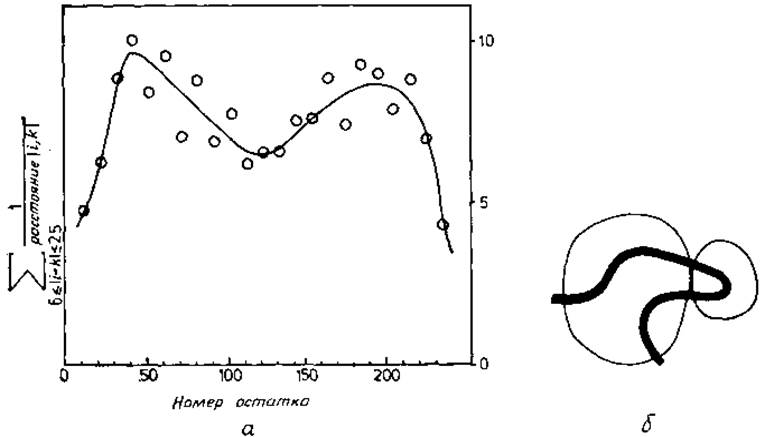
Рис. 5.14. Корреляция между соседними остатками полипептидной цепи. а — мера корреляции между соседними остатками как функция номера остатка і в химотрипсине. Для сглаживания кривой значения по 10 остаткам усреднены. Отчетливо выделяется двухдоменная структура, схематически показанная на рис. 5.17, г, б — доменная структура аденилаткиназы. Малый и большой структурные домены связаны двумя полипептидными цепями. Корреляция между соседними остатками в малом домене выражена сильнее, чем в большом.
Последовательные цепи ß-структур стремятся к близкому расположению. Отмеченная корреляция между близкими по цепи остатками проявляется не только на уровне доменов, но также и внутри их. Наглядным количественным примером может служить гистограмма расстояний в ß-структурных цепях, приведенная на рис. 5.15, а. В частности, в цепях антипараллельной ß-структуры, где чисто пептидная цепь образует два или более последовательных ß-зигзага, проявляется заметная корреляция между близкими по цепи остатками. В параллельных слоях такая корреляция слабее, однако и там она имеет достаточно важное значение.
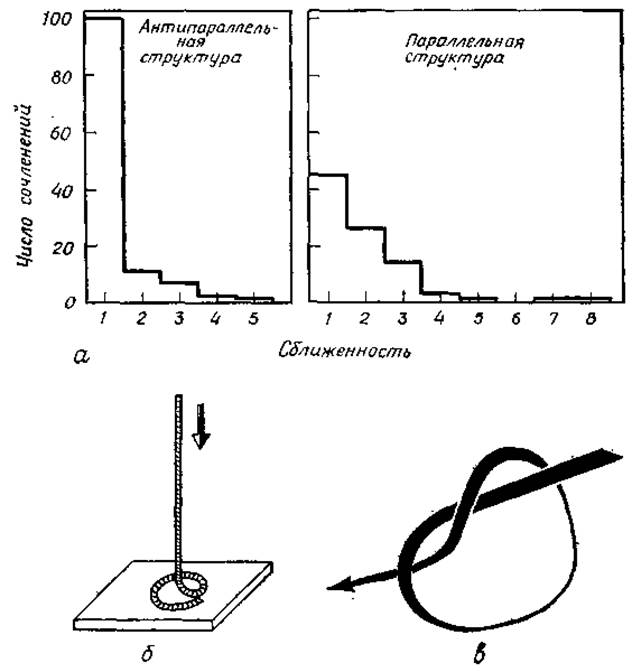
Рис. 5.15. Предпочтительные структуры глобулярных белков.
а — корреляция между соседними остатками, наблюдаемая в антипараллельной и параллельной ß-структурах. Приведено число контактов между одной цепью в ß-структуре (вдоль цепи) и ее первой, второй, ... соседними цепями [327]. 6— удерживаемой вначале за верхний конец веревке предоставляют возможность упасть. В свернутой форме веревки отсутствуют узлы и отчетливо проявляется корреляция между ее соседними частями, в — узел полипептидной цепи; экспериментально не обнаружен.
Корреляцию между близкими по цепи остатками можно интерпретировать, пользуясь как кинетическим, так и термодинамическим подходами. Корреляция между близкими по цепи остатками возникает, по-видимому, в процессе свертывания цепи. Поскольку конформаций, сближающих удаленные по цепи остатки, значительно больше, чем конформаций, сближающих близкие по цепи остатки, то процесс свертывания должен существенно зависеть от взаимодействий между последними. В противном случае уже на начальной стадии потребовалось бы опробывание слишком многих конформационных состояний, отделение правильных состояний от неправильных стало бы исключительно сложным и процесс свертывания цепи имел бы много шансов пойти по неверному пути.
С точки зрения термодинамики изложенные выше соображения выглядят следующим образом. При свертывании энтропия цепи должна понижаться (разд. 3.5). Первоначальное понижение энтропии минимально, если свертывание цепи приводит к конформации, близкой к среднестатистической конформации цепи в растворе, т. е. если оно приводит к структуре с сильной корреляцией между близкими по цепи остатками. При таком незначительном понижении энтропии не возникает первоначального (активационного) энтропийного барьера, который было бы трудно преодолеть за разумное время. Таким образом, процесс свертывания цепи может происходить постепенно, не требуя слишком большой связывающей энергии и гидрофобных сил (см. также разд. 8.3).
Учитывая корреляцию между близкими по цепи остатками, можно сравнить свертывающуюся цепь с веревкой, которую опускают вниз способом, показанным на рис. 5.15, б. Образующийся на полу клубок не беспорядочен, но характеризуется корреляцией между близкими участками, он не запутан, и веревку можно легко поднять за один конец. Эта аналогия подтверждается отсутствием «узлов» во всех известных структурах. Термин «узел» использован здесь в его обиходном смысле (рис. 5.15, б), а не в математическом (математические узлы могут существовать только в замкнутых системах).
Структурные домены, по-видимому, служат единицами свертывания белка. Корреляция между близкими по цепи остатками дает основание рассматривать домены как такие участки цепи, которые свертываются независимо друг от друга. Если это так, то структурные домены можно определить как единицы свертывания цепи, т. е. более конкретно, чем ранее. Строение химотрипсина в известной степени подтверждает такое определение [18]. Этот белок содержит 13 молекул воды между двумя доменами внутри молекулы (рис. 5.14, а). По-видимому, домены свертываются отдельно и молекулы воды задерживаются в процессе последующей ассоциации доменов. Это соображение подкрепляется тем фактом, что функциональные домены (как было выяснено биохимическими испытаниями) действительно свертываются независимо друг от друга [76, 77].
Совершенно очевидно, что большинство крупных белков можно разделить на несколько структурных доменов, содержащих 100—150 остатков, которые отвечают глобуле диаметром около 25 Å (табл. 5.2). С точки зрения свободной энергии такое ограничение величины домена является неожиданным, поскольку одна крупная глобула характеризуется значительно меньшим отношением поверхность/объем, чем несколько более мелких. В большой глобуле должно образоваться крупное гидрофобное ядро и многочисленные внутренние водородные связи: и то, и другие энергетически выгодно. Вероятно, ограничение величины необходимо для простоты процесса свертывания путем соблюдения достаточно малой длины независимо свертывающегося звена.
В некоторых случаях, как, например, в аденилаткиназе [186], имеются две области, которые можно называть доменами и которые сочлененны двумя цепями вместо одной. Как видно из рис. 5.14, б, корреляция между соседними по цепи остатками в этих двух доменах заметно отличается. По-видимому, домен с сильной корреляцией должен свертываться первым, а затем использоваться в качестве своеобразной матрицы, способствующей свертыванию другого домена.