БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 22. БИОСИНТЕЗ НУКЛЕОТИДОВ
22.6. Пуриновые основания могут использоваться повторно с помощью реакций синтеза из готовых остатков с участием ФРПФ
Свободные пуриновые основания образуются путем гидролитического расщепления нуклеиновых кислот и нуклеотидов. Пуриннуклеотиды могут синтезироваться из таких предобразованных оснований с помощью реакций синтеза из готовых остатков. Эти реакции проще, чем пути синтеза de novo, обсуждавшиеся выше, и обходятся клетке гораздо дешевле. При синтезе из готовых остатков рибозофосфатная группа ФРПФ переносится на пурин и образуется соответствующий нуклеотид.
Существуют два фермента, участвующие в реакциях синтеза из готовых остатков, с различной специфичностью. Аденин-фосфорибозилтрансфераза катализирует образование аденилата:
Аденин + ФРПФ → Аденилат + РРi
Гипоксантин-гуанин - фосфорибозилтрансфераза катализирует образование инозината и гуанилата:
Гипоксантин + ФРПФ → Инозинат + РРi
Гуанин + ФРПФ → Гуанилат + PP¡.
Многообразие и эффективность путей использования пуринов можно продемонстрировать также на примере биосинтеза гистидина. Шестичленный фрагмент пуринового кольца АТР участвует в построении имидазольного кольца гистидина (разд. 21.10). Остаток пуринового скелета тоже не пропадает впустую: он сохраняется в виде рибонуклеотида 5-аминоимидазол-4-карбоксамида, промежуточного продукта биосинтеза de novo пуринового кольца.
22.7. АМР и GMP- ретроингибиторы биосинтеза пуриновых нуклеотидов
Синтез пуриновых нуклеотидов регулируется ингибированием по принципу обратной связи на нескольких стадиях (рис. 22.10).
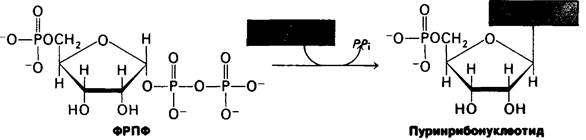
Рис. 22.10. Регуляция биосинтеза пуринов
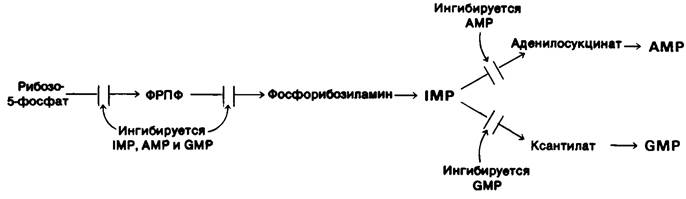
1. Концентрация ФРПФ регулируется ингибированием 5-фосфорибозил-1 -пирофосфат — синтетазы пуриннуклеотидами. Эта синтетаза ингибируется AMP, GMP и IMP.
2. Решающий этап биосинтеза пуриновых нуклеотидов - превращение ФРПФ в фосфорибозиламин путем переноса аминогруппы боковой цепи глутамина. Глутамин-фосфорибозилпирофосфат — амидотрансфераза ингибируется многими пуриновыми рибонуклеотидами по механизму обратной связи. Следует отметить, что ингибирующее действие АМР и GМР на этот фермент синергично.
3. Образование инозината- точка разветвления путей синтеза АМР и вМР. Реакции, ведущие от инозината к синтезу АМР и GМР, ингибируются по механизму обратной связи. АМР подавляет превращение инозината в аденилосукцинат, его непосредственный предшественник. Подобно этому, GMP ингибирует превращение инозината в ксантилат- непосредственный предшественник GMP.
4. GTP служит субстратом для синтеза АМР, а АТР-субстрат для синтеза GMP. Эта взаимосвязь на уровне субстратов необходима для того, чтобы сбалансировать синтез адениловых и гуаниловых рибону- клеотидов.
22.8. Пиримидиновое кольцо синтезируется из карбамоилфосфата и аспартата
В отличие от последовательности реакций синтеза пуриннуклеотидов de novo пиримидиновое кольцо вначале собирается и только затем присоединяется к рибозофосфату с образованием пиримидиннуклеотида. Донором рибозофосфата при синтезе пиримидиннуклеотидов, так же, как и при синтезе пуриннуклеотидов, служит ФРПФ. Предшественники пиримидинового кольца - карбамоилфосфат и аспартат.
Синтез пиримидинов начинается с образования карбамоилфосфата, который служит также промежуточным продуктом синтеза мочевины (разд. 18.4). Синтез этого активированного донора карбамоильной группы в клетках эукариот компарт- менгализован. Карбамоилфосфат, который используется для синтеза пиримидинов, образуется в цитозоле, тогда как карбамоилфосфат, используемый для синтеза мочевины, в митохондриях (разд. 18.5). Существуют две разные карбамоилфосфатсинтазы. Еще одно существенное различие состоит в том, что при синтезе карбамоилфосфата в цитозоле донором азота служит глутамин, а не NH4+:
Глутамин + 2ATP + HCO3- →Карбамоилфосфат + 2ADP + Рi + Глутамат.
Решающий этап в биосинтезе пиримидинов-образование N-карбамоиласпартата из аспартата и карбамоилфосфата. Карбамоилирование катализируется аспартат-транскарбамоилазой (аспартат-карбамоил-трансферазой, АТКазой), ферментом, особенно интересным с точки зрения регуляции (разд. 22.14). Пиримидиновое кольцо образуется в следующей реакции, когда карбамоиласпартат циклизуется с отщеплением молекулы воды и образованием дигидрооротата. Затем при дегидратации дигидрооротата образуется оротат.
22.9. К оротату присоединяется рибозофосфатный остаток ФРПФ
Следующий этап синтеза пиримидиннуклеотидов — присоединение рибозофосфатной группы. Оротат (свободный пиримидин) реагирует с ФРПФ с образованием оротидилата (пиримидиннуклеогид). Протекание этой реакции, которую катализирует оротидилат-пирофосфорилаза, поддерживается гидролизом пирофосфата. Затем оротидилат декарбоксилируется, образуя уридилат (уридинмонофосфат UМР)- главный пиримидиннуклеотид.
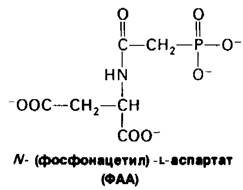
22.10. Первые три фермента биосинтеза пиримидинов синтезируются в виде одной полинентидной цепи
У Е. coli шесть ферментов, синтезирующих UMP из простых предшественников, видимо, нс связаны друг с другом. У высших организмов, напротив, несколько из этих ферментов образуют мультиферментный комплекс. Содержание этого комплекса в клетках млекопитающих сильно увеличи вается под действием N-(фосфонацетил)- L-acnapmama (ФАА), мощного ингибитора аспартат-транскарбамоилазы (АТКазы). ФАА прочно связывается с АТКазой (Кi = 10-8 М), так как имеет определенное структурное сходство с переходным комплексом, возникающим в процессе катализа (рис. 22.12). Выживающие клетки преодолевают ингибирующее действие ФАА, синтезируя в 100 раз больше АТКазы, чем нормальные клетки. Концентрации карба- моилфосфат-синтазы и дигидрооротазы также увеличиваются в 100 раз, тогда как активности ферментов, катализирующих последующие реакции биосинтеза пиримидинов, практически не изменяются. Эти данные позволили установить тот факт, что карбамоилфосфат-синтаза, аспартат- транскарбамоилаза и дигидрооротаза ковалентно связаны в составе единой полипептид ной цепи с мог. массой 200 к Да. Ферменты, катализирующие две последние реакции биосинтеза пиримидинов, орогат- фосфорибозилтрансфераза и оротидилат- декарбоксилаза, образуют другой ком
плекс. Возможно, они также ковалентно связаны. Напомним, что комплекс синтетазы жирных кислот в дрожжах состоит из двух типов полипентидных цепей, каждая из которых содержит несколько ферментов (разд. 17.20). По всей вероятности, ковалентное связывание функционально родственных ферментов - общее явление у эукариот. Это может облегчать сборку мультиферментных комплексов. Еще одно предполагаемое преимущество соединения нескольких ферментов в одну полипептидную цепь состоит в том, что они синтезируются в эквимолярных количествах.
Рис. 22.12. Структура ФАА, эффективного ингибитора АТКазы