БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 12. ГЛИКОЛИЗ
12.10. Пируват может превращаться в этанол, лактат или ацетилкофермент А
Последовательность реакций превращения глюкозы в пируват очень схожа у всех организмов и во всех видах клеток. В противоположность этому судьба пирувата в поцессах генерирования энергии обмена веществ различна. Мы рассмотрим три реакции, протекающие с участием пирувата.
1. Этанол образуется из пирувата у дрожжей и некоторых других микроорганизмов. На первой стадии происходит декарбоксилирование пирувата:
Пируват + Н+ → Ацетальдегид + СО2.
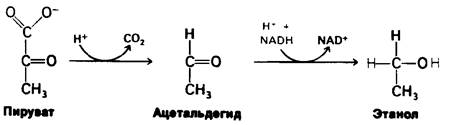
Реакция катализируется пируват-декар- боксилазой, которая содержит в качестве кофермента тиаминпирофосфат. Тиаминпирофосфат является коферментом многих декарбоксилаз (обсуждение механизма действия см. в разд. 13.10). Вторая стадия состоит в восстановлении ацетальдегида в этанол за счет NADH. Эта окислительновосстановительная реакция катализируется алкоголь-дегидрогеназой, содержащей в активном центре ион цинка.
Ацетальдегид + NADH + ⇄ Н+ ⇄ Этанол + NAD.
Превращение глюкозы в этанол называется спиртовым брожением. Суммарная реакция этого анаэробного процесса имеет следующий вид:
Глюкоза + 2 Рi + 2ADP + 2Н+→ 2 Этанол + 2СО2 + 2АТР + 2Н2O.
Важно отметить, что NAD+ и NADH не входят в это суммарное уравнение. Восстановление ацетальдегида в этанол приводит к регенерированию NAD+, который используется в реакции, катализируемой глицерапьдегид-3-фосфат-дегидрогеназой. Таким образом, в суммарной реакции превращения глюкозы в этанол нет окислительновосстановительного процесса.
2. Лактат образуется из пирувата в норме у многих микроорганизмов. Реакция имеет место также в клетках высших организмов при ограниченном поступлении кислорода (как в интенсивно работающей мышце). Восстановление пирувата за счет NADH с образованием лактата катализируется лактат-дегидрогеназой:
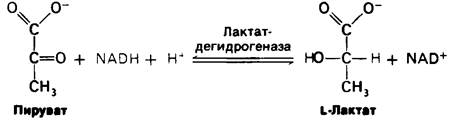
Суммарная реакция превращения глюкозы в лактат такова:
Глюкоза + 2Рi + 2ADP → 2 Лактат + 2АТР + 2Н2О.
Как и в случае спиртового брожения, окислительно-восстановительного процесса в суммарной реакции нет. NADH, образующийся в результате окисления глицеральде- гид-3-фосфата, потребляется при восстановлении пирувата. Регенерирование NAD + при восстановлении пирувата в лактат поддерживает в анаэробных условиях непрерывное течение гликолитического процесса. Если бы регенерирования NAD+ не происходило, гликолиз не мог бы идти дальше образования глицеральдегид-3-фосфата, а, следовательно, не происходило бы и образования АТР. На самом деле синтез лактата требует времени, что мы увидим в гл. 15.
3. Только небольшая часть содержащейся в глюкозе энергии высвобождается при ее анаэробном превращении в лактат (или этанол). Значительно большее количество энергии извлекается в аэробных условиях в цикле трикарбоновых кислот и в цепи переноса электронов. Включение в этот окислительный путь происходит на уровне («пункт входа») ацетил-кофермента А (ацетил-СоА), который образуется в митохондриях при окислительном декарбоксилировании пирувата:
Пируват + NAD+ + СоА → Ацетил-СоА + СO2 + NADH.
Реакция катализируется пируват-дегидрогеназным комплексом. (Более подробно она рассматривается в следующей главе.) NАD+, необходимый для этой реакции и для окисления глицеральдегид 3-фосфата, регенерирует на последнем этапе переноса электронов NADН на O2 по цепи переноса электронов в митохондриях.
12.11. Участки связывания NAD+ очень сходны в различных дегидрогеназах
Лактат-дегидрогеназа из скелетных мышц, представляющая собою тетрамер с мол. массой 140 кДа, и алкоголь-дегидрогеназа, димер с мол. массой 84 кДа, обладают совершенно различной трехмерной структурой. Однако участки связывания NAD+ у них обнаруживают поразительное сходство (рис. 12.11). NAD+-связывающая область состоит из четырех α-спlipa лей и шести тяжей из параллельных p-слоев. Конформации NAD+при связывании с лактат-дегидрогеназой и алкоголь-дегидрогеназой также почти одинаковы. Аденозиновый компонент NAD+связывается в гидрофобной щели. В отличие от этого никотинамидный компонент связывается таким образом, что реакционноспособная сторона кольца оказывается в полярном окружении, тогда как другая сторона приходит в контакт с гидрофобными остатками фермента.
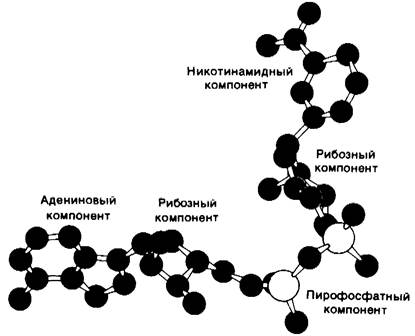
Связанный NAD+имеет вытянутую конформацию (рис. 12.12), адениновое и никотинамидное кольца отстоят друг от друга на 14 А. Трехмерная структура глицеральдегид-3-фосфат-дегидрогеназы и малат-дегидрогеназы (фермент цикла трикарбоновых кислот, разд. 13.9) также установлена с высокой степенью разрешения. Их NАD+-связывающие участки очень сходны с таковыми в лактат-дегидрогеназе и алкоголь-дегидрогеназе. Представляется вероятным, что сходство участков связывания NAD+ в этих четырех ферментах представляет собою пример фундаментального структурного мотива NАD+-зависимых дегидрогеназ.
Рис. 12.11. Схематическое изображение участка дегидрогеназ, связывающего NAD+. Половина этого участка, связывающая NAD+ (окрашена зеленым), подобна по структуре половине, связывающей аденин (окрашено желтым)
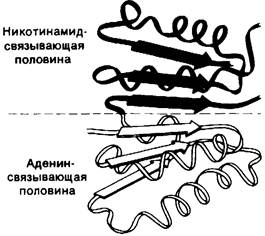
Рис. 12.12. Модель NAD+. Приведена конформация, обнаруженная при исследовании NAD+, связанного в комплексе с лактат-дегидрогеназой
12.12. Глюкоза индуцирует большие конформационные изменения в гексокиназе
Рентгенокристаллографическое исследование дрожжевой гексокиназы показывает, что связывание глюкозы приводит к большим конформационным изменениям фермента. Молекула гексокиназы состоит из двух долей, которые сближаются при связывании глюкозы (рис. 12.13). Глюкоза вызывает поворот одной доли относительно другой на 12°. В результате ось полипептида сдвигается на 8 А. Щель между долями закрывается, и связанная глюкоза оказывается окруженной белком (кроме его 6-гидроксиметильной группы). Закрывание щели в гексокиназе служит ярким примером той роли, которую играет в механизме ферментативного действия индуцированное соответствие (разд. 6.8), впервые постулированное Кошландом (Koshland). Индуцированные глюкозой структурные изменения имеют важное значение, по-видимому, в двух отношениях. Во-первых, окружение глюкозы становится в значительно большей степени неполярным, что усиливает перенос фосфорильной группы от АТР. Во-вторых, обхватывание глюкозы гексокиназой создает неблагоприятные условия для участия Н2O в качестве субстрата реакции. Если бы гексокиназа имела жесткую структуру, молекула воды, заняв участок связывания —СН2ОН-группы глюкозы, действовала бы на α-фосфат АТР. Иными словами, «жесткая» киназа помимо киназной активности обладала бы также и активностью АТРазы. Эта нежелательная активность предотвращается благодаря тому, что ферментативная активность киназы проявляется лишь в том случае, если щель между долями фермента закрыта глюкозой. Мы видим здесь, как гибкость фермента способствует его специфичности. Интересно отметить, что в молекулах пируваткиназы, фосфоглице- раткиназы и фосфофруктокиназы также имеются щели между долями, которые закрываются при связывании субстрата. Индуцируемое субстратом закрывание щели, рассмотренное здесь на примере гексокиназы, иллюстрирует наличие у всех киназ важного общего свойства.
Рис. 12.13. Конформация гексокиназы значительно изменяется при связывании глюкозы (показано красным). Две доли фермента сближаются и окружают субстрат
