БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 12. ГЛИКОЛИЗ
12.13. Альдолаза образует шиффово основание с дигидроксиацетонфосфатом
Обратимся теперь к альдолазе, которая катализирует конденсацию дигидроксиацетонфосфата и глицеральдегид-3-фосфата с образованием фруктозо-1,6-бисфосфата. Сначала дигидроксиацетонфосфат образует протонированное шиффово основание со специфическим лизиновым остатком в активном центре альдолаз, присутствующих в тканях животных.
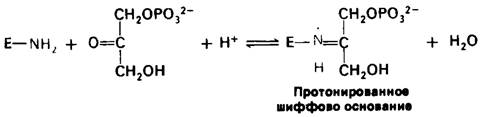
Это протонированное шиффово основание играет в катализе решающую роль, поскольку оно способствует образованию енолят-аниона дигидроксиацетонфосфата.
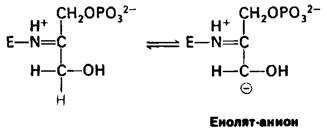
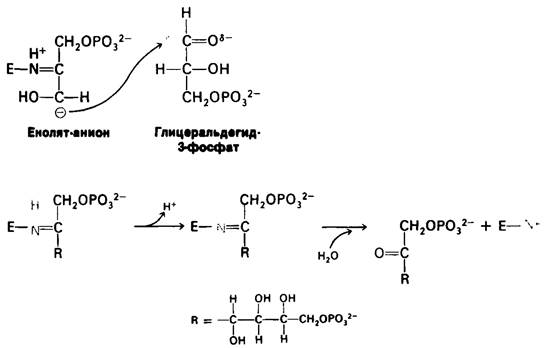
Последующее присоединение глицеральдегид-3-фосфата к образующемуся в качестве промежуточного соединения енолят-аниону дает протонированное шиффово основание фруктозо-1,6-бисфосфата.
Это шиффово основание депротонируется и гидролизуется, образуя фруктозо-1,6-бис- фосфат и регенерированный фермент.
Путь расщепления фруктозо-1,6-бисфосфата представляет собой простое обращение рассмотренного пути его образования.
12.14. Образование тиозфира при окислении глицераль дегид-3-фосфата
При действии гл ицеральдегид-3-фосфат - дегидрогеназы образуются различные виды фермент-субстратных промежуточных продуктов. Фермент катализирует окислительное фосфорилирование своего альдегидного субстрата.
Глицеральдегид-3-фосфат + Рi + NAD+ → 1,3-БФГ + NADH + Н+.
В процессе превращения альдегида в ацилфосфат сначала происходит окисление альдегидной группы.
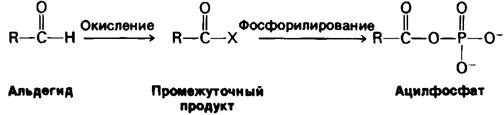
Это требует удаления гидрид-иона (Н-), который представляет собою ядро атома водорода с двумя электронами. Отделение гидрид-иона от альдегида сопряжено с преодолением мощного барьера, обусловленного биполярным характером карбонильной группы. Углеродный атом карбонильной группы уже имеет частичный положительный заряд.
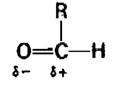
Рис. 12.14. Микрофотография кристаллов альдолазы

Удаление гидрид-иона облегчается уменьшением положительного заряда атома углерода. Это достигается присоединением нуклеофильного агента, обозначаемого как X- в следующем уравнении:
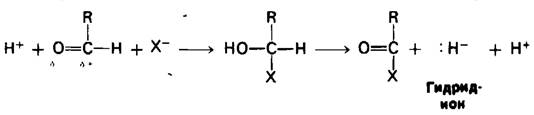
Гидрид-ион легко отделяется от образовавшегося продукта, поскольку углеродный атом больше не несет высокого положительного заряда. Более того, некоторое количество свободной энергии окисления накапливается в ацильном промежуточном продукте. Присоединение к этому промежуточному продукту ортофосфата приводит к образованию ацилфосфата, имеющего высокий потенциал переноса группы. Описанная последовательность реакций названа фосфорилированием на субстратном уровне, или субстратным фосфорилированием.
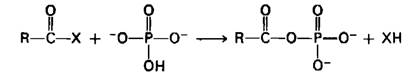
Теперь посмотрим, каким образом глице- ральдегид-3-фосфат-дегидрогеназа катализирует эти реакции (рис. 12.15). Нуклеофильный агент X - это сульфгидрильная группа цистеинового остатка в активном центре фермента. Альдегидный субстрат реагирует с ионизированной формой указанной сульфгидрильной группы с образованием полутиоацеталя. Следующий этап — перенос гидрид-иона. Акцептором для гидрид-иона служит молекула NAD+, которая прочно связана с ферментом. Продуктами реакции являются восстановленный кофермент NADH и тиоэфир. Этот тиоэфир представляет собою богатый энергией промежуточный продукт, соответствующий упомянутому ранее ацильному промежуточному продукту. NADH отделяется от фермента, и с активным центром вновь связывается NAD+. Далее ортофосфат воздействует на тиоэфир с образованием 1,3-бисфосфоглицерата, богатого энергией фосфата. Образование 1,3-бисфосфоглицерата из 3-фосфо- глицеральдегида имеет крайне важное значение, поскольку термодинамически невыгодная реакция, образование ацилфосфата
из карбоксилата, стимулируется при этом термодинамически выгодной реакцией, окислением альдегида.
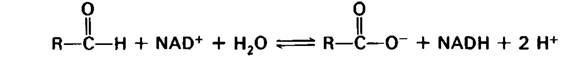
Рис. 12.15. Механизм каталитического действия глицеральдегид-3- фосфат—дегидрогеназы
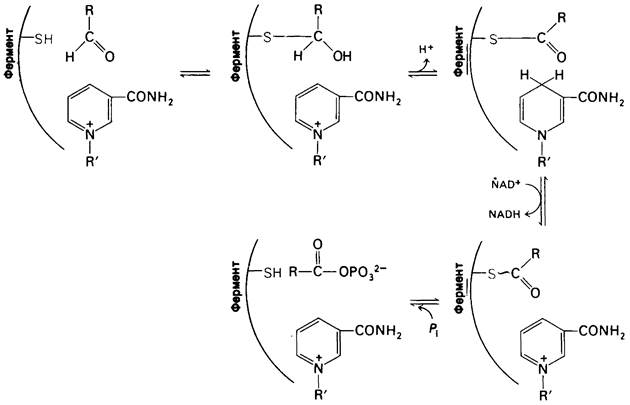
Эти две реакции сопряжены тиоэфирным промежуточным продуктом, который накапливает большую часть энергии, освобождающейся при реакции окисления. Мы сталкиваемся здесь с использованием ковалентно связанного с ферментом промежуточного продукта в качестве механизма сопряжения энергии.
12.15. Арсенат, аналог фосфата, действует как разобщитель
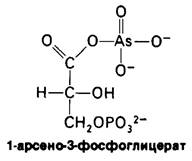
Арсенат (AsO43-) очень сходен с Рi по структуре и реакционной способности. В реакции, катализируемой глицеральдегид-3-фосфат-дегидрогеназой, арсенат может заменять фосфат по воздействию на богатый энергией тиоэфирный промежуточный продукт. Образующийся в результате этой реакции 1-арсено-З-фосфоглицерат в противоположность 1,3-бисфосфоглицерату неустойчив. 1-арсено-З-фосфоглицерат и другие ациларсенаты очень быстро и самопроизвольно гидролизуются. Поэтому суммарная реакция, протекающая в присутствии арсената, выглядит следующим образом:
Глицеральдегид-3-фосфат + NAD+ + Н2O → 3-фосфоглицерат + NADH + 2Н+.
Обратите внимание, что гликолиз идет в присутствии арсената, но он не сопровождается образованием АТР, происходящим в норме в процессе превращения 1,3-бисфос- фоглицерата в 3-фосфоглицерат. Таким образом, арсенат разобщает окисление и фосфорилирование путем образования высоколабильного ациларсената. Вероятная причина предпочтения фосфора арсенату в процессе эволюции биологических молекул состоит в большей кинетической стабильности фосфорных высокоэнергетических соединений.