БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 12. ГЛИКОЛИЗ
12.16. Енолфосфат имеет высокий потенциал переноса группы
Поскольку 1,3-БФГ является ацилфосфатом, он обладает высоким потенциалом переноса группы. На более поздних этапах гликолиза образуются различные высокоэнергетические соединения фосфата. Фосфоенолпируват, енолфосфат, образуется в результате дегидратации 2-фосфоглицерата. ∆G0' гидролиза фосфатного эфира обычного спирта составляет — 3 ккал/ моль, тогда как для фосфоенолпирувата эта величина равна — 14,8 ккал/моль. Почему фосфоенолпируват имеет такой высокий потенциал переноса фосфатной группы? Ответ заключается в том, что реакция не останавливается на переносе фосфорильной группы при образовании енола. Енол претерпевает превращение в кетон, а именно в пируват.
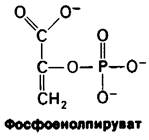
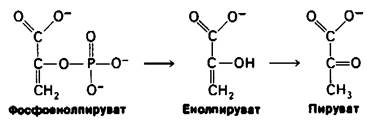
∆G0' превращения енол → кетон очень велико, составляя примерно — 10 ккал/моль. Сравним эту величину с величиной ∆G0' гидролиза фосфоенолпирувата в енолпиру- ват, равной примерно — 3 ккал/моль. Таким образом, присущий фосфоенолпирува- ту высокий потенциал переноса фосфатной группы возникает из большой движущей силы последующего превращения енол → кетон.
12.17. Метаболизм 2,3-бисфосфоглицерата, регулятора транспорта кислорода
Напомним, что 2,3-бисфосфоглицерат (2,3-БФГ) служит регулятором транспорта кислорода в эритроцитах. Он снижает сродство гемоглобина к кислороду, стабилизируя дeзоксигенированную форму гемоглобина (гл. 4). Эритроциты характеризуются высокой концентрацией 2,3-БФГ (обычно равной 4 мМ), что отличает их от других клеток, содержащих лишь следовые количества этого соединения. 2,3-БФГ играет общую роль в качестве кофактора при превращении 3-фосфоглицерата в 2-фосфоглицерат, осуществляемом фогоглицератмутазой.
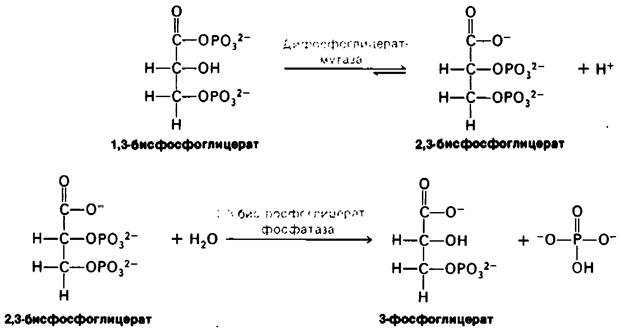
Синтез и расщепление 2,3-БФГ идут в обход гликолитического пути (рис. 12.16) Под действием бисфосфоглицератмутазы (дифосфоглицератмутазы) 1,3-БФГ превращается в 2,3-БФГ.
Рис. 12.16. Путь синтеза и распада 2,3-бисфосфоглицерата
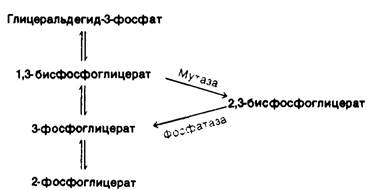
2,3-БФГ гидролизуется 2,3-бисфосфогли- - цератфосфатазой с образованием 3-фосфоглицерата. Фосфатаза - фермент, катализирующий гидролиз фосфатного эфира.
Интересен механизм этой мутазной реакции. 3-фосфоглицерат является ее обязательным участником, хотя в итоговой стехиометрии реакции он не фигурирует. Мутаза одновременно связывает 1,3-бисфос- фоглицерат и 3-фосфоглицерат. В этом тройном комплексе происходит перенос фосфорильной группы от С-1 1,3-бисфос- фоглицерата на С-2 3-фосфоглицерата (рис. 12.17).
Рис. 12.17. Схематическое изображение участия 3-фосфоглицерата в превращении 1,3-бисфосфоглицерата в 2,3-бисфосфоглицерат
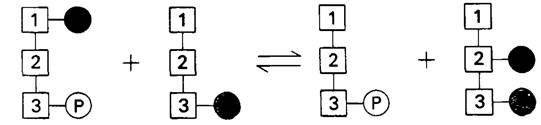
В данной мутазной реакции 2,3-БФГ выступает как мощный конкурентный ингибитор в отношении 1,3-БФГ. Таким образом, скорость синтеза 2,3-БФГ отчасти зависит от его собственной концентрации. Другим регуляторным фактором является концентрация 1,3-БФГ, поскольку фермент не всегда насыщен этим соединением. В отличие от этого содержание 3-фосфоглицерата в эритроцитах почти находится на том уровне, который необходим для насыщения мутазы. Таким образом, скорость синтеза 2,3-БФГ регулируется концентрацией несвязанных 1,3-БФГ и 2,3-БФГ.
12.18. Нарушение гликолиза в эритроцитах приводит к изменению транспорта кислорода
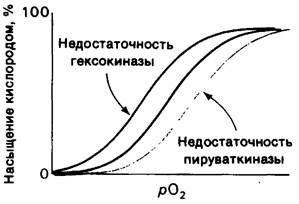
Гликолиз в эритроцитах и транспорт кислорода связаны между собой участием в обоих процессах 2,3-бисфосфоглицерата. А это означает, что нарушения гликолиза могут оказывать влияние на транспорт кислорода. Действительно, у некоторых больных с наследственными нарушениями гликолиза в эритроцитах диссоциационные кривые кислорода изменены (рис. 12.18). При недостаточности гексокиназы концентрация промежуточных продуктов гликолиза находится на низком уровне из-за нарушения первого этапа процесса-фосфорилирования глюкозы. Для эритроцитов таких больных характерна пониженная концентрация 2,3-БФГ, а, следовательно, гемоглобин у них обладает ненормально высоким сродством к кислороду. Прямо противоположные изменения имеют место в случае недостаточности пируваткиназы. Концентрация промежуточных продуктов гликолиза оказывается ненормально высокой, что объясняется блокированием конечного этапа процесса. Соответственно содержание 2,3-БФГ вдвое превышает норму, что обусловливает низкое сродство гемоглобина к кислороду. Отклонения от нормы диссоциационных кривых кислорода при недостаточности гексокиназы и пируваткиназы казались необъяснимыми, пока не было установлено, что 2,3-БФГ служит регулятором транспорта кислорода.
Таблица 12.3. Обычные концентрации промежуточных продуктов гликолиза в эритроцитах

Рис. 12.18. Кривые диссоциации кислорода для нормальных эритроцитов (черная линия), эритроцитов больного с недостаточностью гексокиназы (красная линия) и эритроцитов больного с недостаточностью пируваткиназы (синяя линия)