БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 13. ЦИКЛ ТРИКАБОНОВЫХ КИСЛОТ
13.9. Стехиометрия цикла трикарбоновых кислот
Суммарная реакция цикла трикарбоновых кислот имеет следующий вид:
Ацетил-СоА + 3NAD+ + FAD + GDP + Рi + Н2O → 2СO2 + 3NADH + FADH2 + GTP + 2Н + СоА.
Такая стехиометрия цикла трикарбоновых кислот (рис. 13.5 и табл. 13.1) обусловлена следующими реакциями.
1. Два атома углерода включаются в цикл при конденсации ацетильного компонента (из ацетил-СОА) с оксалоацетатом. Два углеродных атома покидают цикл в форме СO2 в ходе последующих реакций декарбоксилирования, катализируемых изоцитрат-дегидрогеназой и α-оксоглутарат-дегидрогеназой. Как будет вкратце обсуждаться ниже, атомы углерода, покидающие цикл, отличны от тех, которые в него включились.
Рис. 13.5. Цикл трикарбоновых кислот
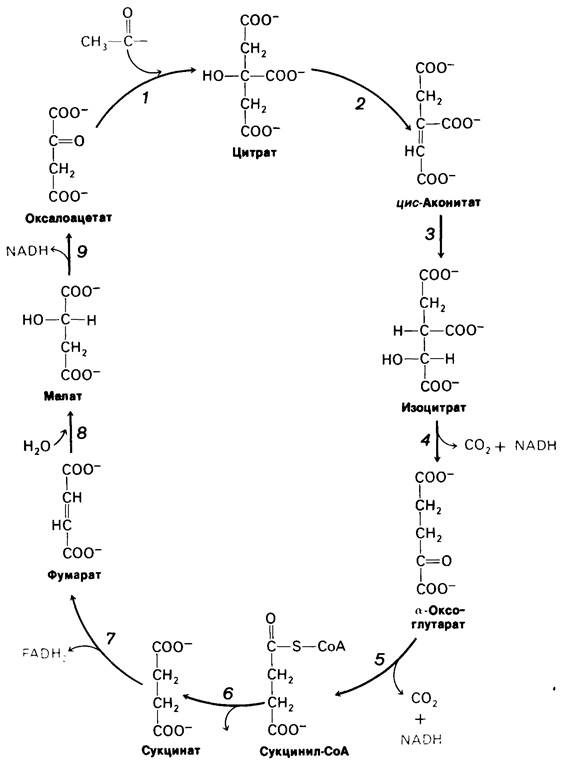
2. Четыре пары атомов водорода покидают цикл в ходе четырех окислительных реакций. Две молекулы NAD+ восстанавливаются в реакциях окислительного кар- боксилирования изоцитрата и а-оксоглутарата, одна молекула FAD восстанавливается при окислении сукцината и одна молекула NAD + восстанавливается при окислении малата.
3. Одна высокоэнергетическая фосфатная связь (в форме GTP или АТР) генерируется из богатой энергией тиоэфирной связи сукцинил-СоА.
4. Потребляются две молекулы воды: одна в синтезе цитрата при гидролизе цитрил-СоА, вторая-при гидратации фумарата.
Заглядывая вперед, скажем, что NADH и FADH2, образующиеся в цикле трикарбоновых кислот, окисляются в цепи переноса электронов (гл. 14). Генерирование АТР происходит при транспорте электронов от этих переносчиков на O2, их конечный акцептор. На каждую молекулу NADH в митохондрии образуются три молекулы АТР, на каждую молекулу FADH2-две молекулы АТР. Отметим, что только одна высокоэнергетическая фосфатная связь в расчете на один ацетильный остаток образуется непосредственно в цикле трикарбоновых кислот. Одиннадцать фосфатных связей, более богатых энергией, генерируются при окислении трех молекул NADH и одной молекулы FADH2 в цепи переноса электронов.
Молекулярный кислород непосредственно не участвует в цикле трикарбоновых кислот. Однако цикл функционирует лишь в аэробных условиях, поскольку NAD+
и FAD в митохондрии могут быть регенерированы только при переносе электронов на молекулярный кислород. Гликолиз в принципе может протекать как в аэробных, так и в анаэробных условиях, тогда как цикл трикарбоновых кислот носит строго аэробный характер. Напомним, что гликолиз может протекать в анаэробных
условиях по той причине, что в процессе превращения пирувата в лактат происходит регенерирование NAD+.
13.10. Пиру ват- дегидрогеназный комплекс- организованная система ферментов
Обратимся теперь к механизму некоторых реакций. Окислительное декарбоксилирование пирувата с образованием ацетил- СоА катализируется пируват-дегидрогеназным комплексом, организованной системой трех видов ферментов (табл. 13.2). Превращения, катализируемые этим комплексом, описываются следующим суммарным уравнением:
Пируват + СоА + NAD+ → Ацетил-СоА + СO2 + NADH.
Таблица 13.1. Цикл трикарбоновых кислот

Таблица 13.2. Пируват-дегидрогеназный комплекс E. coli

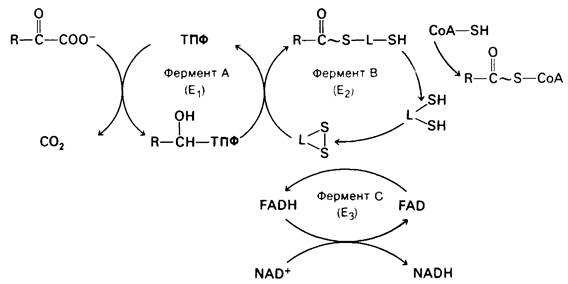
Механизм этой реакции гораздо сложнее, чем можно было бы думать, исходя только из ее стехиометрии. Помимо стехиометрических кофакторов СоА и NAD+ в ней в качестве каталитических кофакторов участвуют тиаминпирофосфат (ТПФ), липоамид и FAD.
Рис. 13.6. Модель тиаминпирофосфата
Превращение пирувата в ацетил-СоА происходит в четыре стадии. На первой стадии пируват соединяется с ТПФ и затем подвергается декарбоксилированию. Реакция катализируется пируват-дегидрогеназным компонентом мультиферментного комплекса.
Пируват + ТПФ → Гидроксиэтил—ТПФ + СO2.
Решающее значение для данного процесса имеет следующая особенность ТПФ, простетической группы пируват-дегидрогеназного компонента: очень кислый характер атома углерода, находящегося между атомами азота и серы тиазолового кольца. Он ионизируется, образуя карбанион, который легко присоединяется к карбонильной группе пиру вата.
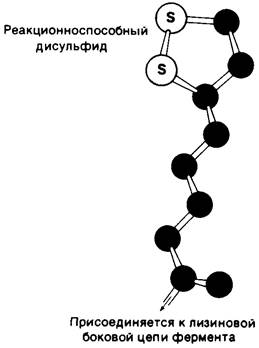
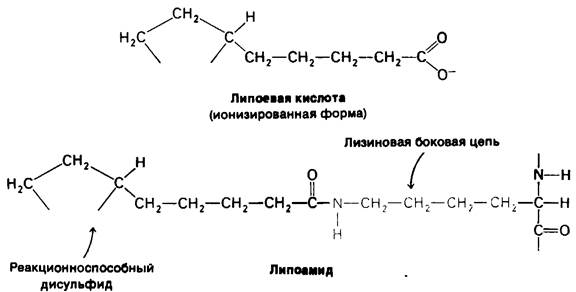
Рис. 13.7. Структура липоевой кислоты и липоамида. Липоевая кислота ковалентно присоединена к специфической лизиновой боковой цепи дигидролипоил- трансацетилазы. Отметим, что эта простетическая группа находится на конце длинной гибкой цепи, которая позволяет ей поворачиваться от одного активного центра
к другому в составе ферментного комплекса
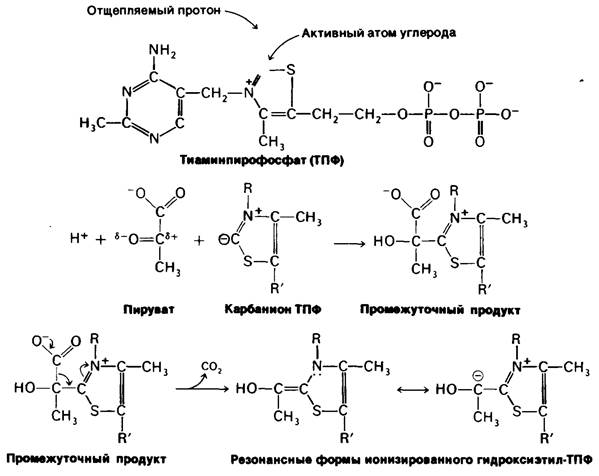
Рис. 13.8. Модель липоильной части липоамида
Положительно заряженный азот в кольце ТПФ принимает на себя электроны, стабилизируя формирование отрицательного заряда, необходимого для декарбоксилирования. Затем протонирование приводит к образованию гидроксиэтиламинпирофосфата.
На второй стадии гидроксиэтильная группа, связанная с ТПФ, окисляется с образованием ацетильной группы и одновременно переносится на липоамид. Окислителем в этой реакции служит дисульфидная группа липоамида, которая превращается в сульфгидрильную группу. Реакция катализируется дигидролипоилтрансацетилазным компонентом комплекса и приводит к образованию ацетиллипоамида.
На третьей стадии ацетильная группа переносится с ацетиллипоамида на СоА, образуя ацетил-СоА. Процесс также катализируется дигидролипоил-трансацетилазой. При переходе ацетильной группы на СоА сохраняется богатая энергией тиоэфирная связь.
На четвертой, завершающей стадии происходит регенерирование окисленной формы липоамида. Реакция катализируется диги- дролипоил-дегидрогеназным компонентом комплекса. Окислителем в ней служит NAD+, а роль простетической группы фермента выполняет FAD.
Источником сведений, проливших свет на структуру и сборку пируват-дегидрогеназного комплекса, явились исследования Лестера Рида (Lester Reed). Интенсивному изучению был подвергнут ферментный комплекс из Е. coli. Было установлено, что его мол. масса 4600 кДа и что он состоит из 48 полипептидных цепей. На электронной микрофотографии отчетливо видна структура многогранника с диаметром около 300 А (рис. 13.9). Ядро (сердцевину) пируват-дегидрогеназного комплекса составляют полипептидные цепи трансацетилазы. Пируват-дегидрогеназный и липоил- дегидрогеназный компоненты связываются с наружной стороной этого ядра, состоящей из трансацетилазных компонентов (рис. 13.10).
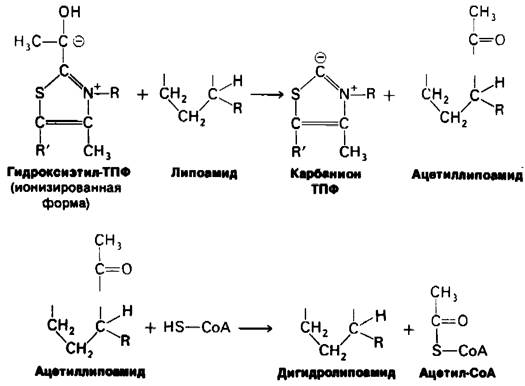
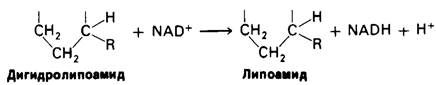
Рис. 13.9. Электронная микрофотография пируват-дегидрогеназного комплекса из Е. coli

Рис. 13.10. Модель пируват-дегидрогеназного комплекса из Е. coli

Составляющие комплекс полипептидные цепи удерживаются вместе нековалентными силами. При щелочных значениях pH комплекс диссоциирует на пируват-дегидрогеназный компонент и субкомплекс из двух других ферментов. Трансацетилазу можно затем отделить от дегидрогеназы при нейтральных значениях pH в присутствии мочевины. После смешивания при нейтральном значении pH в отсутствие мочевины происходит самопроизвольная ассоциация этих трех ферментов с образованием пируват-дегидрогеназного комплекса. Таким образом, нативный ферментный комплекс может, по-видимому, образовываться путем самосборки.
Структурное объединение трех видов ферментов делает возможным координированный катализ при осуществлении сложной реакции (рис. 13.11). Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связываются с комплексом. Тесная близость между ферментами увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции. Активированные промежуточные продукты переносятся от одного активного центра к другому липоамидной простетической группой трансацетилазы. Присоединениелипоильной группы к ε-аминогруппе лизинового остатка трансацетил азы создает гибкий рычаг для реакционноспособного о кольца. Этот молекулярный рычаг в 14 А способствует взаимодействию липоильной части транс- ацетилазной субъединицы с тиаминпирофосфатным компонентом соседней пируват-дегидрогеназ ной субъединицы и с флавиновым компонентом соседней липоил-дегидрогеназы. Кроме того, липоильные компоненты мультиферментного комплекса могут реагировать друг с другом, образуя сеть взаимодействующих реакционноспособных групп. Заряд липоильного компонента в течение цикла его превращений составляет 0,-1 или — 2 при полной ионизации сульфгидрильных групп. Эти изменения заряда могут служить движущей силой для направленного движения липоильной группы.
Рис. 13.11. Перечень реакций, катализируемых пируват-дегидрогеназным комплексом. L обозначает лияоильную группу