БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 14. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
14.15. Трехмерная структура цитохрома с
Цитохром с-единственный из белковых переносчиков электронов, который можно путем мягкой обработки отделить от внутренней митохондриальной мембраны. Растворимость этого периферического мембранного белка в воде облегчает его очистку и кристаллизацию. Действительно, о структуре цитохрома с известно значительно больше, чем о структуре какого-либо другого белка - переносчика электронов.
Цитохром с состоит из одной 104-членной полипептидной цепи и присоединенной к ней ковалентно группы гема. Трехмерную структуру ферро- и ферриформ цитохрома с раскрыл Ричард Дикерсон (Richard Dickerson) с разрешением, близким к атомному (рис. 14.14). Белок имеет почти сферическую форму диаметром 34 А. Группа гема окружена многочисленными плотноупакованными гидрофобными боковыми цепями. Атом железа связан с атомом серы остатка метионина и с атомом азота остатка гистидина (рис. 14.15). Гидрофобный характер окружения гема обусловливает большее положительное значение окислительно-восстановительного потенциала цитохрома с (соответствующее более высокому сродству к электронам), чем в случае того же самого комплекса гема в водной среде. Удаление электрона из гема в составе цитохрома с является энергетически менее выгодным, чем его удаление из гема в воде, потому что в цитохроме с диэлектрическая постоянная вблизи атома железа ниже.
Рис. 14.14. Трехмерная структура восстановленного цитохрома с тунца. Показаны группа гема (окрашено красным), метионин-80 (окрашено синим), гистидин- 18 (окрашено синим) и α-углеродные атомы
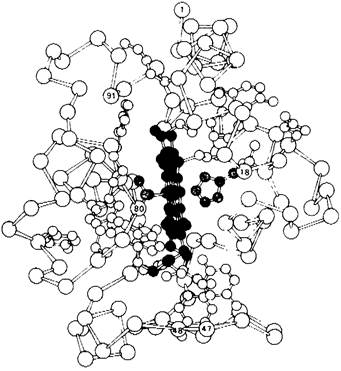
Рис. 14.15. Атом железа гемовой группы в цитохроме с связан с метиониновой и гистидиновой боковой цепью
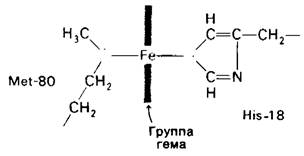
Общая структура молекулы может быть охарактеризована как оболочка толщиной в один остаток, плотно окружающая гем. Гидрофобные боковые цепи образуют внутреннюю часть оболочки. Далее идет главная цепь, за ней следую г несущие заряд боковые цепи, которые размещаются на поверхности. Имеется очень маленькая α-спираль, β-складчатые слои отсутствуют. По существу, полипептидная цепь обернута вокруг гема. Остатки с 1-го по 47-й находятся со стороны гистидина-18 группы гема (названной правой стороной), остатки с 48-го по 91-й-на стороне метионина-80 (названной левой стороной). Остатки с 92-го по 104-й идут обратно через гем на его правую сторону.
14.16. Взаимодействие цитохрома с с его редуктазой и оксидазой
Как уже указывалось ранее, цитохром с переносит электроны от QН2-цитохром- с—редуктазного комплекса (второй запасающий энергию участок) к цитохром-с— оксидазному комплексу (третий запасающий энергию участок). Как взаимодействует цитохром с со своей редуктазой и затем со своей оксидазой? Важным подходом к разрешению этого вопроса является изучение распределения заряженных остатков на поверхности белка. В молекулах цитохрома с всех изученных до сих пор видов имеются кластеры лизиновых боковых цепей вокруг гемовой щели на одной поверхности белка (передняя часть рис. 14.14). Распределение зарядов на поверхности цитохрома с, по всей вероятности, играет определенную роль в распознавании и связывании редуктазы и оксидазы. Например, взаимодействие цитохрома с с цитохромоксидазой нарушается при модификации лизина-13. Кроме того, полилизин конкурирует с цитохромом с за связывание с обоими ферментами.
Каким образом цитохром с акцептирует с редуктазы электроны, которые он затем отдает оксидазе? A priori здесь возможны два механизма. Перенос электронов между группами гема различных белков может осуществляться ароматическими боковыми цепями. Другая возможность-это прямой перенос электрона от одного гема к другому. Важно отметить, что электрон, переносимый гемом, не обязательно тяготеет к его атому железа. Он скорее частично делокализован над всей конъюгированной ԉ-электронной сетью гема. Следовательно, электрон может переноситься oт одною гема к другому, если их края достаточно сближены (отстоят менее чем на 8 А) и их плоскости примерно параллельны. Прямой механизм переноса электрона представляется более вероятным из-за очень большой величины свободной энергии, требуемой для образования свободнорадикального аниона ароматической боковой цепи. Кроме того, один из краев гема в цитохроме с (передний край на рис. 14.14) доступен для прямых реакций, участвующих в переносе электронов.
14.17. Конформация цитохрома с оставалась в основном постоянной в течение миллиардов лет
Цитохром с имеется у всех организмов, обладающих митохондриальными дыхательными цепями; растений, животных и эукариотических микроорганизмов. Этот переносчик электронов возник более 1,5 млрд, лет назад, до того, как произошла дивергенция на царство растений и животных. Его функция сохранялась неизменной в течение всего этого периода, о чем свидетельствует тот факт, что цитохром с любого вида эукариот реагирует in vitro с цитохромокеидазой любого другого исследованного к настоящему времени вида. Например, цитохром с из зародышей пшеницы реагирует с цитохромоксидазой из ткани человека. Второй критерий сохранения функции-близость значений окислительно-восстановительного потенциала для всех молекул цитохрома с (около -+0,25 В). Третий критерий-почти полная идентичность спектров поглощения молекул цитохрома с различных видов. Действительно, цитохромы некоторых прокариот, такие, как цитохром с2 фотосинтезирующих бактерий и цитохром с550 денитрифицирующих бактерий, очень близки к цитохрому с из митохондрий сердца тунца (рис. 14.16).
Рис. 14.16. Сохранение трехмерной структуры цитохрома с в ходе эволюции на примере сходства конформаций цитохрома с из митохондрий сердечной мышцы тунца (А), цитохрома с2 из Rhodospirillum rubrum, фотосинтезирующей бактерии (Б) и цитохрома с550 из Paracoccus denitrificans, денитрифицирующей бактерии (В)
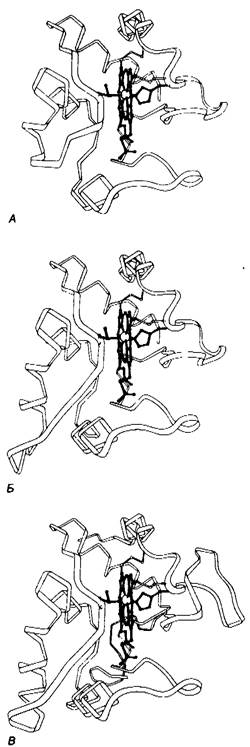
Эмиль Смит, Эмануэль Марголиаш (Emil Smith, Emanuel Margoliash) и др. определяли аминокислотную последовательность цитохромов с от более чем восьми далеких друг от друга видов эукариот. Они обнаружили поразительный факт- оказалось, что 26 из 104 остатков сохранялись инвариантными в течение более полутора миллиардов лет эволюции. Теперь, когда известна пространственная структура молекулы, становятся очевидными причины такого постоянства большинства из этих остатков. Как можно было ожидать, инвариантными являются гемовые лиганды метионин-80 и гистидин-18, так же как два цистеина, ковалентно связанные с гемом. Последовательность из 11 остатков (с 70-го по 80-й) почти одинакова во всех молекулах цитохрома с. Инвариантны многие гидрофобные остатки, контактирующие с гемом. В ходе эволюции в цитохроме с сохранилась большая часть остатков глицина. Как, указывалось ранее (разд. 9.6), остатки глицина имеют важное значение в силу их малых размеров. Компактное скручивание пептидной цепи требует присутствия глицина в определенных положениях. Некоторые инвариантные остатки лизина и apгинина локализованы в положительно заряженных кластерах на поверхности молекулы. Один из таких кластеров взаимодействует с цитохром-с-редуктазой, другой-с цитохромоксидазой.