БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 15. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ И ГЛЮКОНЕОГЕНЕЗ
15.14. Глюконеогенез-это не обращение гликолиза
При гликолизе глюкоза превращается в пируват, при глюконеогенезе пируват превращается в глюкозу. Однако глюконеогенез -это отнюдь не обращение гликолиза. Он должен идти по иному пути, поскольку термодинамическое равновесие гликолиза сдвинуто далеко в сторону образования пи- рувата. В обычных условиях, существующих в клетках, фактическое значение ∆G для образования пирувата из глюкозы составляет около — 20 ккал/моль (разд. 12.9). Уменьшение свободной энергии при гликолизе происходит в основном на трех необратимых стадиях, катализируемых гексокиназой, фосфофруктокиназой и пируваткиназой.
Путь глюконеогенеза обходит эти фактически необратимые реакции гликолиза при помощи следующих новых этапов:
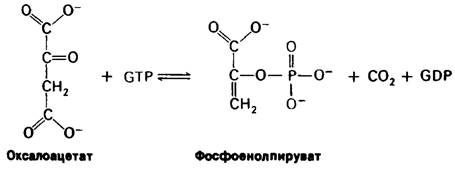
1. Фосфоенолпируват образуется из пирувата через оксалоацетат. Вначале происходит карбоксилирование пирувата в оксалоацетат с потреблением одной молекулы АТР. Затем оксалоацетат подвергается де- карбоксилированию и фосфорилированию с образованием фосфоенолпирувата за счет второй высокоэнергетической фосфатной связи.
Пируват + СО2 + АТР + Н2О ⇄ Оксалоацетат + ADP + Рi + 2Н+,
Оксалоацетат + GT ⇄ Фосфоенолпируват + GDP + СO2.
Первая реакция катализируется пируват- карбоксилазой, вторая - фосфоенолпируват- карбоксикиназой. Суммируя эти реакции, получаем
Пируват + АТР + GTP + Н2O ⇄ Фосфоенолпируват + ADP + Pi + 2H+.
Данный путь образования фосфоенолпирувата из пирувата термодинамически выгоден, поскольку ∆G0 равно + 0,2 ккал/моль, в отличие от + 7,5 ккал/моль для реакции, катализируемой пируваткиназой. Это значительно более благоприятное значение ∆G0' обусловлено участием в процессе дополнительной высокоэнергетической фосфатной связи.
2. Фруктозо-6-фосфат образуется из фруктозо-1,6-бис фосфата путем гидролиза фосфатного эфира при C-L. Этот экзергонический гидролиз катализируется фруктозо-1,6-бисфосфатазой.
Фруктозо-1,6-6исфосфат + Н2O → Фруктозо-6-фосфат + Рi.
3. Глюкоза образуется путем гидролиза глюкозо-6-фосфата, реакции, катализируемой глюкозо-6-фосфатазой.
Глюкозо-6-фосфат + Н2O → Глюкоза + Рi.
Таблица 15.2. Различия ферментов гликолиза и глюконеогенеза

Глюкозо-6-фосфатаза связана с эндоплазматическим ретикулумом и действует на субстрат, локализованный в цитозоле. В мозгу и мышцах этого фермента нет, и поэтому глюкоза не выводится из этих органов.
15.15. Биотин - мобильный переносчик активированного СO2
Обнаружение того факта, что в митохондриях происходит образование оксалоацетата из пирувата, привело Мертона Аттера (Merton Utter) к открытию в 1960 г. пируват- карбоксилазы. Этот фермент представляет особый интерес из-за его каталитических и аллостерических свойств. Пируват-карбоксилаза содержит ковалентно присоединенную простетическую группу, биотин, который функционирует в качестве переносчика, активированного СO2.
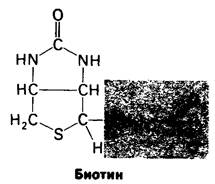
Карбоксильный конец биотина связан амидной связью с 8-аминогруппой специфического остатка лизина.
Заметим, что биотин присоединен к пируват-карбоксилазе длинной гибкой цепью, сходной с цепью, связывающей липоамид в пируват-дегидрогеназном комплексе.
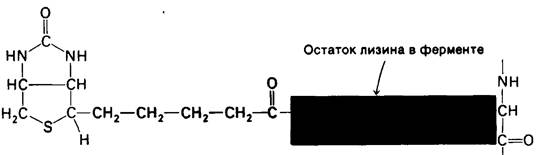
Карбоксилирование пирувата протекает в две стадии:

Карбоксильная группа в промежуточном продукте карбоксибиотин—фермент связана с атомом N-1 биотинового кольца.
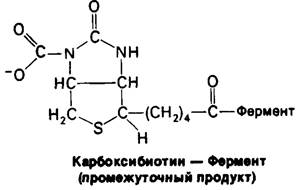
В этом промежуточном продукте карбоксильная группа активирована. ∆G0' для ее отщепления
СO2 ≈ Биотин—фермент + Н+→ СO2 + Биотин—фермент
составляет — 4,7 ккал/моль, что обусловливает способность карбоксибиотина к переносу СO2 на акцепторы без дополнительного потребления свободной энергии.
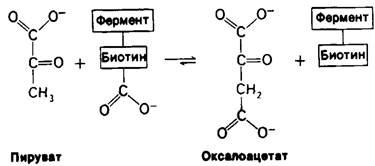
Активированная карбоксильная группа переносится затем с карбоксибиотина на пируват с образованием оксалоацетата. Длинная гибкая цепь между биотином и ферментом сообщает этой простетической группе способность поворачиваться от одного активного центра фермента (АТР-бикарбонатный участок) к другому (пируватному участку).
15.16. Пируват-карбоксилаза активируется при участии ацетил-СоА
Активность пируват-карбоксилазы зависит от присутствия ацетил-СоА. В отсутствие связанного с ферментом аиетил-СоА (или другого близкого к нему ацил-СоА) биотин не карбоксилируется. Вторая частичная реакция не зависит от ацетил-СоА. Аллостерическая активация пируват-карбоксилазы при участии ацетил-СоА представляет собой важный физиологический механизм контроля. Оксалоацетат, продукт пируват- карбоксилазной реакции, является одновременно и стехиометрическим промежуточным продуктом глюконеогенеза, и каталитическим промежуточным продуктом цикла трикарбоновых кислот. Высокое содержание ацетил-СоА служит сигналом необходимости большего количества оксалоацетата. Если имеет место избыток АТР, оксалоацетат потребляется в процессе глю- конеогенеза. В условиях недостатка АТР оксалоацетат включается в цикл трикарбоновых кислот, конденсируясь с ацетил-СоА.
Таким образом, пируват-карбоксилаза не только имеет важное значение для глюконеогенеза, но играет также критическую роль в поддержании необходимой концентрации промежуточных продуктов цикла трикарбоновых кислот. Указанные промежуточные продукты должны все время восполняться, поскольку они потребляются при некоторых биосинтетических реакциях, например, при синтезе гема. Эта роль пируват-карбоксилазы получила название ана- плеротической, что означает восполняющая, компенсирующая.