БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 11 МЕТАБОЛИЗМ: ОСНОВНЫЕ ПОЛОЖЕНИЯ И ОБОЗНАЧЕНИЯ
11.10. Кофермент A как универсальный переносчик ацильных групп
Кофермент А-другая молекула, занимающая центральное место в метаболизме. В 1945 г. Липман установил, что для многих процессов ацетилирования, катализируемых ферментами, требуется гермостабильный кофактор. Этот кофактор был назван коферментом А (СоА), где А означает ацетилирование. Он был выделен, а несколькими годами позднее была определена его структура (рис. 11.11).
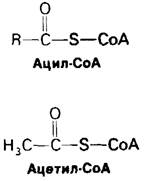
Реакционноспособной частью молекулы СоА является концевая сульфгидрильная группа. Ацильные группы присоединяются к СоА при помощи тиоэфирнойсвязи. Образующееся в результате этого производное получило название ацил-СоА. Ацильная группа, связанная с СоА, часто бывает представлена ацетильной группой. Это производное называют ацетил-СоА. ∆G0' для гидролиза ацетил-СоА имеет большую отрицательную величину:
Ацетил-СоА + Н2O ⇄ Ацетат + СоА + Н+
∆G0' = - 7,5 ккал/моль,
Другими словами, ацетил-СоА имеет высокий потенциал переноса ацетильных групп. СоА является переносчиком активированных ацетильных или других ацильных групп, подобно тому как АТР служит переносчиком активированных фосфорильных групп.
Рис. 11.11. Строение кофермеита А (СоА)
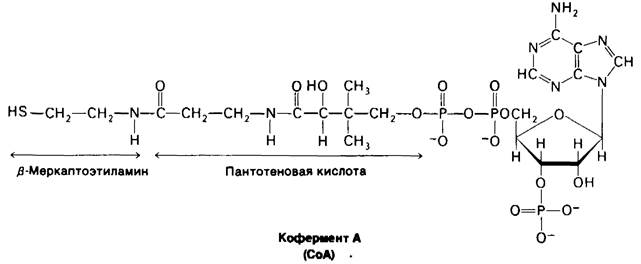
Рис. 11.12. Cтроение некоторых водорасторимых Витаминов
При дальнейшем рассмотрении процессов метаболизма мы встретимся и с другими переносчиками активированных групп. Некоторые из них перечислены в табл. 11.3.
Таблица 11.3. Некоторые активированные переносчики в метаболизме

Эти переносчики опосредуют обмен активированных групп в многочисленных биохимических реакциях. Они действительно играют очень сходную роль во всех формах жизни. Их универсальное присутствие - один из интегральных моментов биохимии.
11.11. Большинство водорастворимых витаминов являются компонентами коферментов
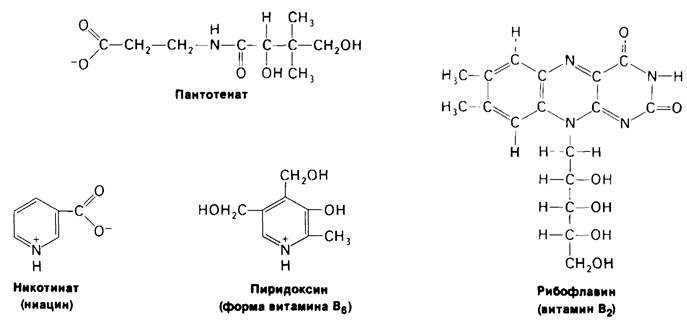
Липман писал: «Врачи любят прописывать витамины, и миллионы людей принимают их, однако потребовалась немалая биохимическая изобретательность, чтобы понять, почему они необходимы и каким образом организм их использует». Витамины-органические молекулы, которые в малых количествах должны присутствовать в рационе высших животных. Эти молекулы играют почти одинаковую роль во всех формах жизни, однако высшие животные утратили способность их синтезировать. Существуют две группы витаминов: жирорастворимые, обозначаемые буквами А, D, Е и К, и водорастворимые, к которым относятся витамины группы В. Биохимическая роль водорастворимых витаминов в основном известна. Большинство из них представляют собой компоненты коферментов (табл. 11.4). Например, рибофлавин (вита-
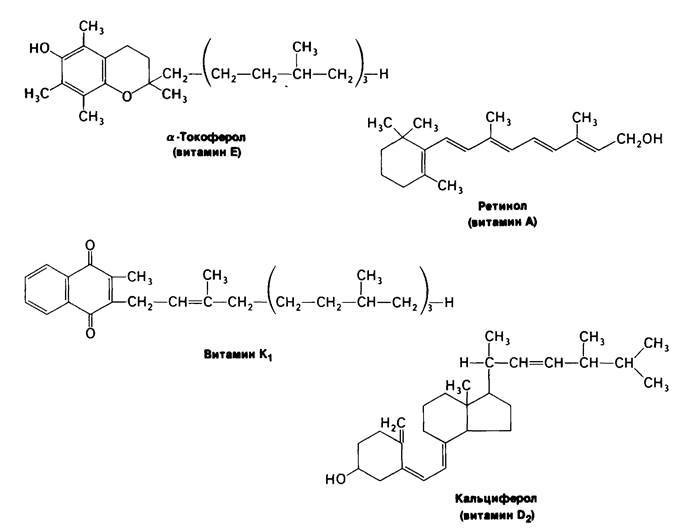
мин В2)-предшественник FAD, а нантотенат является компонентом кофермента А, Молекулярная основа действия жирорастворимых витаминов (рис. 11.13) изучена значительно хуже. Витамин К, необходимый для нормального свертывания крови, участвует в карбоксилировании остатков глутамата в γ-карбоксиглутамат (разд. 8.23). Витамин А (ретинол) предшественник ретиналя, светопоглощаюшей группы в coставе зрительных пигментов (разд. 37.13). Недостаток этого витамина приводит к куриной слепоте. Кроме того, молодым животным витамин А требуется для роста. Метаболизм кальция и фосфора регулируется гормоном-производным витамина D (разд. 20.26). При недостатке витамина D нарушается формирование костной ткани у растущих животных. Недостаточность витамина Е у крыс приводит к бесплодию. Этот витамин защищает ненасыщенные мембранные липиды от окисления.
Таблица 11.4. Коферментные производные некоторых водорастворимых витаминов

Рис. 11.13. Строение некоторых жирорастворимых витаминов
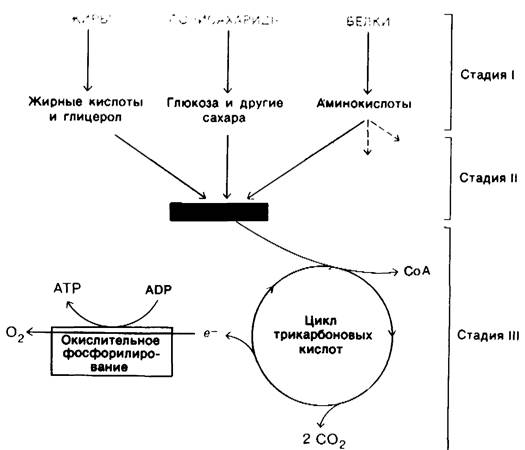
11.12. Стадии извлечения энергии из пищевых веществ
Рассмотрим в общих чертах процесс генерирования энергии у высших организмов, прежде чем перейти в последующих главах к детальному анализу этих реакций. Ганс Кребс (Hans Krebs) описал три стадии генерирования энергии при окислении питательных веществ. На первой стадии крупные молекулы пищи расщепляются на более мелкие компоненты. Белки гидролизуются на 20 типов аминокислот; полисахариды гидролизуются до простых сахаров, таких, как глюкоза; жиры распадаются на глицерол и жирные кислоты (рис. 11.14). На этой стадии не происходит высвобождения биологически полезной энергии. На второй стадии многочисленные малые молекулы, образовавшиеся в результате первой стадии, распадаются до нескольких простых компонентов, играющих центральную роль в метаболизме. Большинство из них-сахара, жирные кислоты, глицерол и некоторые аминокислоты-превращаются в ацетильную часть ацетил-СоА. На этой стадии происходит образование АТР, но в значительно меньшем количестве, чем при полном окислении ацетильного компонента ацетил-СоА. Третья стадия-это цикл трикарбоновых кислот и окислительное фосфорилирование, представляющие собой конечные общие пути в окислении топливных молекул. Ацетил-СоА привносит свои ацетильные компоненты в этот цикл, где они полностью окисляются до СО2. При окислении каждой ацетильной группы имеет место перенос на NAD+ и FAD четырех пар электронов. В процессе переноса
электронов от восстановленных форм этих переносчиков к О2 происходит генерирование АТР-процесс, названный окислительным фосфорилированием. Большая часть АТР, генерируемого при расщеплении пищевых веществ, образуется на этой третьей стадии.
Рис. 11.14. Стадии извлечения энергии из пищевых веществ
11.13. Процессы обмена веществ регулируются множеством различных механизмов
Даже в простейшей бактериальной клетке может протекать более тысячи взаимозависимых реакций. Очевидно, что эта сложная система должна строго регулироваться. Более того, регуляция обмена веществ должна быть гибкой в силу непостоянства условий внешней среды. Исследование широкого круга организмов показало, что существует много различных механизмов регуляции метаболизма. Следует подчеркнуть, что, хотя центральные метаболические пути в настоящее время почти полностью установлены, изучение механизмов их регуляции до сих пор находится в зачаточном состоянии. Немногие вопросы современной биохимии представляют собой настолько важную и захватывающую проблему.
Главный механизм регуляции метаболизма-контроль количества некоторых ферментов. Этот механизм широко исследовался у бактерий. Регуляция скорости синтеза β-галактозидазы и других белков, необходимых для использования лактозы, представляет собой классический пример, который детально рассматривается в гл. 28. Исследования, проведенные в последние годы, показали, что регуляции подвержена также скорость расщепления некоторых ферментов. Регуляция метаболизма достигается и путем контроля каталитической активности определенных ферментов. Общий и важный механизм регуляции -обратимый аллостерический контроль. Например, во многих биосинтетических процессах имеет место аллостерическое ингибирование первой реакции конечным продуктом процесса; это взаимодействие называют ингибированием по принципу обратной связи, или ретроингибированием. Активность некоторых ферментов модулируется также путем ковалентных модификаций, таких, как фосфорилирование специфического серинового остатка.
Важный общий принцип метаболизма состоит в следующем; пути биосинтеза и распада почти всегда разобщены. Это разобщение, как будет показано в последующих главах, необходимо по энергетическим причинам. Оно также способствует регуляции метаболизма. У эукариот возможности метаболической регуляции и ее гибкость усиливаются благодаря наличию компартментации. Например, окисление жирных кислот протекает в митохондриях, а их синтез-в цитозоле (растворимой части цитоплазмы). Компартментация пространственно разобщает эти противоположно направленные реакции.
Многие метаболические реакции отчасти регулируются энергетическим статусом клетки. Показателем энергетического статуса служит энергетический заряд, который пропорционален сумме молярной фракции АТР и половины молярной фракции ADP (учитывая, что АТР содержит две, а ADP-одну ангидридную связь). Отсюда энергетический заряд вычисляется по формуле

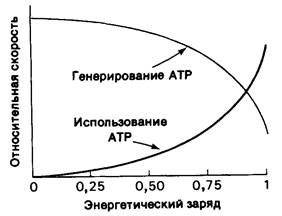
Значение энергетического заряда может колебаться от 0 (в системе присутствует только АМР) до 1 (в системе присутствует только АТР). Дэниел Аткинсон (Daniel Atkinson) показал, что метаболические пути, ведущие к синтезу АТР, ингибируются высоким энергетическим зарядом, тогда как пути использования АТР стимулируются высоким энергетическим зарядом. При графическом изображении зависимости между скоростью этих процессов (генерирования и использования АТР) и энергетическим зарядом кривые идут наиболее круто вблизи значения энергетического заряда 0,9, при котором они обычно пересекаются (рис. 11.15). Очевидно, что регуляция этих путей метаболизма направлена на поддержание энергетического заряда в сравнительно узких пределах. Другими словами, энергетический заряд, так же как pH клетки, забуферен. Его значение в большинстве клеток находится в диапазоне 0,80-0,95. Другой показатель энергетического статуса-это потенциал фосфорилирования, который определяется уравнением
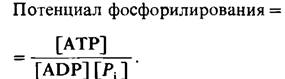
Потенциал фосфорилирования в противоположность энергетическому заряду зависит от концентрации Рi и прямо связан со свободной энергией, высвобождаемой при. расщеплении АТР.
Рис. 11.15. Влияние энергетического заряда на относительную скорость типичного генерирующего АТР (катаболического) пути и типичного использующего АТР (анаболического) пути