Фізіологія людини - Вільям Ф. Ґанонґ 2002
Функції травної системи
Механізми регулювання шлунково-кишкових функцій
Шлунок
У шлунку їжа нагромаджується й перемішується з соляною кислотою, слизом та пепсином і дозовано надходить у дванадцятипалу кишку; це добре відрегульований процес.
Анатомічні особливості
Макроанатомія шлунка показана на рис. 26-8. Слизова оболонка шлунка містить багато глибоких залоз. У пілоричній та кардіальній частині залози секретують слиз. Залози тіла шлунка, у тім числі і дна, містять парієтальні (оксинтні) клітини, які секретують соляну кислоту та внутрішній фактор, головні (зимогенні, пептичні) клітини, які виділяють пепсиногени (рис. 26-9). їхні секрети змішуються зі слизом, що його секретують клітини у шийках залоз. Кілька залоз у разі відкривання на поверхню слизової часто утворюють заглиблення (шлункова ямочка). Слиз секретують слизові клітини епітелію (мукоцити), які містяться між залозами, на поверхню слизової разом з НСО3.
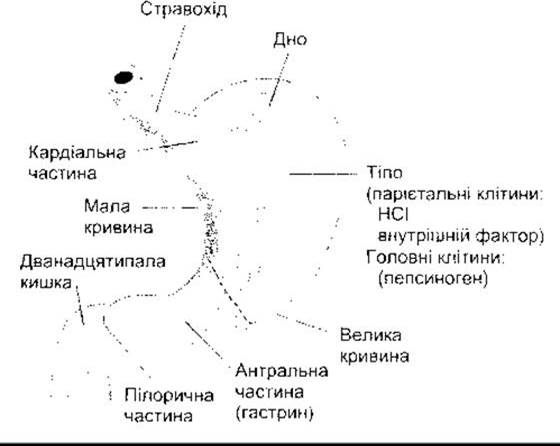
Рис. 26-8. Анатомія шлунка. Головні речовини наведені в дужках під назвою частин шлунка, де вони секретовані. Штрихова лінія позначає межу між тілом та антральною частиною.
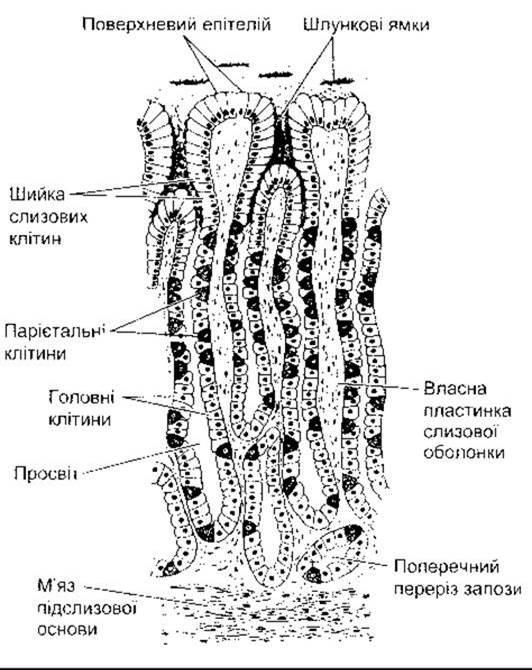
Рис. 26-9. Схематичне зображення залоз у слизовій тіла шлунка людини (відтворено за дозволом з Bell GH, Davidson N, Scarboryugh G: Textbook of Physiology and Biochemistry, 6th ed. Livingstone, 1965).
Шлунок має добре розвинуте крово- та лімфопостачання. Його парасимпатична іннервація забезпечена блукаючим невром, а симпатична - з черевного вузла.
Секреція шлунка
Клітини шлункових залоз секретують понад 2500 мл шлункового соку за день. Цей сік вміщує різноманітні речовини (табл. 26-5). Шлункові ензими описані у Розділі 25. Соляна кислота, яку секретують залози тіла шлунка, знищує більшість захоплених бактерій, допомагає травленню білків і стимулює надходження жовчі та підшлункового соку. Її концентрація достатня для ушкодження клітин, проте в нормальних осіб шлункова слизова не стає ушкодженою чи перетравлюваною, оскільки шлунковий сік містить слиз. Слиз, що його секретують шийкові та поверхневі слизові клітини тіла та дна і подібні клітини у будь-якій ділянці шлунка, складається з глікопротеїнів, які називають муцинами. Кожний муцин уміщує чотири субодиниці, зв’язані дисульфідними містками. Слиз утворює гнучкий гель, що покриває слизову оболонку.
Поверхневі слизові клітини також секретують НСО3, який затримується у слизовому гелі, так що градієнт pH становить від 1-2 у люмінальній поверхні до 6-7 на поверхні епітеліальних клітин. Соляна кислота, секретована парієтальними клітини шлункових залоз, проходить цей бар’єр у пальцеподібних каналах, залишаючи інтактною решту гелевого шару.
Поверхневі мембрани слизових клітин і щілинні з’єднання між клітинами також часто є частиною слизового бар’єра, що захищає шлунковий епітелій від ушкодження. Речовини, схильні уражувати бар’єр і зумовлювати подразнення шлунка, - це спирт, оцет, жовчні солі та аспірин, інші нестероїдні протизапальні препарати (НСПЗП). Простагландини стимулюють секрецію слизу, а аспірин та споріднені лікарські засоби інгібують синтез простагландинів.
Частину резистентності шлункової кислоти до самоперетравлення забезпечує наявність трефоїлових пептидів у слизовій. Їх є декілька типів і вони кислоторезистентні. Ці пептиди також містяться в інших частинах шлунково-кишкового тракту, у гіпоталамусі та гіпофізі й у швидко-проліферувальних тканинах. Для цих сполук характерна трипетлева будова біля амінокінців і скріплення їх дисульфідними зв’язками. Отже, вони подібні до трилисної конюшини. У мишей з нокаутом гена одного з цих пептидів шлунковий та кишковий епітелій стає гістологічно аномальний і є великий ризик розвитку добро- та злоякісних пухлин слизової.
Вміст електролітів у шлунковому соці змінюється відповідно до рівня секреції. За низького рівня секреції концентрація Na+ висока, а Н+ - низька, однак зі збільшенням секреції кислоти концентрація Na+ зменшується.
Таблиця 26-5. Склад шлункового соку у нормі (натще)

Секреція пепсиногену
Головні клітини, які секретують пепсиногени, - неактивні попередники пепсинів у шлунковому соці (див. Розділ 25); вони вміщують гранули зимогену. Секреторний процес подібний до того, що відбувається під час секреції трипсиногену та інших панкреатичних ензимів підшлункової залози. Активність пепсиногену можна визначити у плазмі та в сечі, де його називають уропепсиногеном.
Секреція соляної кислоти
Складно одержати продукти секреції парієтальних залоз без домішок інших секретів шлунка, однак найчистіший проаналізований є ізотонічним, що важливо. Концентрація цих продуктів Н+ еквівалентна до 0,17 Н НСl з pH до 0,87. Тому секрет парієтальних клітин як ізотонічний розчин може бути важливим для чистої НСl, що вміщує 150 мекв Сl і 150 мекв для Н+ на літр. Незважаючи на це, значення pH цитоплазми парієтальних клітин подібне до pH інших клітин - 7,0-7,2 а порівняльна концентрація на літр плазми - близько 100 мекв для Сl і 0,00004 мекв для Н+. На апікальній оболонці парієтальних клітин розташована Н+-K+-АТФ-аза, яка нагнітає Н+ у протилежному напрямі до його концентраційного градієнта (рис. 26-10). Парієтальні клітини поляризовані: апікальні мембрани спрямовані в просвіт шлункових залоз, а базолатеральні мембрани контактують з інтерстиційною рідиною. Канальці продовжуються з апікальної поверхні всередину клітини (рис. 26-11). У решті клітин також розміщені в значній кількості тубуловезикулярні структури з молекулами H+ -К+-АТФ-ази на стінках. Рівень К+ всередині везикул зменшується, і молекули АТФ-ази неактивні. У разі подразнення парієтальних клітин тубуловезикулярні структури переміщуються до апікальної поверхні й зливаються з нею, таким способом постачаючи значно більше молекул АТФ-ази на мембрану. Це збільшує площу секреторної поверхні та сприяє утворенню численних мікроворсинок, які виступають до канальців. Молекули АТФ-ази після цього експонують до К+ у ПКР, і розпочинається Н+-К+-обмін.
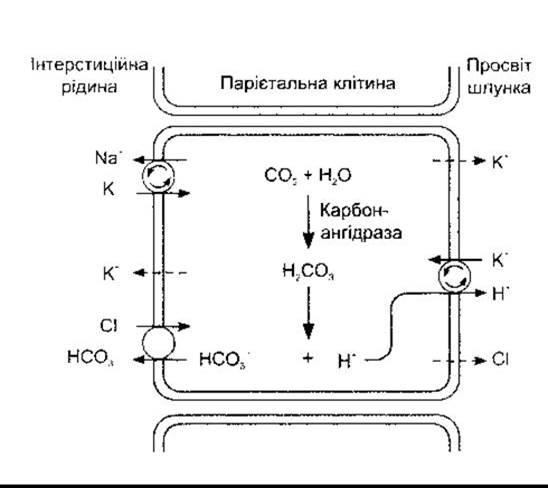
Рис. 26-10. Секреція HCl парієтальними клітинами шлунка. Активне транспортування за участю АТФ позначено стрілками у колах. Йони Н+ секретуються у простір канальців в обмін на К+ за участю Н+-К+-АТФ-ази. НСО3- обмінюється на Cl- у інтерстиційній рідині за допомогою антипорту, і Nа+-К+-АТФ-аза підтримує низький рівень внутрішньоклітинного Na+. Штрихові лінії позначають напрям дифузії. Порівняйте з рис. 38-20.
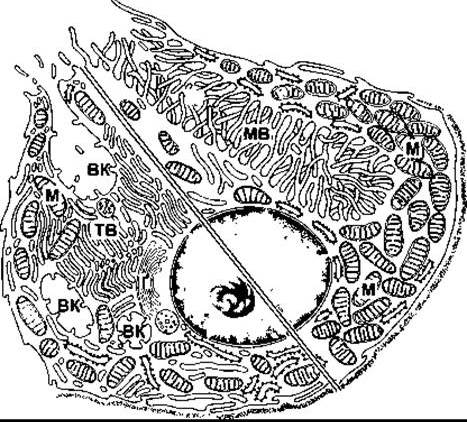
Рис. 26-11. Композитна схема парієтальної клітини, яка відображає клітину в стані спокою (внизу ліворуч) і в активному стані (вгорі праворуч). Клітина в стані спокою має внутрішньоклітинні секреторні канальці (ВК), які відкриваються на апікальну мембрану клітини, і систему тубуловезикулярних структур (ТВ) у цитоплазмі. У разі активування клітини ТВ з’єднуються з клітинною мембраною, і мікроворсинки (MB) простягаються у канальці, так що площа контактування клітинної мембрани зі шлунковим просвітом значно збільшується; М - мітохондрія, Ґ - апарат Ґольджі (відтворено за дозволом з Juqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. McGraw-Hill, 1998).
Випомповування Н+ з парієнтальних клітин в обмін на К+ потребує енергії, яку забезпечує гідроліз АТФ. Йони СІ також виштовхуються проти електрохімічного градієнта через канали, активовані цАМФ апікальної мембрани. Концентраційний градієнт спрямований досередини, однак назовні спрямований електричний градієнт, який є значно більшим. Йони К+ теж виштовхуються. Звільнені йони Н+ об’єднуються з Н2СО3, а, відповідно, Н2СО3 утворюється гідратацією (див. рис. 26-10). Цю реакцію каталізує карбононангідраза, а парієтальні клітини особливо багаті на цей ензим.
Унаслідок дисоціації Н2СО3 утворюється НСО3-, що його виштовхує антипорт на базалатеральну мембрану парієтальних клітин, які обмінюють НСО3 на інший аніон в інтерстиційній рідині, здебільшого на Сl. За рахунок відтоку НСО3 у кров шлунок набуває значень негативного дихального коефіцієнта, - кількість СО2 в артеріальній крові стає більшою, ніж у венозній крові шлунка. Після приймання їжі простежується підвищення секреції соляної кислоти, і може секретуватись достатня кількість Н+, спричинюючи підвищення рівня pH у крові та сечі, що стає більше лужною (транзиторне зменшення кислотності сечі після приймання їжі).
Секрецію кислоти стимулює гістамін через Н2-рецептори, ацетилхолін через М3 мускаринові рецептори і, напевно, гастрин через гастринові рецептори на мембранах парієтальних клітин (рис. 26-12). Рецептори Н2 збільшують внутрішньоклітинний вміст цАМФ через Gs, тоді як мускаринові гастринові рецептори впливають через збільшення внутрішньоклітинного вмісту вільного Са2+. Внутрішньоклітинні ефекти взаємодіють так, що активування одного рецептора потенціює відповідь іншого на подразнення. Простагландини, особливо які належать до класу Е, інгібують секрецію кислоти, активуючи Gi. І це пояснює частково збільшення випадків виразок у хворих, що приймають протизапальні лікарські засоби, які інгібують синтез простагландинів.
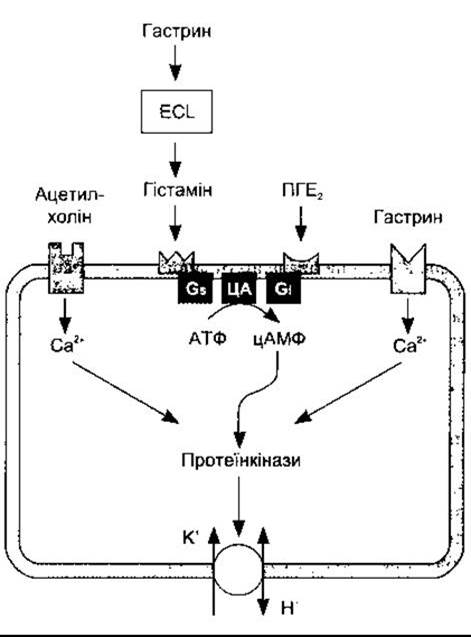
Рис. 26-12. Регулювання секреції кислоти парієтальними клітинами шлунка. Секреція кислоти посилюється у разі впливу ацетилхоліну на М3 мускаринові рецептори і збільшення внутрішньоклітинного Са2+. Крім того, гастрин стимулює секрецію гістаміну ентерохромафіноподібними (ECL) клітинами і це є головний шлях, яким гастрин стимулює секрецію Н+ Гістамін зв’язується з Н2-рецепторами, і через Gs збільшується активність аденілатциклази (АЦ) і внутрішньоклітинного цАМФ. ПГЕ2 впливає через G1, зменшуючи активність аденілатциклази і вміст внутрішньоклітинної цАМФ; цАМФ і Са2+ через протеїнкінази збільшують транспортування Н+ у шлунковий простір за участю Н+-К+-АТФ-ази.
ECL-клітини
Гастрин також стимулює секрецію гістаміну ентерохромафіноподібними (ECL - з англ. enterochromaffin-like cells) клітинами. Ці везикуло- або ґрануловмісні клітини належать до гіредомінантного типу ендокринних клітин у кислотосекретувальній ділянці шлунка. Тепер уже відомий головний шлях, яким гастрин стимулює секрецію соляної кислоти через ці клітини. ECL-клітини мають ацетилхолінові рецептори в додаток до гастринових, однак відносне значення ацетилхоліну у стимулюванні їхньої секреції ще остаточно не з’ясоване. Соматостатин інгібує їхню діяльність. ECL-клітини підлягають гіпертрофії у випадках, коли секреція соляної кислоти у шлунку пригнічена протягом тривалого часу.
Моторика шлунка та евакуація їжі зі шлунка
У разі надходження їжі у шлунок дно та верхня частина шлунка розслаблюються і пристосовують об’єм до незначного підвищення тиску (рецептивне розслаблення, або адаптивна релаксація). Потім розпочинається перистальтика у дистальному відділі тіла, змішування та подрібнення їжі. Невеликі, напіврідкі порції надходять через пілоричну частину шлунка у дванадцятипалу кишку.
Вплив блукаючого нерва стимулює рецептивну релаксацію, яка розпочинається рухами глотки і стравоходу. Перистальтичні рухи, регульовані БЕР шлунка, швидко розпочинаються та стрімко поширюються у напрямі до пілоричної частини шлунка. Кожна хвиля спричинює скорочення дистальної частини шлунка, інколи їх називають антральними систолами, і вони можуть тривати понад 10 с. Такі хвилі простежуються три або чотири рази за хвилину.
У механізмах регулювання евакуації вмісту шлунка, очевидно, антральна і пілорична частини шлунка та проксимальна частина дванадцятипалої кишки працюють як єдина система. За скороченнями антральної частини шлунка настають послідовні скорочення пілоричної частини і дванадцятипалої кишки. В антральній частині особливо сильні скорочення просовують допереду шлунковий вміст, затримуючи потрапляння твердих мас у дванадцятипалу кишку (вони знову змішуються і подрібнюються). Окремими порціями рідший шлунковий вміст надходить наче струмінь у тонку кишку. У нормі регургітація з дванадцятипалої кишки не відбувається, оскільки скорочення пілоричної частини шлунка схильні тривати дещо довше, ніж у дванадцятипалій кишці. Попередження регургітації вмісту може також відбуватись унаслідок стимулювального впливу ХЦК і секретину на пілоричний сфінктер.
Голодні скорочення
Уважають, що скорочення шлунка в періоди між прийманням їжі пов’язані з ММК; інколи вони можуть бути відчутними і навіть спричинювати помірний біль. Такі голодні скорочення зумовлюють відчуття болю; колись думали, що вони є важливим регулятором апетиту. Хоча експериментальні дослідження свідчать, що приймання їжі є нормальним у тварин після денервації шлунка та кишки (Розділ 14).
Мозкові впливи
Наявність їжі у ротовій порожнині рефлекторно стимулює шлункову секрецію. Еферентними волокнами цього рефлексу є блукаючий нерв. Реалізація умовних рефлексів відбувається через вплив блукаючого нерва на підвищення шлункової секреції. У людей, наприклад, вигляд, запах, думки про їжу збільшують шлункову секрецію. Така дія зумовлена травними умовними рефлексами, що усталюються з раннього періоду життя.
Утворення умовних рефлексів та їхні нейромеханізми описані у Розділі 16. Подразнення передньої частини гіпоталамуса та прилеглих частин очноямкових закруток лобової частки збільшує еферентну активність блукаючого нерва та шлункову секрецію. Мозкові впливи відповідають за одну третю (інколи за половину) секреції кислоти у відповідь на звичайні нормальні харчові продукти.
Вплив емоцій
Психічні стани впливають на шлункову секрецію та моторику, що реалізуються головно через блукаючий нерв. Вільям Бюмонт виконав визначні спостереження за А.Ст.Мартіном з Канади, який мав тривалу фістулу шлунка внаслідок проникаючого вогнепального поранення, і зауважив, що гнів та ворожість супроводжувані тургором, гіперемією та гіперсекрецією у шлунковій слизовій. Подальші спостереження зроблені й на інших хворих зі шлунковими фістулами. З’ясовано, що страх і депресія зменшують шлункову секрецію, кровопостачання та інгібують шлункову моторику.
Вплив шлунка
Їжа, що надійшла в шлунок, збільшує шлункову секрецію, зумовлювану виглядом і запахом їжі та наявністю їжі у ротовій порожнині (рис. 26-13). Рецептори стінки шлунка та слизової оболонки відповідають на розтяг та хімічне подразнення головно амінокислотами і спорідненими продуктами травлення. Волокна від рецепторів прямують до підслизового сплетення, де містяться тіла клітин рецепторних нейронів. Вони утворюють синапси на постганглюнарних парасимпатичних нейронах, що закінчуються на парістальних клітинах, і стимулюють секрецію. Отже, відповідь (утворення кислоти) продукована місцевим рефлексом, у якому рефлекторна дуга є повністю всередині стінки шлунка. Постгангліонарні нейрони місцевої рефлекторної дуги такі ж, як і ті, що їх іннервують низхідні вагусні прегангліонарні нейрони з головного мозку, які зумовлюють мозкову фазу секреції. Продукти травлення білків теж стимулюють збільшення секреції гастрину і збільшують кислотопродукування.
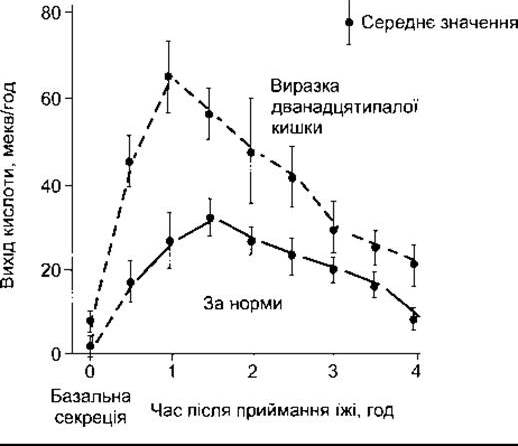
Рис. 26-13. Динаміка секреції кислоти у шлунку людини після приймання м’ясної їжі (відтворено за дозволом з Brooks FP: Integrative lecture: Response of the Gl tract to a meal. Undergraduate Teaching Project. American Gastroenterological Association, 1974).
Регулювання шлункової секреції
Регулювання моторики та секреції у шлунку відбувається із залученням нейрогуморальних механізмів. Нервове регулювання представлене місцевими автономними рефлексами, у тім числі холінергічними нейронами та передаванням імпульсів з ЦНС блукаючим нервом. Гуморальні компоненти забезпечені гормонами, які описані вище. Подразнення блукаючого нерва збільшує секрецію гастрину завдяки вивільненню гастрин-рилізинг пептиду (див. вище). Інші волокна блукаючого нерва вивільняють ацетилхолін, який безпосередньо впливає на клітини залоз тіла і дна, збільшуючи секрецію соляної кислоти та пепсинів. Подразнення шийного або грудного частин блукаючого нерва збільшує секрецію кислоти і пепсину, проте ваготомія не блокує секреторну відповідь на місцевий подразник.
Для зручності фізіологічне регулювання шлункової секреції звичайно характеризують у термінах мозковий, шлунковий та кишковий вплив, хоча вони перекриваються. Мозкові впливи - це опосередковані блукаючим нервом відповіді внаслідок активності ЦНС. Шлунковий вплив - це первинні місцеві рефлекторні відповіді та відповідь на вплив гастрину. Кишковий вплив - це рефлекс та гормональний ефект за механізмом зворотного зв’язку шлункової секреції, розпочатий зі слизової тонкої кишки.
Вплив кишки
Незважаючи на те, що гастринопродукувальні клітини містяться у слизовій тонкої кишки, як і в шлунку, введення амінокислот безпосередньо у дванадцятипалу кишку не підвищує рівня циркулювального гастрину. Жири, вуглеводи та кислота у дванадцятипалій кишці інгібують секрецію шлункової кислоти і пепсину та шлункову моторику за допомогою нейрогуморальних механізмів. Роль ентерогастрону - кишкового гормону, що відповідає за інгібування шлункової кислоти, - остаточно не з’ясована. Можливо, це буде пептид YY (див. вище). Секреція шлункової кислоти збільшується в разі наступного видалення великої частини тонкої кишки. Гіперсекреція, яка пропорційна ступеню кількості видаленої кишки, можливо, настає внаслідок руйнування джерела гормонів, що інгібують секрецію кислоти.
Інші впливи
Гіпоглікемія впливає через головний мозок і а еферентний блукаючий нерв, що стимулює секрецію кислоти і пепсину. Іншими стимуляторами є алкоголь та кофеїн, які безпосередньо впливають на слизову. Невеликі кількості алкоголю корисно впливають на травлення внаслідок стимулювання шлункової секреції, що відомо ще зі стародавніх часів.
Регулювання шлункової моторики та евакуювання
Евакуювання вмісту зі шлунка відбувається залежно від якості спожитих харчових продуктів. Їжа, багата на вуглеводи, виходить зі шлунка через декілька годин, білкова їжа - повільніше, а евакуювання зі шлунка жирної їжі - ще повільніше (рис. 26-14). Швидкість випорожнення також залежить від осмотичного тиску хімусу, що надходить у дванадцятипалу кишку. Гіперосмолярність дуоденального вмісту аналізують осморецептори дванадцятипалої кишки, які ініціюють сповільнення шлункової евакуації, що її виконує нервова система.
Продукти травлення білків та йони гідрогену, що омивають слизову дванадцятипалої кишки, розпочинають шлункову моторику - ентерогастральний рефлекс. Розтягнення дванадцятипалої кишки також ініціює цей рефлекс. Пептид YY інгібує шлункову моторику. У людей ваготомія може часто спричинювати виражену атонію та розтягнення шлунка. Збудження чи хвилювання прискорює випорожнення шлунка, а страх - сповільнює.
Оскільки жири особливо ефективні для гальмування випорожнень шлунка, то дехто п’є молоко, вершки або оливкову олію чи їсть вершкове масло перед уживанням алкогольних коктейлів. Жири затримують алкоголь у шлунку триваліший час, у такий спосіб і відтерміновується їхня абсорбція у тонкій кишці. Речовини, що спричинюють інтоксикацію, потрапляють у тонку кишку поволі, усталеними порціями. Так, принаймні теоретично, раптове підвищення концентрації алкоголю в крові і як закономірний результат - обтяжливу інтоксикацію, можна подолати.
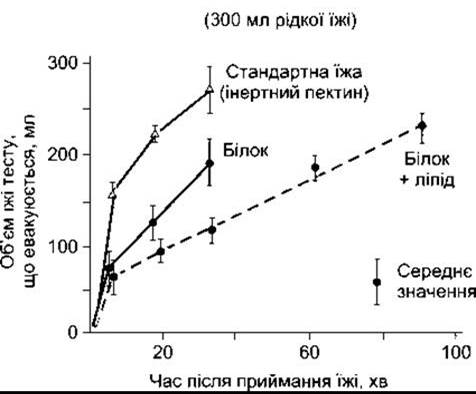
Рис. 26-14. Вплив білків та жирів на швидкість евакуювання зі шлунка людини. Особи спожили 300 мл рідкої їжі (відтворено за дозволом з Brooks FP: Integrative lecture: Response of the Gl tract to a meal. Undergraduate Teaching Project. American Gastroenterological Association, 1974).
Пептична виразка
Виникнення шлункових і дуоденальних виразок та ерозій у людей передусім пов’язане з порушенням бар’єра, який за нормальних умов попереджує подразнення та самоперетравлення слизової шлунковим секретом. Інфікування бактеріями Helicobacter pylori спричинює деструкцію цього бар’єру. Так діє аспірин та інші НСПЗП, які надзвичайно широко використовують як знеболювальне і для лікування артритів. Додатковою причиною ульцерації є тривалий надлишок кислоти. Приклад цього типу - виразки, що простежуються у випадку синдрому Золлінґера-Еллісона. Цей синдром характерний для хворих з гастриномами. Такі пухлини трапляються у шлунку та дванадцятипалій кишці, однак найбільше їх знаходять у підшлунковій залозі. Гастрин спричинює гіперсекрецію кислоти і появу важких виразок. Як звичайно, підвищена секреція кислоти наявна у всіх хворих з виразками дванадцятипалої кишки та препілоричної частини шлунка (немає кислоти - немає виразки).
Речовини, які застосовують для симптоматичного лікування виразок, зумовлюють гальмування кислотосекреції та підвищення резистентності слизової до кислоти. Різноманіття відмінних антацидів, більшість із яких вміщує алюміній гідроксид, магній гідроксид або кальцій бікарбонат, є доступними. Блокада Н2 гістамінових рецепторів за допомогою лікарських засобів Н2 блокаторів, таких як циметидин, ранітидин, нізатидин і фамотидин, ефективно зменшує кислотну секрецію, оскільки вони вилучають потенційний ефект подразнення цих рецепторів у відповідь надію інших подразників (див. вище). Мускаринові рецептори можна блокувати атропіном або новими специфічнішими антихолінергічними засобами. Шлункова Н+- К+-АТФ-аза може бути інгібована омепразолом. Сукральфат, основна алюмінієва сіль цукрози октасульфату, збільшує резистентність слизової до кислоти перш за все завдяки утворенню прикріплених білків та інших комплексів до місця виразки, вона також ефективна в лікуванні виразок.
Використання блокаторів Н2-рецепторів та омепразолу дало змогу зменшити потребу в хірургічному лікуванні виразок. Крім того, важкі дуоденальні та препілоричні виразки інколи лікують ваготомією в комбінації з видаленням гастриносекретувальної слизової антральної частини шлунка. Довготривале лікування омепразолом спричинює утворення в ECL-клітинах карциноїдних пухлин у щурів. У людей тільки незначно збільшується кількість гастрину в плазмі, проте карциноми не виявлені.
Сучасні дослідження причин пептичних виразок покликані з’ясувати проникаючу роль інфекції Н. pylori. Ерадикацію (знищення) Н. pylori забезпечують призначенням антибіотиків. Хворі з виразкою шлунка і дванадцятипалої кишки, які приймають НСПЗП, повинні припинити вживати їх або, якщо це неможливо, продовжити лікування довгодіючими агоністами ПГЕ, такими як мізопростол. Гастриноми потрібно видаляти хірургічно.
Інші функції шлунка
Крім депонування їжі та регулювання надходжень її у дванадцятипалу кишку, шлунок виконує ще декілька функцій.
Парієтальні клітини шлункової слизової, крім соляної кислоти, секретують внутрішній фактор, 49 кДа глікопротеїн, що зв’язує ціанокобаламін (вітамін В12), потрібний для всмоктування у тонкій кишці. Ціанокабаламін (рис. 26-15) - це комплексний кобальтовмісний вітамін, що його синтезують мікроорганізми. Неадекватна абсорбція цього вітаміну спричинює анемію, що супроводжується появою у кров’яному руслі великих примітивних попередників еритроцитів, які називають мегалобластами, та ушкодженням певних сенсорних шляхів у ЦНС. Повна ремісія дефіцитного синдрому настає в разі парентерального введення ціанокобаламіну, однак не у випадку споживання per os, оскільки внутрішній фактор секретований слизовою оболонкою шлунка. Дефіцит унаслідок неадекватного харчового приймання ціанокабаламіну рідкісний, оскільки денний необхідний мінімум низький, і вітамін міститься у більшості харчових продуктів тваринного походження. Дефіцитні стани виявляються клінічно, тому першочергово потрібно думати про дефект абсорбції ціанокобаламіну. Неадекватна абсорбція може бути внаслідок первинних захворювань кишки, таких як спру або дефіцит внутрішнього фактора. Це трапляється після гастректомії або коли парієтальні клітини зруйновані хворобою. У разі перніціозної анемії парієтальні клітини є мішенями для автоімунної деструкції (автоімунний гастрит) або порушені хронічною бактеріальною інфекцією слизової оболонки (неавтоімунний гастрит).
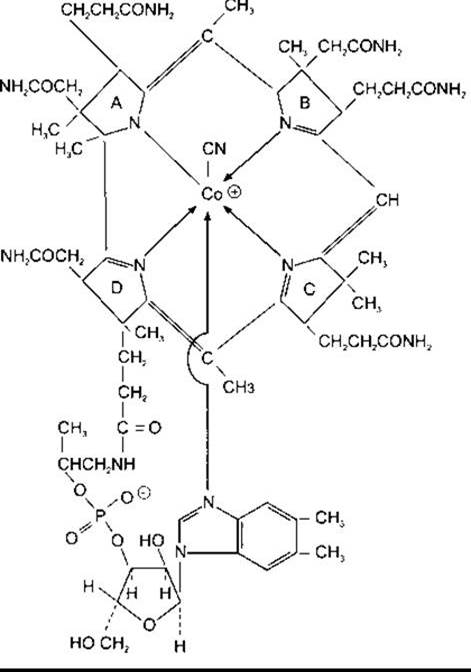
Рис. 26-15. Ціанокоболамін (вітамін В12). Емпірична формула С63Н88O14N14PCo
Комплекс внутрішній фактор-ціанокобаламін потім зв’язується зі специфічними рецепторами у клубовій кишці й абсорбується ендоцитозом. В ентероцитах ціанокобаламін переміщається із зовнішнього фактора до транскобаламіну II, іншого ціанокобаламінозв’язаного білка, який транспортує його у плазму.
У хворих з тотальною гастректомією дефіциту внутрішнього фактора можна уникнути парентеральним уведенням ціанокобаламіну. Травлення білків є нормальним без пепсинів, і живлення може бути збереженим. Крім того, ці хворі схильні до розвитку залізодефіцитної анемії (див. Розділ 25) та інших аномалій, тому вони повинні їсти часто і невеликими порціями. Оскільки швидке всмоктування глюкози з кишки і, як наслідок, гіперглікемія різко збільшує секрецію інсуліну, то у хворих з гастроектомією інколи розвивається гіпоглікемічний симптом через 2 год після приймання їжі (див. Розділ 19).
Слабість, запаморочення, пітливість після приймання їжі, що є частиною гіпоглікемії, створюють картину демпінґ-синдрому, дистрес-синдрому, що виникає у пацієнтів, у яких частини шлунка видалені, або голодна кишка анастомозована зі шлунком. Іншою причиною симптомів є швидке потрапляння гіпертонічного хімусу до кишки, що провокує переміщення більшої кількості води до кишки так, що виникає значна гіповолемія та гіпотензія.