БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 18. БІОТЕХНОЛОГІЇ ОДЕРЖАННЯ БІОЛОГІЧНО АКТИВНИХ ПРОДУКТІВ НА ОСНОВІ МЕТАЛОКОМПЛЕКСНИХ СПОЛУК
Розробка наукових основ створення і використання біологічно активних металокомплексних сполук передбачає одержання фундаментальних знань щодо механізмів регулювання біохімічних окисно-відновних процесів із застосуванням комплексів перехідних металів з біолігандами. При конструюванні біохелатів використовуються принципи одержання ефективно діючих біонеорганічних комплексів, які функціонують у клітинах ІПvivo. Є можливості моделювати властивості складних біокомплексів, шляхом створення спрощених аналогів, які характеризують найбільш суттєві ознаки вихідних сполук. Для цього необхідне проведення порівняння створюваного біокомплексу і моделі з використанням структурного і (або) функціонального підходу при конструюванні, тобто модель за структурою має бути аналогічною біокомплексу, що моделюється, чи його головного активного компонента; або модель, яка не має структурної ідентичності з вихідним біокомплексом, здатна виконувати аналогічні біологічні функції.
При створенні аналогів можливе одержання структур, які за своїми характеристиками перевищують вихідні біокомплекси, оскільки останні синтезуються в клітинах при невисоких концентраціях реагуючих речовин, температурах, тиску, у вузькому інтервалі рН. При конструюванні модельних систем є можливість для широкого варіювання цих параметрів.
Сконструйовані моделі біокомплексів спроможні виконувати різноманітні біологічні функції і мати значні переваги стосовно структур, утворених in vivo. В процесі конструювання біомоделей перш за все необхідно використовувати сучасні дані про шляхи утворення і транспорту біосистем, які моделюються,
проформи, у яких вони елімінуються з оточуючого середовища, транспортуються крізь мембрани клітин і досягають кінцевого пункту, де утворюють відповідні біокомплекси. Біокомплекси металів - це їх координаційні сполуки, які виконують певні функції в організмі.
Металопротеїни - комплекси металів з білками, які відіграють важливу роль у накопиченні, транспорті й активації молекулярного кисню з використанням його в різних окислювальних процесах. Під час метаболізму енергетичні потреби клітин задовольняються за рахунок енергії, яка вивільнюється при окисленні біосполук за участю кисню.
Одним з перспективних напрямів досліджень є моделювання ферментних систем, які беруть участь в окисно-відновних процесах, для вивчення механізмів біоактивації молекулярного кисню. Окисно-відновні процеси в організмі каталізуються ферментами-оксидоредуктазами.
Для вищих форм життя велике значення має молекулярний кисень, реакція відновлення якого щодо води - основа біоенергетики клітин. Молекулярний кисень в основному стані є бірадикалом, у якого два неспарених електрони з паралельними спінами знаходяться на різних розпушуючих π x і π молекулярних орбіталях. Саме тому молекулярний кисень є відносно інертною молекулою, бо за законом зберігання спіну в результаті взаємодії О2 з речовинами, якими заповнені орбіталі, повинен з’явитися бірадикал, але для такої реакції потрібна висока енергія активації (заборона за спіном). Таким чином, органічні молекули існують у кисневому оточенні завдяки забороні за спіном. Спінову заборону для реакцій триплетного кисню можливо подолати послідовним додаванням електронів:
![]()
Крім цього, О2 активно взаємодіє з органічними радикалами, у яких є неспарені електрони. Ці реакції мають важливе значення для клітин у ланцюгових радикальних процесах перекис- ного окислення ліпідів (ПОЛ). Кисень не вступає в прямі неферментативні реакції з органічними речовинами, але в клітинах є сформовані високоспеціалізовані ферментні системи, які беруть участь у відновленні кисню шляхом перенесення на нього одного, двох або чотирьох електронів. Ферменти, які відновлюють О2, є металопротеїдами, що мають активний центр з одним або декількома атомами перехідних металів (заліза, цинку, міді, марганцю, кобальту, молібдену). Ферментний контроль реакцій окислення за участю кисню зумовлюється слабкими внутрішніми магнітними збурюваннями та перемішуванням спінових станів діючих речовин у процесі окислення під впливом обмінних взаємодій з парамагнітними іонами металів. Метали активного центру виконують роль донорів електронів для кисню.
Процеси енергетичного забезпечення життєдіяльності клітин еукаріот підтримуються завдяки окисно-відновним реакціям за участю багатьох ферментних систем під контролем спінових ефектів. Проте навіть за умов високої специфічності процесів окислювального фосфорилювання в мітохондріях, або мікросомального окислення за участю монооксигеназ у всіх таких реакціях, де беруть участь металопротеїди і кисень, відбувається утворення активних метаболітів кисню — супероксиданіонрадикалу, гідроксилрадикалу, пероксиду водню, синглетного кисню та продуктів радикальних окислювальних реакцій: перекисних сполук, дієнових кон’югатів, малонового диальдегіду та інших.
У клітинах для захисту від токсичних метаболітів кисню і продуктів їх діяльності сформовані високоспеціалізовані системи ферментних антиоксидантів. Розрізняють чотири лінії ферментного захисту клітин від активних метаболітів кисню: 1) супероксиддисмутаза (СОД); 2) глутатіонпероксидаза (ГПО) і каталаза (КТ); 3) ГПО і глутатіонтрансфераза; 4) глутатіонтрансфераза, формальдегіддегідрогеназа, гліоксилаза, хінонредуктаза, епоксигідратаза.
Для окремих ферментів антиоксидантного захисту характерні специфічність дії клітинної і органної локалізації і використання як каталізаторів елементів Zn, Cu, Fe, Mn, Se. З метою зменшення токсичного впливу активних метаболітів кисню в експериментальній терапії використовують антиоксидантні ферменти СОД і каталазу. При введенні препарату СОД спостерігається накопичення пероксиду водню, що призводить до інактивації ферменту. При спільному введенні каталази, яка ферментативно перетворює токсичний Н2О2на нешкідливі Н2О і О2, СОД не втрачає активності навіть після дисмутації більше 103 радикалів О2- на моль ферменту. Оскільки супероксидрадикал частково інгібує КТ, стає зрозумілим, що спільне використання комплексу антиоксидантних ферментів значно збільшує їх ефект і попереджує утворення найбільш токсичного гідроксильного радикалу.
Одним з перспективних напрямів є використання в клінічній практиці препаратів СОД і КТ, що є ефективним при різних патологіях, пов’язаних з надлишковою індукцією високотоксичних активних форм кисню. Для попередження швидкої інактивації ферменту при потраплянні в біорідини є спроби використання іммобілізованих форм ферменту, що значно збільшує тривалість дії біокаталізатора. Другим практичним напрямом є моделювання низькомолекулярних комплексів антиоксидантних металоферментів, які є високоефективними каталізаторами і, на відміну від аналогів, можуть мати набагато вищу активність.
Комплекси металів з біолігандами - одна із форм найбільш наближених до оригіналу моделей металоферментів. Крім того, для низькомолекулярних моделей не існує проблеми щодо переносників і транспорту. Одним з таких прикладів є моделювання каталазної активності хелатами міді (ІІ) з поліамінами. Так, для прояву каталітичної активності комплексу в ньому мають бути два вільних координаційних місця, натомість як металохелати, у яких усі координаційні місця зайняті, не проявляють специфічної активності.
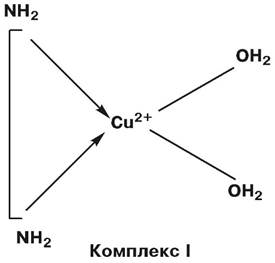
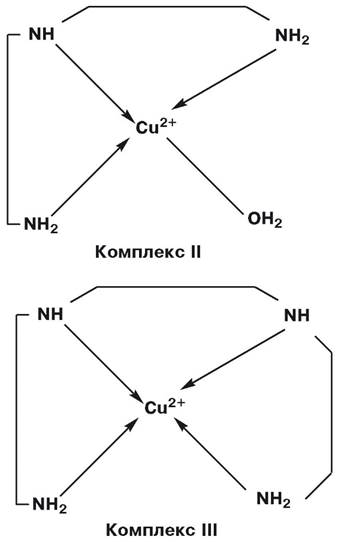
Моделювання дії каталази хелатними комплексами міді (ІІ):
![]()
Активність комплексів: І >> ІІ > ІІІ ~ 0.
При координації лігандів з металами, які мають окисні або відновні властивості, окисно-відновні властивості самих лігандів можуть змінюватися. Наприклад, якщо метал є окислювачем, то координації його з лігандом сприяє окисленню ліганду. Сам факт координації, при якій відбувається зміщення електронної щільності ліганду в бік льюісової кислоти (металу), сприяє збільшенню окислювальної здатності комплексних часточок.
Практичний інтерес мають системи, в яких ліганд скоординований з іоном металу, що легко відновлюється. Відновлення металу в таких системах супроводжується перетворенням ліганду у високореакційноздатний вільний радикал. Прикладом реакцій такого типу є каталіз іонами Си2+ автоокислення аскор- бату. Окислення аскорбату, яке каталізується іонами металів та іонами хелатованих металів, відрізняється. У присутності хела- тоутворюючих лігандів механізм дії міді (ІІ) інший. В цьому випадку швидкість реакції не залежить від концентрації кисню, а відновлення останнього відбувається не до пероксиду водню, а до води. Тобто введення ліганду суттєво змінює перебіг реакції. В присутності деяких лігандів каталітична активність іону металу збільшується, що, можливо, пов’язане зі збільшенням його окисно-відновного потенціалу. Але необхідно враховувати, що утворені комплекси можуть бути прооксидантами і порушувати окисно-відновний гомеостаз в організмі.
З урахуванням вищезгаданих відомостей про роль, стан і форми надходження біометалів у живих організмах у НДІ екології і біотехнології БДАУ проводяться багаторічні дослідження щодо створення металовмісних препаратів для потреб ветеринарної медицини і тваринництва.
Один з напрямів досліджень — створення ефективних препаратів для профілактики і лікування анемії молодняка сільськогосподарських тварин. Високий рівень смертності поросят раннього віку залишається однією з актуальних проблем сучасного свинарства.
Важлива роль при переході організму від пренатального до постнатального розвитку, що характеризується зміною кисневого режиму і виникненням стану гіпероксії, належить системі антиоксидантного захисту (АОЗ) клітин, які регулюють рівень активних метаболітів кисню: супероксидного аніонрадикалу, гідроксильного радикалу, пероксиду водню, синглетного кисню та ін. За фізіологічних умов у організмі постійно підтримується динамічна рівновага між прооксидантними і антиоксидантними системами. Надмірне підсилення вільнорадикального окислення субстратів на фоні пригнічення систем антиоксидантного захисту призводить до розвитку оксидативного стресу, який є одним з універсальних механізмів виникнення та розвитку
багатьох патологічних процесів. У новонароджених поросят посилення інтенсивності перекисного окислення ліпідів (ПОЛ) під впливом активних метаболітів кисню супроводжується загостренням анемічного стану. Для попередження анемії поросятам 3-4-денного віку внутрішньом’язово вводять препарати заліза (залізодекстран, фероглюкін-75, су'їферон, суїферовіт тощо). Однак це переважно однокомпонентні препарати імпортного виробництва, які містять тільки залізо, а в препаратах, у яких містяться Cu, Co тощо, ці мікроелементи знаходяться в неорганічній формі, яка менш ефективна, ніж комплексні, хелатні сполуки мікроелементів.
В НДІ екології і біотехнології БДАУ розроблені технології і одержані препарати, як однокомпонентні — «Ферокол» (аналог імпортних «Залізодекстран», «Урсоферан»), так і полікомпонентні: «Куфер», який містить залізо і мідь, «Біомет» з цими ж елементами і кобальтом, «Полімет» (Fe, Cu, Со, Zn ), «Полімет-Селен» (Fe, Cu, Со, Zn + Se), «Вітамет» (Fe, Cu, Со, Zn + комплекс вітамінів).
Адекватне забезпечення новонароджених поросят біодо- ступним, нетоксичним залізом є основним чинником у профілактиці залізодефіцитної анемії. Для нормалізації рівня гемоглобіну та відновлення запасів заліза в організмі потрібне введення необхідної кількості цього елемента в нетоксичній формі, яка легко засвоюється. Щоб правильно оцінити ефективність, безпечність та допустимість застосування залізовмісних препаратів слід ураховувати особливості метаболізму цього біоелемента в організмі тварин.
Залізо є обов’язковим і незамінним компонентом білків та ферментних систем організму, сприяє підтримці необхідного рівня системного і клітинного метаболізму, окисно-відновного гомеостазу в організмі в цілому. Водночас вільне, нехелатоване залізо каталізує окисно-відновні реакції, сприяє утворенню високотоксичних вільних радикалів, які спричиняють пероксидне пошкодження ліпопротеїдних клітинних мембран, порушення їхньої функції та загибель клітин.
Іони заліза відіграють важливу роль у взаємоперетвореннях в організмі активних метаболітів кисню і насамперед найбільш реакційно-здатного гідроксильного радикалу OH. При взаємодії Fe з пероксидом водню продуктом реакції є OH (реакція Фентона):
![]()
Гідроксильні радикали утворюються також у реакції взаємодії пероксиду водню з супероксиданіонрадикалом (0·2), яку каталізують іони Fe2+ (реакція Габера-Вейса):
![]()
Таким чином, залізо — необхідний елемент для живих клітин і водночас є потужним прооксидантом. Різноманітність ефектів заліза скоординована, що сприяє утворенню спеціалізованих молекул для зв’язування заліза, його транспортування та депонування в розчинних, нетоксичних для організму формах (трансферин, феритин). Одночасно сформувалась і регуляція гомеостазу заліза, яка дозволяє підтримувати основні життєво важливі клітинні функції та уникнути можливих пошкоджень.
Отже, при конструюванні залізовмісних препаратів для профілактики і лікування анемій слід ураховувати як зазначені обставини, так і сучасні вимоги до ін’єкційних препаратів такого напряму, які повинні відповідати наступним критеріям: форма заліза має бути такою, яка може ефективно використовуватися організмом тварин для біосинтезу гемоглобіну при одноразовому його застосуванні, сумісною з біорідинами та тканинами тіла, нетоксичною на всіх етапах транспортування в організмі тварин, з відповідною в’язкістю, у фізіологічних умовах не мати проок- сидантної дії та бути стабільною при тривалому зберіганні.
Препарати, створені в НДІ екології та біотехнології БДАУ задовольняють усі вимоги. В основу конструювання нетоксичної форми заліза нами було покладено будову молекули білка феритину, який бере участь у депонуванні в організмі заліза. У нещодавних дослідженнях японських вчених феритин намагалися використовувати з наступною метою. Як відомо, у деяких регіонах світу в продуктах харчування є дефіцит заліза в легкозасвоюваній організмом формі. Ця проблема надто актуальна для країн Південно-Східної Азії, де головний продукт харчування — рис. Для створення сортів рису, здатного до підвищеного накопичення заліза, проведена трансгенна операція. Із сої ви
ділено ген феритину з підвищеною активністю, який було вбудовано в геном рису. Встановлено, що в зерні трансформованих рослин накопичення феритину втричі більше, ніж у зерні рослин вихідних ліній. Інший, оригінальний біотеxнологічний підхід, в якому за основу взято будову феритину, використаний у вітчизняних дослідженнях. З тканин піддослідних тварин було виділено цей залізодепонуючий білок, вивчені у його складі форми заліза та властивості останнього. В модельних експериментах проведені та визначені умови формування кластерних сполук заліза, які характерні для нативної структури феритину.
На основі цих результатів розроблена технологія одержання залізовмісних препаратів. В отриманих препаратах залізо знаходиться у формі захищеного вуглеводною оболонкою ядра, що містить активну речовину у вигляді кристалітів (великих кластерів) гідроксиду заліза, подібних до тих, що знаходяться у складі природного залізодепонуючого білка феритину, і за фізіологічних умов не мають прооксидантної дії. Крім заліза, до складу препаратів уведено біометали (мідь, кобальт, цинк, селен), присутність яких необхідна для процесів гемопоезу, і які є простетичними групами антиоксидантних ферментів (церуло- плазміну, Cu-Zn-супероксиддисмутази, глутатіонпероксидази).
Метали існують у вигляді хелатів з амінокислотами, що підвищує доступність металів у процесі їх метаболізму в організмі. Одним з основних факторів, що визначають спорідненість органічних молекул до іонів металів, є хелатний ефект. Під цим терміном розуміють чітко виражену здатність органічної молекули зв’язувати іони металів за наявності в ній двох або більшої кількості груп, здатних до хелатування.
Хелатоутворення часто змінює хімічні і фізичні властивості вихідних реагентів і відіграє значну роль у біології. Ефект хелатоутворення має місце при створенні таких важливих металовмісних молекул, як порфірини, хлорофіл, кальцієзв’язувальні білки тощо. Функціональна активність металів-біотиків у організмі, їх участь у процесах метаболізму пов’язані зі здатністю біометалів утворювати хелатні комплекси.
Комплекси метал-біоліганд мають високу біологічну активність, завдяки чому досягається їх висока засвоюваність, а за рахунок поступового розриву хелатних зв’язків - пролонгованість
дії. Після розщеплення комплексу як метали, так і біоліганди (амінокислоти та ін.) ефективно використовуються організмом у процесах метаболізму. Проведені дослідження вказують на принципову можливість використання металокомплексних каталізаторів для регулювання важливих електронтранспортних процесів клітини (для регулювання редокс-процесів клітини). Використання металохелатних препаратів дозволяє значно зменшувати дози мікроелементів у раціонах, ефективно вирішити екологічні та економічні проблеми сільськогосподарского виробництва. Широкому використанню залізодекстранових препаратів в комплексі з металохелатними сполуками перешкоджають технологічні труднощі одержання таких комплексних препаратів.
В НДІ екології і біотехнології БДАУ протягом останніх років розробляються технології одержання полікомпонентних препаратів, які містять біоелементи (залізо, мідь, кобальт) в комплексі з біолігандами. Вибір цих мікроелементів у створених препаратах пояснюється їх важливою роллю в процесах ге- мопоеза, обмінних і окисно-відновних процесах організму.
Залізо є компонентом важливих залізовмісних білків, у тому числі ферментів, у складі яких знаходиться в гемовій і негемовій формах. Основна маса заліза у вигляді гему включена в гемоглобін. Залізо входить до складу цитохрома Р-450, цитохромів дихального ланцюга мітохондрій, важливих антиоксидантних ферментів (каталази). Залізо необхідне не тільки для забезпечення організму киснем, а й функціонування дихального ланцюга, синтезу молекул АТФ, процесів метаболізму і детоксикації різних сполук, синтезу ДНК. Найбільш виражена форма прояву дефіциту заліза - залізодефіцитна анемія.
Мідь відіграє важливу роль у процесах біосинтезу гему і гемоглобіну. Тому дефіцит міді, як і заліза, призводить до виникнення анемії. Мідь - структурний елемент ферменту дихального ланцюга мітохондрій — цитохромоксидази, яка бере участь у процесах генерації енергії у клітинах. Важливу роль відіграє мідь в антиоксидантному захисті організму, вона поряд з цинком входить до складу тканевого антиоксидантного ферменту — супероксиддисмутази (СОД) й основного антиоксидантного білка плазми крові - церулоплазміну (ЦП). Цинк входить до структури активного центру багатьох металоферментів. Він необхідний для функціонування ДНК- і РНК-полімераз-ферментів, які беруть участь у процесах передачі генетичної інформації і біосинтезу білків, ферменту ключової реакції біосинтезу гему, який входить до складу гемоглобіну; цитохромів дихального ланцюга мітохондрій, цитохрому Р-450, каталази, інших важливих ферментів.
Цинк є обов’язковим компонентом одного з основних антиоксидантних ферментів (Zn, Cu) — супероксиддисмутази, бере участь в індукції біосинтезу важливих захисних білків клітини - металотіонеінів, тому цей елемент належить до антиоксидантів репаративної дії. Цинк відіграє надзвичайно важливу роль у процесах реалізації гормональних функцій в організмі, впливає на продукцію і функціонування інсуліну. Цинк необхідний для функціонування тимусу і забезпечення нормального стану імунної системи організму, він є компонентом ретинолтранспортного білка, поряд з вітамінами А і С перешкоджає імуносупресії, стимулює синтез антитіл. Цинк відіграє важливу роль у протеїновому, вуглеводному і ліпідному обмінах. Характерною ознакою нестачі цинку у молодняка свиней є зроговіння шкіри, прояви паракератозу, зниження продуктивності, у хрячків затримується розвиток сім’яників.
Кобальт — необхідний компонент вітаміну В12. Важливе значення має здатність вітаміну В12 регулювати процеси кровотворення, що пов’язано з його участю в синтезі пуринових і піримідинових основ нуклеїнових кислот, накопиченням в еритроцитах сірковмісних сполук. Роль вітаміну В12 в процесах метаболізму визначається його участю (у складі кобаламінових ферментів) в білковому, ліпідному і вуглеводному обмінах. Селен є кофактором ферменту йодотиронін-дейодинази, входить до складу такого важливого ферменту антиоксидантного захисту клітин, як глутатіонпероксидаза.
Селен у створених препаратах знаходиться в комплексі з амінокислотами, оскільки ця форма менш токсична, ніж неорганічні форми селену.
Залізо - важливий елемент для всіх організмів, але надлишок його призводить до негативних наслідків. Значна кількість заліза в тканинах знаходиться у вигляді гемових білків, а до не- гемового заліза належать деякі залізосірчані білки, а також білки, здатні депонувати залізо (феритин, гемосидерин), трансфе- рин та незначна кількість низькомолекулярних комплексів заліза з окремими лігандами: цитратом, деякими амінокислотами, фосфатними сполуками та ін. Ці комплекси є причиною ураження тканин продуктами вільнорадикального окислення ліпідів, білків та інших речовин.
Результати багатьох досліджень вказують на те, що однією з перших реакцій організму на будь-яку стресову ситуацію (включаючи оксидативний стрес), є збільшення інтенсивності процесів перекисного окислення ліпідів у мембранних структурах клітини. Основну роль у регуляції антиоксидантних захисних систем клітини, які нейтралізують негативний вплив як токсикантів, так і метаболітів, утворених під їх впливом, відіграють ферментні системи метаболізму і детоксикації різних класів сполук. Знешкодження цих речовин є багатоступеневим процесом, у якому беруть участь спряжені ферменти системи: супероксиддисмутаза (СОД), глутатіонпероксидаза (ГП), каталаза і система глутатіону. Тому введення до складу препарату мікроелементів, здатних індукувати синтез ферментів антиоксидантного захисту, викликає певний практичний інтерес.
Є відомості, що введення тваринам залізодекстранових препаратів спричиняє виникнення оксидативного стресу, тобто призводить до активації перекисного окислення ліпідів (ПОЛ). Слід зазначити, що швидке відновлення нестачі антирадикальних речовин в організмі лімітується процесами їх транспорту. Тому більш ефективним може бути використанння синтезованих комплексів, які, з одного боку можуть індукувати синтез ферментів антиоксидантного захисту, з іншого — ці низькомолекулярні сполуки, для яких в організмі не існує специфічних транспортних механізмів, можуть самі бути інгібіторами перекисного окислення ліпідів (ПОЛ).
Таким чином, з урахуванням ролі вищезгаданих металів-біотиків в окисно-відновних процесах і процесах гемопоеза, в лабораторіях НДІ було одержано стійкі і стабільні комплексні препарати для профілактики та лікування анемій, які містять ці біометали в оптимальних співвідношеннях. На препарати складена відповідна Нормативно-технічна документація та настанови із застосування, затверджені Державним департаментом ветеринарної медицини МАП України. На препарати, технологію їх отримання та компонентний склад одержані патенти України.
Препарати пройшли успішну апробацію в господарствах України різних форм власності та за кордоном (Республіка Чехія). Для перевірки ефективності застосування створених препаратів протягом останніх років проводяться виробничі досліди в умовах повнораціонної годівлі та високої технології утримання тварин у Чеській Республиці. У 2002 році в навчально-дослідному господарстві Чеського аграрного університету міста Прага, Червений уєзд, район Прага-захід на поросятах віком від народження до 45 днів перевіряли ефективність створених препаратів. Було сформовано 3 групи поросят по 30 голів за принципом аналогів. Препарати вводили поросятам 4-денного віку. Зважування проводили на 4-й, 15-й, 30-й і 45-й дні життя. Результати вивчення ефективності застосування антианемічних препаратів наведені в таблицях 18.1, 18.2.
Таблиця 18.1.
Порівняльна характеристика ефективності застосування препаратів для профілактики анемій у новонароджених поросят
1 дослідна група «Феррібіон» Республіка Чехія |
||||
Дні досліду Жива маса, кг |
4-й 1,91±0,043 |
15-й 3,92±0,11 |
30-й 8,29±0,15 2 |
45-й 12,37±0,39 |
2 дослідна група « Полімет » Україна |
||||
Дні досліду Жива маса, кг |
4-й 1,98±0,063 |
15-й 4,14±0,095 |
30-й 8,68±0,14 |
45-й 13,08±0,29 |
3 дослідна група «Полімет-В12» Україна |
||||
Дні досліду Жива маса, кг |
4-й 1,93±0,051 |
15-й 4,16±0,107 |
30-й 9,73±0,23 |
45-й 14,03±0,42 |
Таблиця 18.2.
Збереженість поголів’я
Група |
Кількість голів у групі |
Збереженість, % |
1 дослідна |
30 |
86,7 |
2 дослідна |
30 |
90,0 |
3 дослідна |
30 |
93,3 |
Отримані результати досліджень свідчать, що такі препарати, як: залізовмісний (Феррібіон), залізомідьцинккобальтовмісний (Полімет) та комплексний (Полімет-В12) є ефективними засобами профілактики аліментарних анемій поросят-сисунів. Встановлено, що препарати Полімет і Полімет-В12 за ефективністю дії не поступаються препарату Феррібіон (виробник - Республіка Чехія), а за технолого-економічними показниками мають переваги при профілактиці та лікуванні анемії у поросят.
Таким чином, практика багаторічних досліджень НДІ екології і біотехнології дозволила з’ясувати основні закономірності процесів комплексоутворення, залежність між структурою лігандів та їх комплексоутворюючою здатністю, що дозволило в подальшому конструювати складні біокомплекси із заданими характеристиками.
В результаті модельних, лабораторних, науково-виробничих досліджень встановлені механізми цілеспрямованого регулювання дії сконструйованих комплексів у необхідному напрямі, що дозволило створити ефективні профілактично-лікувальні засоби широкого спектра дії.