БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
РОЗДІЛ 4. КЛІТИННА ІНЖЕНЕРІЯ
4.4.БІОТЕХНОЛОГІЯ ПЕРЕНЕСЕННЯ ГЕНІВ У СОМАТИЧНІ КЛІТИНИ ЗА ДОПОМОГОЮ МЕТАФАЗНИХ ХРОМОСОМ
Можливість перенесення чужорідної генетичної інформації в соматичні клітини тварин за допомогою метафазних хромосом була доведена Мак-Брайдом О.У. та Озером Х.Л. (1973). Отримані результати перенесення генів, що кодують тимідинкіназу і гіпоксантинфосфорибозилтрансферазу, у соматичні клітини за допомогою метафазних хромосом були підтверджені дослідами in vitro іншими дослідниками (рис. 4.2).
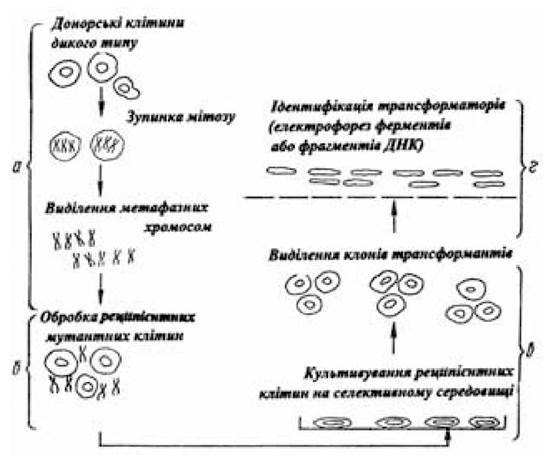
Рис. 4.2. Схема перенесення генів у соматичні клітини з допомогою метафазних хромосом
(за Серовим О.Л., 1985)
З генетичного матеріалу, носіями якого є окремі ізольовані хромосоми, можливе створення «бібліотек» рекомбінантних ДНК. Цей прийом може бути використаний як для картування генів, так і для їхнього виділення. Спроможність методу ізольованих хромосом, який використовують для проведення картування, перевершує метод гібридизації соматичних клітин, але поступається за обсягом і глибиною інформації, що одержують за допомогою прийомів конструювання рекомбінантних ДНК. Ізольовані хромосоми були використані для картування гена α-глобіну людини. Отримані цим методом результати узгоджуються з раніше установленим фактом локалізації гена α-глобіну в хромосомі 16. Щоб широко використовувати метод ізольованих хромосом у вирішенні різноманітних проблем біології і пов’язаних з її досягненнями прикладних наукових напрямів (від вивчення механізмів генної регуляції до проблем медицини і галузей сільського господарства), необхідно мати достатній набір селективних середовищ. Для кожної хромосоми потрібні селектовані маркери такої специфічності і доступності, як для виділення трансформантів (трансформанти — це клітини чи клітинні клони, у яких міститься перенесений за допомогою ме- тафазних хромосом генетичний матеріал). Чужорідний генетичний матеріал, перенесений у реципієнтні клітини, називається трансгеном. Якщо обсяг цього матеріалу такий, що його присутність у реципієнтній клітині визначається цитогенетичним шляхом, говорять про макротрансгеном. Мікротрансгеном — це та кількість перенесеного за допомогою метафазних хромосом генетичного матеріалу, що цитогенетичним шляхом установити неможливо. При цьому варто мати на увазі, що така хромосома людини, як 16, містить ген, який кодує аденінфосфорибозилтрансферазу, 17-ген, що кодує тимідинкіназу, і Х-хромосома — ген, що кодує гіпоксантинфосфорибозилтрансферазу.
Перенесення генетичного матеріалу в реципієнтні клітини є багатоступінчастим процесом. Для одержання великої кількості мітотичних клітин їх затримують у стадії мітозу (синхронізація клітин), а потім виділяють метафазні хромосоми, суспензією яких обробляють реципієнтні клітини. Наступна стадія — виділення, розмноження й аналіз трансформантів (ідентифікація ознаки донорського геному в трансформантах). Джерелом метафазних хромосом (донорські клітини) найчастіше є фібробласти первинних культур чи фібробластоподібні клітини первинних ліній клітин жаби, китайського хом’ячка, миші, пацюка, людини, генотип яких відноситься до дикого типу. Еукаріотичні клітини, у яких з донорських клітин за допомогою метафазних хромосом переноситься генетичний матеріал (реципієнтні клітини), є мутантними лініями. У їхніх клітинах не реалізується гіпоксантинфосфорибозилтрансферазна, тимідинкіназна, аденозинфосфорибозилтрансферазна, аргінінсукцинатсинтетазна активність. Про перенесення, що відбулося, макро- чи мікротрансгенома з донорської в реципієнтну клітину свідчить встановлення в останній раніше відсутньої ферментативної активності і здатності цих клітин рости на відповідних селективних поживних середовищах. Перенесений з донорських клітин, що є носіями таких кодуючих генами властивостей, як резистентність до високих концентрацій метатрексата, що виступає як інгібітор дегідрофолатредуктази, а також таких ознак злоякісності, як здатність рости на агаровому середовищі або при низьких концентраціях сироватки, генетичний матеріал у нормальних за цими ознаками реципієнтних клітинах обумовлює індукування властивостей, притаманних донорським клітинам. Це, з одного боку, підтверджує факт перенесення, що відбулося, а з іншого — є прийомом вивчення морфології і біохімії хромосом.
Щоб досягти успіху в перенесенні генів за допомогою метафазних хромосом, насамперед необхідно одержати в моношаровій культурі велику кількість мітотичних клітин. Для цього використовується прийом, що полягає в синхронізації клітин за допомогою введення в середовище колхіцину чи колцеміду (0,06 мкг/мл). Завдяки цьому прийому клітини затримуються на стадії мітозу і в клітинній популяції кількість їх досягає 94-97 %. Зупинені на стадії метафази клітини моношарової культури бувають слабко прикріплені до субстрату і при струшуванні легко відокремлюються від нього і спливають. Клітини ссавців культивуються в культурі при температурі 37 оС, а для вирощування курячих клітин температуру доводять до 41 оС.
Для виконання наступної операції (руйнування клітинної мембрани) метафазні клітини поміщають у гіпотонічний розчин. Висока ефективність руйнування клітинних мембран і звільнення метафазних хромосом досягається при використанні гомогенізаторів типу Даунса чи шприців (5 мл) з тонкою голкою (№ 22), через яку пропускають клітинну суспензію. При виконанні цих операцій використовується нейтральний буферний розчин (pH 7), що складається з трис-HCl (0,02 моль/л), гексиленгліколю чи детергентів (тритон Х-100, твін-80), а для стабілізації хромосом уводять іони Са2+; Mg2+. Усі операції виконуються в стерильних умовах.
Процедура руйнування клітин контролюється фазовоконтрастним мікроскопом. Перевага надається обережному руйнуванню клітинних мембран, тому що при грубій процедурі виділення ушкоджуються не тільки клітинні мембрани, але й хромосоми, структура яких надалі не відновлюється.
Контрольованим параметром при виділенні метафазних хромосом є температурний режим. Відокремлені тим чи іншим способом синхронізовані мітотичні клітини інкубуються у свіжому середовищі при 4 оС, що приводить до інактивації трипсину, розчинення можливих залишків колцеміду і спонтанного руйнування тих мікротрубочок, що збереглися після обробки колцемідом. Це знижує здатність хромосом до агрегації і зменшує їхнє забруднення. Наступне центрифугування клітинної суспензії, видалення надосадової рідини пастерівською піпеткою і відмивання осаду нейтральним буферним розчином проводяться при 4 оС. Утворений після чергового центрифугування осад ресуспендують в охолодженому буферному розчині й інкубують 10-15 хв на водяній бані при 37 оС. Операції з руйнування клітин і звільнення метафазних хромосом здійснюються при температурі 37 оС і проводяться якнайшвидше. Для наступних етапів перенесення хромосом необхідна низька температура (4 оС). Кислі буферні системи при одержанні метафазних хромосом використовують рідше, тому що висока концентрація іонів водню в поєднанні з двовалентними катіонами сприяє агрегації залишків цитоплазми, що заважає одержанню чистих препаратів хромосом.
Щоб уникнути забруднення ізольованих метафазних хромосом інтерфазними ядрами і незруйнованими клітинами, проводять цитологічний аналіз отриманих препаратів. У препаратах
ізольованих хромосом, вільних від забруднюючих компонентів, відношення білок : ДНК дорівнює 2,2, а РНК : ДНК — менше 0,1; ізольовані метафазні хромосоми при температурі 5 оС витримують тривале зберігання без будь-яких помітних змін морфологічних властивостей, хоча молекулярна маса хромосомної ДНК неухильно зменшується, що, очевидно, є наслідком забруднення препаратів хромосом ендонуклеазами. Тому для перенесення генів, як правило, використовують метафазні хромосоми, що містять високополімерну ДНК з молекулярною масою не менше 100 млн., відразу після їхнього виділення.
Клітини-реципієнти на стадії логарифмічного росту обробляють концентрованою суспензією очищених метафазних хромосом. Відношення кількості донорських хромосом, що додаються, до кількості хромосом, що містяться в геномі реципієнтних клітин, складає 1:1. В експериментах за звичай використовується 5-10 млн реципієнтних клітин.
Частота перенесення селектованого гена-маркера ГФРТ китайського хом’яка в клітини миші складає 10-7-10-6 у перерахунку на одну реципієнтну клітину. Для збільшення частоти перенесення генів до суспензії метафазних хромосом у нейтральному фосфатному буфері додають таку кількість хлористого кальцію, щоб його кінцева концентрація досягла 0,125-0,250 М. Відбувається спільне осадження фосфату кальцію і метафазних хромосом. При додаванні їх до моношару реципієнтних клітин підвищується ефективність перенесенню функціонального гена в 10 разів, а сполучення описаного методу з наступною інкубацією моношару реципієнтних клітин у середовищі з 7-10 % кінцевою концентрацією диметилсульфоксиду підвищує ефективність перенесення генів у 100 разів. Використання інактивованого вірусу Сендай при інкубуванні реципієнтних клітин, що знаходяться на стадії метафази, із суспензією донорських хромосом, підвищує ефективність перенесення приблизно в 10 разів, а укладення ізольованих метафазних хромосом у штучну ліпідну мембрану дозволяє довести ефективність перенесення до 10-5 з розрахунку на одну реципієнтну клітину.
Як уже було зазначено, реалізація потенційних можливостей методу перенесення метафазних хромосом у реципієнтні клітини значною мірою гальмується через труднощі, що виникають при їхній ідентифікації. В останні роки запропоновані методи, що дозволили значно підвищити об’єктивність ідентифікації хромосом. Серед цих методів варто назвати послідовне диференціальне фарбування хромосом за Гімза й акрихіном на G/Q-смуги; поділ ізольованих метафазних хромосом на групи за їх розмірами при центрифугуванні в градієнті сахарози. Для масового виділення однотипних хромосом пропонується використання методу фракціонування в градієнті щільності з наступним сортуванням отриманої фракції методом проточної цитометрії. Отриманий таким шляхом хромосомний матеріал призначений для подальшого використання в біологічних експериментах. Фракція, збагачена після центрифугування в градієнті сахарози однотипними хромосомами, потім сортується методом проточної цитометрії, що значно підвищує ефективність цього прийому сортування.
У каріотипі більшість хромосом незначно розрізняються за кількістю ДНК, а використовувані для проточного цитометричного сортування стандартні прилади не можуть ідентифікувати хромосоми, що розрізняються за вмістом ДНК менш ніж на 3-5 %. У зв’язку з цим можна виділити не індивідуальні хромосоми, а їхні основні групи. Так, каріотип людини цим шляхом розділяється на хромосомні групи А, B, C, D, E, F, і G. Збільшення можливості методу проточної цитометрії до 1 % рівня розходжень, що виявляються у хромосомах у вмісті ДНК, дозволяє при аналізі 24 хромосом людини одержати вже не 7, а 18 окремих піків.
Донорські хромосоми проникають у реципієнтні клітини завдяки фагоцитозу. Є дані, які свідчать про те, що метафазні хромосоми потрапляють у ядро реципієнтних клітин у недеградованому стані і що ці хромосоми в геномі реципієнтної клітини можуть зберігатися тривалий час і мають здатність до автономної реплікації. Однак у лізосомах цитоплазми реципієнтних клітин значна частина донорського хромосомного матеріалу деградує на стадії проникнення.
Результати біохімічного і цитогенетичного аналізів тран- сформантів дозволяють говорити про два види трансформованого фенотипу. У випадку стабільного фенотипу перенесена ознака при рості трансформантів на неселективному середовищі
зберігається протягом декількох тижнів чи місяців; нестабільний фенотип при вирощуванні трансформованих клітин на не- селективному середовищі втрачається. В останньому випадку незважаючи на те, що перенесений у рецепієнтну клітину генетичний матеріал метафазних хромосом знаходиться у ядрі і ек- спресується, фізичний зв’язок його з ядром відсутній. Крім того, нестабільний фенотип у популяції трансформованих клітин губиться зі швидкістю 0,1-10 % і більше за клітинний поділ, що також свідчить про незавершеність процесу трансформації.
При більш-менш тривалому культивуванні клітини з нестабільним трансформованим фенотипом поступово переходять у стабільні трансформанти. Дані про можливість переходу сформованого стабільного фенотипу в нестабільний у літературі не наводяться. Що стосується процесу формування стабільного трансформованого фенотипу, то є підстави говорити про включення донорського генетичного матеріалу в хромосоми реципі- єнтних клітин з одночасним зменшенням обсягу перенесеного в реципієнтні клітини генетичного матеріалу (обсяг цього матеріалу коливається від 1 % (макротрансгеном) до 0,07-0,8 % (мік- ротрансгеном) і залежить від багатьох факторів).
Один із провідних спеціалістів щодо перенесення генів за допомогою метафазних хромосом Сєров О.Л. (1985) вважає, що вивчення таких питань, як механізм включення донорського генетичного матеріалу в геном реципієнтної клітини і механізм клітинної компетенції до трансформації, дозволить за допомогою спрямованого введення генетичного матеріалу здійснювати значні зміни фенотипу реципієнтних клітин.