Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Форма, компактность и динамика молекулы белка
Геометрическая форма глобулярных белков в первом приближении может быть аппроксимирована эллипсоидом вращения, у которого отношение полуосей, как правило, не превышает 2:1. В то же время поверхность глобулярных белков никак нельзя считать гладкой: она как бы изрыта, содержит впадины, а иногда весьма глубокие щели. Такая изрытость существенна для функционирования белка. Например, сорбция субстрата в достаточно хорошо сформированной щели в глобуле фермента переводит реакцию с его участием в совершенно новую среду. Как следствие субстрат изолируется от воды, дегидратируются его функциональные группы, процесс протекает в среде с диэлектрической постоянной около 4-5, тогда как диэлектрическая постоянная воды составляет 80.
Внутреннее гидрофобное ядро белков нередко описывали как «жирную каплю», уподобляя ее структуру гидрофобному ядру мицеллы мыла или другого поверхностно-активного вещества. Хотя такое сравнение неплохо отражает физическую сущность сил, диктующих погружение гидрофобных элементов белка внутрь его глобулы, оно неточно. Боковые цепи гидрофобных аминокислот, образующие внутреннее ядро, не свободны, а достаточно плотно упакованы, приближаясь скорее к кристаллу, чем к жидкой капле. Это особенно справедливо для ядра, но свойственно и пространственной структуре белка в целом.
Анализ белковых кристаллов показывает, что плотность упаковки атомов в белковой глобуле, т.е. отношение суммы ван-дер-ваальсовых объемов аминокислотных остатков к объему глобулы, лежит в пределах 0,72-0,77, что вполне сравнимо с типичным диапазоном плотности упаковки в кристаллах органических соединений 0,68-0,80 и выше интервала 0,60—0,65, характерного для органических жидкостей.
Все же и представление о белковой глобуле как о квазикристаллическом образовании также не вполне точно, поскольку для пространственной структуры белка, включая и плотноупакованные ее участки, характерна определенная динамике Система водородных и других нековалентных связей в белке допускает локальные флуктуации, например частичное и обратимое «расстегивание» а-спиралей или ß-структур. Очевидно, этим объясняется и большая подвижность аминокислотных остатков, расположенных на концах упорядоченных элементов вторичной структуры, по сравнению с «внутренними» остатками, перемещение которых потребовало бы серьезных нарушений кооперативной системы нековалентных взаимодействий. В сочетании с наличием небольших пустот все это позволяет молекулам малого размера, например воде, перемещаться внутри пространственной структуры, несмотря на отмеченную плотность ее упаковки. Это делает возможным, в частности, обмен атомов водорода скрытых внутри глобулы «внутренних» пептидных связей с окружающей белок водой. Известны и функционально важные миграции молекул внутри белка.
Понятно, что аминокислотные остатки, расположенные на поверхности белка, еще более динамичны. Это особенно справедливо для длинных и, как правило, хорошо гидратированных боковых цепей лизина. Они нередко оказываются «невидимыми» при рентгеноструктурном анализе, так как образующие их метиленовые группы по мере удаления от а-углеродного атома описывают окружности все большего радиуса. Вследствие этого их электронная плотность оказывается как бы «размазанной», распределенной в довольно большом объеме. При рентгеноструктурном анализе миоглобина боковая цепь остатка Lys-98, направленная в раствор, прослеживается только до ß-углеродного атома, тогда как в Lys-77, аминогруппа которого фиксирована солевой связью с остатком Glu-18, отчетливо выявляются все атомы углерода и азота. Нередко значительной подвижностью (до 10 А) обладают петли нерегулярной структуры на поверхности белка. В целом поверхностный слой белка характеризуется значительно большей подвижностью, чем внутреннее ядро.
В то же время многие элементы структуры белков, содержащие компоненты каталитического центра или иные функционально важные остатки, нередко оказываются менее подвижными, чем наружные петли. Этим, видимо, обеспечивается точность их взаимодействия с субстратами и другими лигандами, что, конечно, не отрицает возможности перемещений с небольшой амплитудой (рис. 6.3).
Разумеется, известны и гораздо более значительные изменения пространственной структуры белка, индуцируемые теми или иными факторами конформационные перестройки, которым принадлежит немалая роль в функционировании белковых молекул. Однако следует учитывать и описанную выше «микроскопическую» динамику пространственной структуры белка. Так, проникновение молекулы кислорода к месту его связывания гемом в миоглобине не могло бы произойти за разумные времена, поскольку доступ к этой точке белка закрыт боковыми цепями аминокислот. Лишь их флуктуации позволяют кислороду проникать внутрь миоглобина и выходить наружу, видимо, за счет механизма, близкого к диффузионному (см. гл. 8). Более того, атомные флуктуации могут выполнять роль своего рода «смазки» при перемещениях крупных участков структуры, препятствуя их «залипанню», а также помогать «причаливанию», взаимной подгонке поверхностей белковых глобул при образовании ими четвертичной структуры, формировании комплексов ферментов с субстратами и ингибиторами.
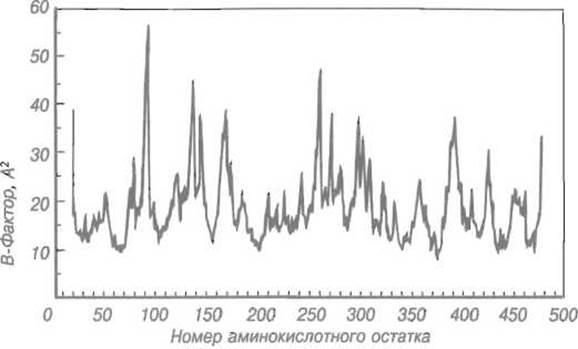
Рис. 6.3. Динамика пептидного скелета в глутатионредуктазе.
В-фактор характеризует (в первом приближении) подвижность аминокислотных остатков (их номера нанесены на оси абсцисс). Первые 17 аминокислот вообще не фиксированы. Пики соответствуют участкам с высокой подвижностью, минимумы — остаткам, вовлеченным в каталитический механизм и потому менее подвижным, в частности Glu-47, Cys-58, Cys-63, Lys-66, Tyr-197, Glu-201, Val-370, His-467
В табл. 6.3 обобщены данные о динамике, свойственной молекуле белка.
Заметим, что источником первых двух типов движений могут быть тепловые колебания, тогда как движения третьего типа — крупные перестройки, — как правило, происходят за счет энергии взаимодействия белка с теми или иными лигандами. Необходимо подчеркнуть, что динамика структуры белка не только отражает физические особенности его организации, но и играет большую роль в его функционировании.
Для изучения динамических возможностей, заложенных в молекулах белка и их отдельных участках, прибегают к методу молекулярно-динамического моделирования. Используя распределение атомов в пространстве, полученное методом рентгеноструктурного анализа, приписывают атомам небольшие значения скоростей, распределенные случайным образом, и рассчитывают положение атомов и скорости, которые они приобретут через очень короткий интервал времени — порядка 10-15 с. При этом учитывают взаимодействия каждого атома с его соседями, используя мощные ЭВМ. Далее переходят к следующему интервалу времени и т.д. Затем изменяют набор скоростей, как бы переходя к более высокой температуре, тогда как начальное распределение скоростей выбиралось близким тому, которое отвечало бы абсолютному нулю. Постепенное приближение к распределению скоростей, свойственному температуре его реального функционирования, позволяет судить о динамических возможностях структуры в целом и его отдельных фрагментов за времена порядка 10-10 с.
Таблица 6.3 Основные типы движений в белковой молекуле
|
Тип движения |
Амплитуда, Ä |
Время, с |
|
Атомные флуктуации (несогласованные перемещения отдельных атомов, например повороты на 20—60° вокруг простых связей пептидного скелета и боковых групп) |
0,01-1 |
10-15-10-11 |
|
Коллективные (согласованные) перемещения групп атомов (от нескольких до сотен) |
0,01-5 |
10-12-10-3 |
|
Индуцированные внешними факторами (например, связыванием субстрата) изменения конформации |
0,5-10 |
10-9-10-3 |