Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Глобины
Миоглобин
Миоглобин и субъединицы гемоглобина имеют очень близкую третичную структуру, их пептидные цепи свернуты в пространстве сходным образом. Вполне определенное, хотя и заметно меньшее сходство обнаруживают и их первичные структуры. В то же время миоглобин лишен четвертичной структуры и его функция ограничивается только хранением кислорода. Таким образом, миоглобин — более простой белок, более древний, чем гемоглобин.
Пептидная цепь миоглобина млекопитающих состоит из 153 аминокислотных остатков. Сравнение первичных структур миоглобинов 24 видов животных показывает, что 82 положения во всех этих белках занимают одни и те же аминокислоты. Следовательно, примерно половина остатков в указанной выборке миоглобинов неизменна, инвариантна, другие же остатки могут заменяться, что, однако, практически не отражается на укладке полипептидной цепи, ее третичной структуре. Впрочем, многие из замен не изменяют существенным образом химической природы данного остатка — гидрофильные аминокислоты заменяются гидрофильными, гидрофобные — гидрофобными, т.е. наблюдаются по преимуществу так называемые консервативные замены.
Миоглобин, как и другие глобины, — четко выраженный а-спиральный белок (рис. 8.1) Его пространственная структура образована восемью а спиралями, последовательно обозначаемыми буквами от А до Н (от аминного к карбоксильному концу цепи). В а-спиралях содержится 75% вс аминокислотных остатков, остальные приходятся на повороты и неупорядоченные концевые остатки пептидной цепи. Неспиральные участки обозначают двумя буквами, соответствующими спиралям, между которыми расположен поворот, или спирали и аминному (N) либо карбоксильному (С) концу пептидной цепи. Например, НС соответствует участку между последней спиралью Н и С-концевой аминокислотой. Для аминокислотных остатков миоглобина принято указывать буквенное обозначение а-спирали, в которой данный остаток находится, и его порядковый номер в ней.
Около 30 аминокислотных остатков, точнее, их боковые цепи образуют внутреннее гидрофобное ядро миоглобина, стабилизирующее его пространственную структуру. Ядро, в котором можно выделить три сегмента, или «кластера», содержит остатки валина, лейцина, изолейцина, фенилаланина и аланина. Упаковка боковых цепей этих аминокислот в кластерах достаточно плотна и в то же время допускает определенную свободу их движения относительно друг друга. В одном из кластеров есть впадина, достаточная, например, для размещения атома ксенона. Кластеры объединяет в гидрофобное ядро планарная молекула гема, как бы вставленная внутрь структуры миоглобина. При этом с водой контактирует только ребро молекулы гема, погруженной в белок, как в своего рода корзинку, образованную двумя а-спиралями (Е и Е) и выстланную гидрофобными боковыми цепями аминокислот. Гем не имеет ковалентных связей с белком, удерживаясь нековатентными взаимодействиями. Всего насчитывается 80 межатомных контактов между белком и гемом, что обеспечивает достаточно прочное удерживание последнего.
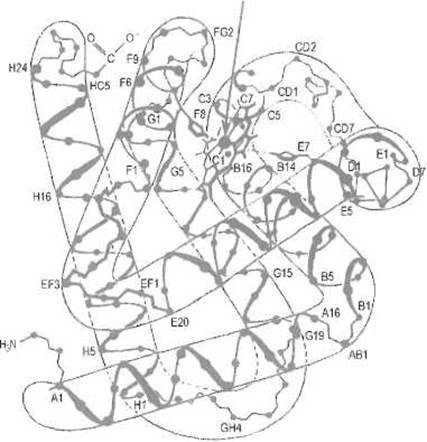
Рис. 8.1. Пространственная структура миоглобина. Показаны только Са -атомы. Между спиралями Е и F расположен гем (указан стрелкой). Близкую структуру имеют субъединицы гемоглобина
С обеих сторон плоскости гема, «над» и «под» атомом железа, располагаются имидазольные кольца двух остатков гистидина (рис. 8.2). Один из них, занимающий восьмое положение в а-спирали F (His F8) и наиболее приближенный к атому железа, называют проксимальным. Атом азота его имидазольного кольца находится в контакте с атомом железа, так что можно думать об образовании между ними ковалентной связи. Другой остаток гистидина, занимающий седьмое положение в а-спирали Е (Flis Е7), называют дистальным, так как он относительно удален от атома железа. Между последним и имидазольной группой этого остатка есть свободное пространство, в котором и размещается связываемая миоглобином молекула кислорода, причем один из ее атомов непосредственно подходит к железу, другой — к имидазолу His Е7. Замена дистального гистидина глицином ухудшает связывание кислорода в 1000 раз.
В миоглобине некоторых моллюсков положение Е7 занято не гистидином, а валином, что также приводит к значительному понижению сродства к кислороду. Очевидно, что водородная связь, образуемая имидазольной группой дистального гистидина с кислородом, способствует связыванию последнего. Таким образом, вокруг двухвалентного железа гема пять координационных мест заняты атомами азота (четыре из них принадлежат порфирину, пятый — His F8), одно — кислородом.
Пространство, в котором связывается молекула кислорода, не имеет, однако, постоянного выхода в окружающую миоглобин воду. Предполагают, что боковые группы остатка His Е7 и соседнего с ним Arg CD3 могут занимать несколько разных положений, образуя своего рода «дверцу». Ее открытие позволяет молекуле кислорода подойти к гему.
Неясно, «дожидается» ли кислород случайного открывания «дверцы» в результате тепловых колебаний или как-то его индуцирует. Очевидно, что динамика молекулы миоглобина играет существенную роль в его функции.
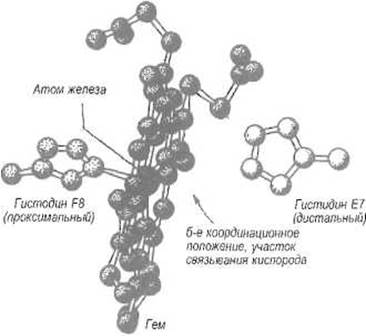
Рис. 8.2. Зона присоединения кислорода в миоглобине и субъединицах гемоглобинов.
Находящийся в центре порфирина атом железа (Fe2+) связан с атомом азота имидазольного кольца проксимального гистидина F8. Молекула кислорода располагается при связывании между группой N-H имидазольного кольца дистального гистидина Е7 и атомом железа под углом к плоскости гема
Напомним, что в нормальных условиях в миоглобине и других глобинах при присоединении кислорода окисление железа не наблюдается. Судя по модельным опытам, это как-то связано с погружением комплекса гем-кислород в гидрофобную среду, каковой является окружение гема в глобинах. Если все же окисление происходит и железо переходит в трехвалентное состояние, то образуется так называемый ферримиоглобин, уже не способный функционировать. Место связывания кислорода в нем занято водой. Заметим, что ту же впадину между атомом железа и дистальным гистидином могут занимать и другие молекулы. Например, СО связывается с гемом примерно в 200 раз прочнее кислорода, лишая глобин возможности функционировать.
Кислород легко связывается миоглобином — полное насыщение белка достигается уже при парциальном давлении около 10 мм рт.ст., а 50%-е — при 1 мм рт.ст 1 (рис. 8.3). Таким образом, миоглобин хорошо приспособлен к хранению кислорода в мышцах, насыщаясь уже при весьма низких парциальных давлениях, характерных для тканей. Однако он не мог бы обеспечить транспортную функцию, так как, насытившись кислородом в легких, с трудом отдавал бы его в капиллярах. Эту задачу решает родственный миоглобину, но построенный более сложно белок гемоглобин.
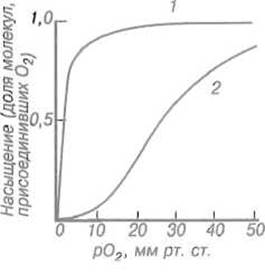
Рис. 8.3. Кривые зависимости степени насыщения кислородом миоглобина (1) и гемоглобина (2) в зависимости от парциального давления кислорода