Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Глобины
Гемоглобин
Все гемоглобины млекопитающих имеют четвертичную структуру и состоят из четырех субъединиц. Практически всегда это две пары одинаковых субъединиц, так что гемоглобины стехиометрически могут быть представлены формулами вида a2ß2, а2у2, а2ß2 и т.д. Пептидные цепи, соответствующие субъединицам гемоглобинов, обнаруживают сходство первичных структур, являются гомологичными. Так, при сравнении первичных структур а- и ß-цепей гемоглобина А человека, которые состоят соответственно из 141 и 147 аминокислот, совпадает около половины остатков. Гомология выявляется и при сравнении последовательностей гемоглобинов и миоглобинов, хотя она менее выражена.
В то же время третичная структура и способ укладывания полипептидных цепей в пространстве у миоглобинов и субъединиц гемоглобинов весьма близки, что отражает их эволюционное родство, происхождение от одного предшественника. Таким образом, субъединицы гемоглобина построены почти так же, как описанная выше молекула миоглобина: а-субъединица образована семью, ß — восемью а-спиралями. Присоединение молекулы кислорода к субъединицам гемоглобина, каждая из которых содержит гем, в первом приближении протекает так же, как и при насыщении миоглобина.
11 мм рт.ст. = 1,3 гПа.
Главное различие функциональных свойств миоглобина и гемоглобина состоит в том, что четвертичная структура сообщает молекуле гемоглобина способность регулировать присоединение и отщепление кислорода, придает ей кооперативные свойства, которых лишен миоглобин. С учетом этого дальнейшее рассмотрение свойств гемоглобина будет посвящено анализу четвертичной структуры этого белка и ее функциональной роли.
8.2.1. Четвертичная структура гемоглобина
В четвертичной структуре гемоглобина субъединицы образуют тетраэдр, стабилизированный межсубъединичными контактами — системой нековалентных связей. Эти контакты, на которые приходится в общей сложности примерно 1/5 всей поверхности четырех субъединиц, весьма различны по числу нековалентных взаимодействий и, следовательно, по прочности (рис. 8.4). Наиболее развит и наиболее устойчив контакт между а-субъединицей и одной из ß-субъединиц — так называемый контакт а1—ß1. В его образовании участвует 34 аминокислотных остатка, 110 атомов сближены в нем на расстояние, меньшее 4 А. Если принять общую площадь межсубьединичных контактов за 100%, то на контакт а1—ß1 и идентичный ему а2—ß2 придется 60%, что отвечает весьма сложной сети по преимуществу гидрофобных взаимодействий и нескольких водородных связей. Контакт той же al-субъединицы с другой ß1-субъединицей, так называемый контакт a1—ß2, выглядит иначе, так как его образуют другие участки поверхности глобул. В его формировании участвует 19 остатков аминокислот, образующих гидрофобные контакты и водородные связи. На его долю (вместе с таким же контактом a2—ß1) приходится 33% общей поверхности межсубъединичных контактов. Как следствие, он значительно слабее контакта a1—ß1.
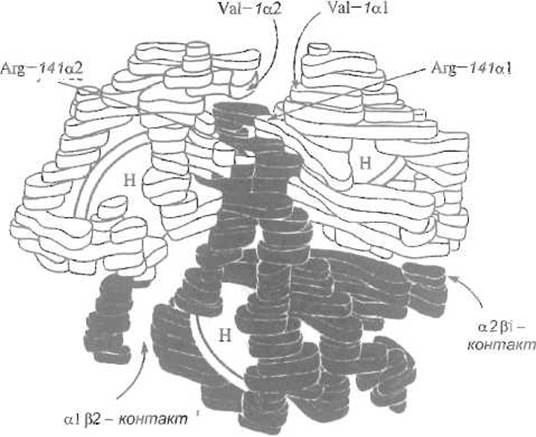
Рис. 8.4. Модель четвертичной структуры гемоглобина.
Диски, помеченные буквой Н, — гемы. Видны контакты a1ß2 и a2ß1. Показано, что слабый контакт a1a2 зависит от взаимодействия N-концевых остатков валина и С концевых — аргинина
Еще слабее контакты между одноименными субъединицами a1 - a2 и ß1 - ß2, которые представлены немногими, преимущественно ионными, взаимодействиями. На них приходится около 7% общей поверхности контактов, стабилизирующих четвертичную структуру. Таким образом, два контакта, т е. a1 - ß1 и a2 - ß2, доминируют в структуре молекулы гемоглобина. В определенных условиях, например в 2 М NaCl, гемоглобин диссоциирует на димеры a-ß, сохраняющиеся благодаря прочному контакту a1-ß1. Практически четвертичная структура гемоглобина как бы образована двумя относительно жестко связанными димерами a - ß, которые удерживаются вместе более слабыми взаимодействиями (димер димеров).
В определенных условиях взаиморасположение димеров может изменяться за счет изменения характера менее прочных контактов a1-ß2 и особенно a1-a2 и ß1-ß2. Не следует думать, что слабые контакты между субъединицами, не слишком значимые для поддержания целостности молекулы, не валены функционально. Наоборот, именно сочетание слабых и сильных взаимодействий обусловливает кооперативностъ четвертичной структуры гемоглобина, что, по-видимому, характерно и для многих других белков, обладающих этим уровнем организации.
Как показал рентгеноструктурный анализ, четвертичная структура молекулы гемоглобина может находиться в одном из двух состоянии, отличающихся поворотом димеров a-ß относительно друг друга (рис 8.5). Одно из них устойчиво, если субъединицы насыщены кислородом и молекула гемоглобина содержит четыре молекулы кислорода, — оксигемоглобин. Другое стабильно, если субъединицы кислорода не содержат, — дезоксигемоглобин. Промежуточные формы неустойчивы, их содержание в любой момент времени невелико. Существованию двух взаимопревращающихся форм четвертичной структуры гемоглобин и обязан кооперативностью связывания и отщепления кислорода, а также рядом других функционально важных свойств.
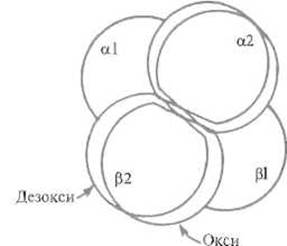
Рис. 8.5. Поворот и смещение aß-димеров в чет вертичной структуре гемоглобина относительно друг друга при переходе белка из дезокси- в оксиформу.
Поворот составляет примерно 15°, смещение — 0,8 Å. Димеры фиксируются в новой позиции за счет изменений контакта a1 ß2 (см. рис. 8.9)
8.2.2. Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
Принято следующее, весьма огрубленное, описание цепи событий, сопровождающих присоединение молекулы кислорода к какой-либо из субъединиц гемоглобина.
Молекула кислорода проникает внутрь субъединицы и размещается между атомом железа гема и имидазольной группой дистального гистидина, которая, видимо, образует с одним из атомов кислорода водородную связь. Присоединение кислорода изменяет электронное состояние атома железа, который до этого находился как бы «над» плоскостью гема, а теперь смещается на 0,4-0,8 Å, приближаясь к кислороду и втягиваясь в плоскость порфиринового кольца (рис. 8.6). Это движение приводит к соответственному смещению имидазола проксимального гистидина, образующего с железом связь, близкую к ковалентной. Смещение имидазола вызывает далее смещение всего остатка гистидина His F8 и всей а-спирали F, в которой этот остаток расположен. Понятно, что изменение структуры, начатое небольшим перемещением атома железа, охватывает немало атомов белка.
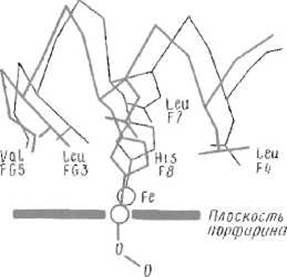
Рис. 8.6. Изменения конформации вблизи гема, сопровождающие присоединение кислорода к атому железа и переход субъединицы гемоглобина из дезокси- в оксиформу.
Атом железа втягивается в плоскость порфиринового кольца, что вызывает смещение связанного с ним остатка гистидина F8, за которым следует движение всей спирали F и поворот FG
Важным последствием такого структурного перехода является то, что боковая р-оксибензильная группа остатка тирозина Tyr НС2, располагавшаяся в дезоксигемоглобине между спиралями F и Н, из-за их сближения вынуждена покинуть это место в структуре и выйти на поверхность молекулы (рис. 8.7). Заметим, что остаток Туг НС2 предшествует С-концевому Arg НСЗ.
Резкое изменение позиции соседнего тирозина влечет за собой и изменение в расположении этого остатка аргинина, а значит, сразу двух заряженных групп: а-карбоксилат- иона и гуанидиниевой группировки, — которыми он обладает. До присоединения кислорода заряженные функциональные группы С-концевого остатка Arg НСЗ одной из а-испей (od-цепи) участвовали в образовании двух солевых связей. Карбоксилат-ион взаимодействовал с протонированной а-аминогруппой N-концевого остатка другой a-цепи (а2), обслуживая a1 - а2-контакт. Катионная гуанидогруппа образовывала соль с карбоксилат-ионом Asp-126 в той же цепи a1. После присоединения кислорода С-концевой аргинин утрачивает обе эти связи и приобретает способность практически свободно вращаться. То же происходит и с С концевым аргинином цепи a2, так что в оксигемоглобине контакт между одноименными субъединицами a1 - a2, и без того слабый, становится малосущественным.
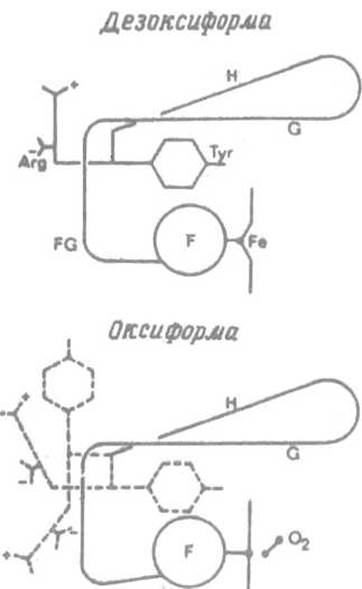
Рис. 8.7. Передача эффекта смещения спирали F на С-концевой аргинин. Боковая цепь тирозина Туг HC2 из-за сближения спиралей F и G оказывается «вытолкнутой» из пространства между ними, что приводит в движение С-концевой остаток аргинина (показано пунктиром). Это влечет за собой разрыв солевых мостиков, в которых участвуют концевые остатки аминокислот
Аналогично в результате присоединения молекулы кислорода к гему ß-субъединицы (ß2) происходит конформационная перестройка, начинающаяся со сближения дистального гистидина с железом гема. Ее итогом оказывается разрыв солевых связей C-концевого остатка His-146. Одна из них — между карбоксилат-ионом С-концевого гистидина и протонированной аминогруппой лизина Lys-40 цепи а1, другая — между имидазолий-катионом His-146 и карбоксилатом Asp-94 в той же цепи ß2. Это влечет за собой ослабление контакта a1 - ß2 (рис. 8.8)
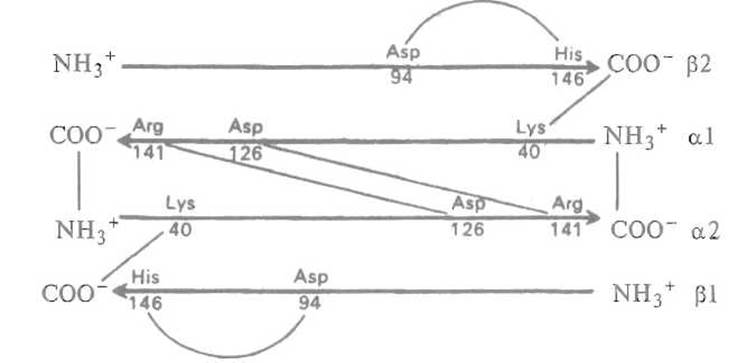
Рис. 8.8. Схема электростатических взаимодействий (показаны тонкими линиями) в молекуле гемоглобина.
Субъединицы условно изображены стрелками, направленными к С-концам. При присоединении кислорода (оксигенировании) эти связи утрачиваются
8.2.3. Функциональная роль четвертичной структуры гемоглобина
В общей сложности при переходе от дезоксигемоглобина к полностью оксигенированной, насыщенной кислородом молекуле утрачивается восемь ионных связей как внутри субъединиц, так и между ними, причем затрагиваются относительно слабые контакты a1 - a2 и ß1 - ß2. Ослабление последних приводит к релаксации молекулы гемоглобина и дает возможность ее половинам — a-ß-димерам — изменить свою ориентацию относительно друг друга. Это смещение достигает 7 А (см рис. 8.6): при этом наиболее прочный контакт a1 — ß1 практически не затрагивается.
Перемещение димеров a-ß происходит как бы скачком, так как существует два способа организации нековалентных взаимодействий на контакте a1-ß2. Его поверхность можно огрубленно представить в виде «ласточкина хвоста» (рис. 8.9), причем в одной (дезокси-, или Т) форме относительное расположение субъединиц стабилизируется, в частности, водородной связью между ТуrС7 a1-субъединицы и карбоксилом AspGl субъединицы ß2. При переходе в окси(R)-форму эта связь утрачивается, зато карбоксильная группа AspGl a1-субъединицы, оказавшись в стерически благоприятном положении после перемещения димеров относительно друг друга, дает водородную связь с AsnG4 субъединицы ß2. Таким образом, контакт a1-ß2 работает как своеобразный переключатель, способный принимать одно из двух состояний в зависимости от того, присоединился или нет кислород к соответствующим субъединицам.
Итак, присоединение молекулы кислорода к субъединице гемоглобина вызывает целую последовательность структурных изменений, распространяющихся от гема к периферии глобулы и смещающих ионизованные группы на ее поверхности. Речь идет о типичном для третичной структуры белка явлении — передаче эффекта на значительные расстояния. Если бы такой эффект оставался только в рамках третичной структуры, его вклад был бы не столь значительным. Однако в гемоглобине он приводит к изменению ионных взаимодействий в слабом контакте между субъединицами, изменяя его и способствуя кооперативному переходу четвертичной структуры в иное состояние.
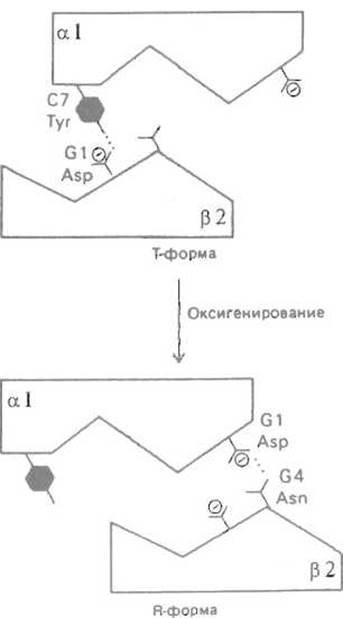
Рис. 8.9. Переход а1ß2-контакта при оксигенировании гемоглобина. Контакт, имеющий форму «ласточкина хвоста», при оксигенировании и переходе молекулы из Т- в R-состояние может также находиться в одном из двух состояний. Утрата водородной связи Tyr С7—Asp Gl между a1- и ß2-субъединицами компенсируется установлением связи между Asp Gl и Asn G4
Следовательно, изменения, происшедшие в одной из субъединиц при присоединении кислорода, могут быть переданы на остальные субъединицы, которым будет выгодно изменить конформацию так, чтобы их третичная структура соответствовала перестроившейся четвертичной, а значит, стала бы благоприятной для присоединения молекул кислорода. Понятно, что такая перестройка четвертичной структуры, ее переход из свойственной дезоксигемоглобину Т-формы (от англ. tight — стянутый) в характерную для оксигемоглобина релаксированную R-форму (от англ. relaxed) мало вероятны (хотя в какой-то мере и возможны), если молекула кислорода присоединилась только к одной из четырех субъединиц. Более того, необходимость описанных изменений третичной структуры, противоречащих структуре гемоглобина, препятствует присоединению первой молекулы кислорода и благоприятствует ее отщеплению.
Следовательно, присоединение первой и в меньшей мере второй молекулы кислорода будет протекать с трудом. Для него потребуется заметно большее парциальное давление кислорода, чем для насыщения миоглобина, где таких задержек нет Действительно, этот процесс — начало насыщения гемоглобина кислородом — происходит в альвеолах легких, где парциальное давление кислорода велико.
Очень важно, что после присоединения двух молекул кислорода к гемоглобину четвертичная структура с примерно равной вероятностью может оказаться как в Т-, так и в R-форме. Последняя способствует присоединению третьей молекулы кислорода, после которого вероятность перехода всей структуры, в том числе и четвертой субъединицы, пока не «заряженной» кислородом, в структуру, облегчающую присоединение к ней кислорода, становится весьма высокой. Это ведет к быстрому завершению процесса насыщения всей тетрамерной молекулы кислородом, Таким образом, присоединение кислорода к гемоглобину, будучи кооперативным процессом, как бы следует принципу «отдай имеющему», что обеспечивает полноту «нагрузки» молекул-переносчиков кислородом в легких.
В тканях первая молекула кислорода отщепляется с определенными затруднениями, так как это требует изменений в контакте субъединиц, противоречащих свойственной оксигемоглобину четвертичной структуре. Однако эти затруднения преодолеваются благодаря низкому парциальному давлению кислорода, которое делает обратную реакцию маловероятной. Отщепление последующих молекул кислорода облегчается с каждым шагом, что приводит к полной «разгрузке» транспортной молекулы. Так, кооперативность обеспечивает эффективный перенос кислорода от легких к тканям. Как полагают физиологи, в отсутствие кооперативных эффектов, например если бы эритроциты содержали миоглобин вместо гемоглобина, животные погибали бы от кислородной недостаточности в тканях.
8.2.4. 2,3-Дифосфоглицерат — эффектор, регулирующий функцию гемоглобина
Очевидно, что кооперативность присоединения и отщепления кислорода гемоглобином зависит от того, насколько легок или, наоборот, труден координированный переход четвертичной структуры из Т- в R-состояние. Оказалось, что 2,3-дифосфоглицерат, содержащийся в эритроцитах, способен избирательно взаимодействовать с дезоксигемоглобином, стабилизируя его четвертичную структуру (Т-форму). 2,3-Дифосфоглицерат несет пять отрицательных зарядов, которые могут быть распределены между восемью атомами кислорода. Его молекула связывается во впадине, образованной обеими ß-субъединицами, где она взаимодействует сразу с семью катионными группами этих цепей. Это а-аминогруппы N-концевых Val-1, имидазольные кольца His-2 и His-143 обеих ß-субъединиц, а также аминогруппа остатка Lys-82 какой-либо одной из них (рис. 8.10)
Стабилизация дезоксиформы понижает сродство к кислороду гемоглобина, образовавшего комплекс с 2,3-дифосфоглицератом. В отсутствие эффектора — 2,3-дифосфоглицерата — гемоглобин А взрослого человека насыщается кислородом на 50% при 12 мм рт.ст., в присутствии же дифосфоглицерата для 50%-го насыщения гемоглобина кислородом необходимо уже его парциальное давление, равное 50 мм рт.ст. 2,3-Дифосфоглицерат — соединение, структурно ничего общего не имеющее с кислородом и связывающееся участком гемоглобина, далеким от места присоединения кислорода. Тем не менее оно существенно влияет на взаимодействие кислорода и гемоглобина. Обладающие такой способностью соединения, которым принадлежит большая роль в регулировании функции белков в организме, получили название аллостерических (структурно далеких) эффекторов. Важно отметить, что сама возможность такого воздействия эффектора на структурно удаленный функциональный центр белка основана на способности четвертичной структуры отвечать на относительно слабые воздействия.
Изменения зоны связывания 2,3-дифосфоглицерата способны значительно влиять на сродство гемоглобина к кислороду. Так, в ß-цепях гемоглобина южноамериканской ламы, живущей на больших высотах и нуждающейся в адаптации к пониженному парциальному давлению кислорода, остатки His-2 заменены остатками аспарагина, которые не несут катионной группы и не могут участвовать в связывании 2,3-дифосфоглицерата. Как следствие дезоксиформа гемоглобина ламы оказывается менее стабилизированной и сродство к кислороду повышается. 50%-ое насыщение гемоглобина ламы наступает уже при парциальном давлении кислорода, равном 24 мм рт.ст. Функциональный смысл такой замены вполне очевиден, тем более что у одногорбого верблюда (эволюционного предка ламы), живущего на равнине, место связывания 2,3-дифосфоглицерата представлено семью катионными группами, включая и остатки His-2 ß-цепей.
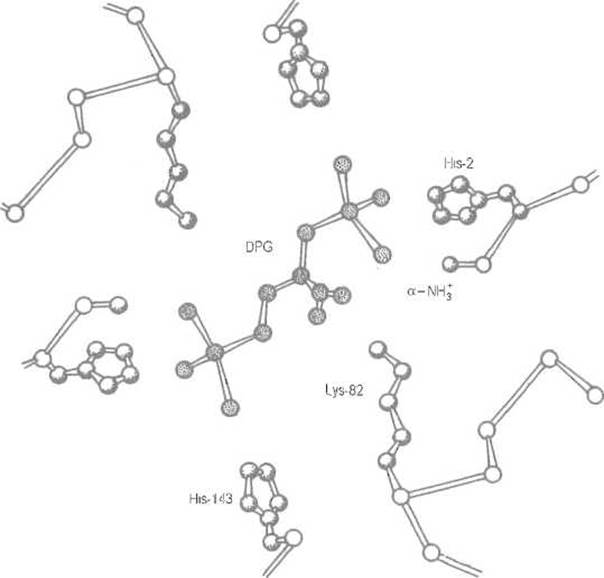
Рис. 8.10. Связывание дифосфоглицерата (DPG) с катионными группами ß-субъединид гемоглобина.
Электростатические взаимодействия анионных групп 2,3-дифосфоглицерата с катионными группами дезоксигемоглобина (заштрихованы) существенно усиливают контакт между субъединицами, прежде всего очень слабый ß1ß2-контакт. Стабилизация дезоксиформы эквивалентна понижению сродства к кислороду. Сродство может быть повышено у гемоглобинов, способных связывать кислород при низком парциальном давлении, за счет ослабления взаимодействия с эффектором. Так, в гемоглобине ламы связывание ослаблено заменой His-2 на Asn-2, в гемоглобине F (плода) — заменой His-143 на Ser-143, что уменьшает число катионных групп белка, взаимодействующих с анионными группировками эффектора
Гемоглобин F плода человека (фетальный) синтезируется только во время беременности и должен обеспечивать перенос кислорода от плаценты, где его парциальное давление составляет всего около 12 мм рт.ст., к тканям плода (по выражению физиологов, «плод дышит на высоте Эвереста»). Понятно, что гемоглобин F должен обладать большим сродством к кислороду, чем гемоглобин взрослого человека. Это также достигается за счет замены His-143 в ß-цепи гемоглобина F на серин, что ослабляет связывание 2,3-дифосфоглицерата и уменьшает стабилизацию дезоксиформы гемоглобина.
8.2.5. Участие гемоглобина в транспорте СО2 и ионов водорода
Кооперативные эффекты четвертичной структуры определяют способность гемоглобина выполнять помимо переноса кислорода ряд других транспортных функций, важных для физиологии кровообращения.
Гемоглобин переносит ионы водорода и СО2, направляющиеся в тканях к легким. Перенос ионов водорода обусловлен так называемым эффектом Бора. Как уже говорилось, при насыщении гемоглобина кислородом рвутся, а при его отщеплении восстанавливаются ионные связи между отдельными функциональными группами. Разрыв или, наоборот, образование ионных связей сказывается на способности функциональных групп связывать протон. Это особенно характерно для сравнительно слабых оснований, рКа которых близок к физиологическому значению pH. В таком случае уже небольшие изменения рКа существенно влияют на способность группы присоединять и, значит, переносить протон. Такими группами являются а-аминогруппа и имидазольная группа гистидина. Так, в оксигемоглобине имидазольная группа С-коицевого His-143 ß-цепей свободна и имеет, по-видимому, нормальный рКа для гистидина, близкий 6. После отщепления кислорода в тканях эта имидазольная группа восстанавливает ионную связь с карбоксилат-анионом остатка Asp-94 той же цепи, т.е. оказывается в поле отрицательного заряда. Понятно, что протон с большим трудом может покинуть имидазолий-катион, если положительный заряд последнего компенсирован сближенной с ним отрицательно заряженной группой.
Таким образом, способность имидазольного кольца С-концевого гистидина к связыванию протона регулируется положением этого кольца в пространственной структуре, его участием или неучастием в ансамбле с карбоксильной группой. Как следствие дезоксигемоглобин, в котором основность имидазольной группы His-143 возрастает, присоединяет протон и переносит его от тканей к легким, где при насыщении гемоглобина кислородом и переходе его четвертичной структуры в релаксированную R-форму ион водорода отщепляется.
Перенос СО2гемоглобином обусловлен его способностью присоединяться к а-аминогруппам белка с образованием так называемой карбаминовой кислоты — полуамида угольной кислоты:

Эта реакция протекает в тканях с аминогруппами дезоксигемолобина. Появившиеся отрицательно заряженные остатки карбаминовой кислоты вступают в ионные взаимодействия с катионными группами белка, дополнительно стабилизируя дезоксиформу. В легких при насыщении гемоглобина кислородом протекает обратная реакция, которая ведет к выделению СО2.
8.2.6. Аномальные гемоглобины
В популяции человека господствует нормальный гемоглобин А, однако с частотой примерно 1/1000 встречаются аномальные гемоглобины — мутантные белки, в которых произошла одиночная за мена аминокислотного остатка другим. Такие замены могут происходить во многих положениях — известно около 200 аномальных гемоглобинов, тогда как а- и ß-цепи в сумме содержат 288 аминокислотных остатков. Функциональные последствия замен весьма различны. Многие из них, в особенности происходящие на поверхности и не связанные с радикальным изменением природы аминокислотного остатка, безразличны для функциональных свойств, нейтральны и никак не выявляются клинически. Известно, однако, немало аномальных гемоглобинов, носители которых в большей или меньшей степени страдают от недостаточности функции гемоглобина. Тяжесть таких молекулярных болезней различна и обычно снижается за счет присутствия у гетерозигот нормального гемоглобина А.
Аномальные гемоглобины принято называть по местности, в которой была впервые обнаружена данная мутация. Во многих случаях удается, основываясь на данных о строении гемоглобина, объяснять молекулярные механизмы того или иного нарушения структурных и функциональных свойств гемоглобина.
В гемоглобине Вена остаток Туr-130 ß-цепи заменен аспарагиновой кислотой. Ее карбоксильная группа втягивается в гидрофобное ядро, занимая в нем место фенильного кольца тирозина, что дестабилизирует молекулу. Носители данной мутации страдают ге молитической анемией.
В гемоглобине Хаммерсмит замена Phe-42 в ß-цепи серином приводит к утрате весьма важного гидрофобного контакта с гемом. Более того, в гидрофобное окружение гема вторгается гидрофильная группа, а вслед за ней — вода. В результате дестабилизации гидрофобного ядра ß-цепь оказывается неустойчивой, легко теряет гем, происходит нежелательное окисление железа.
В гемоглобине Бостон дистальный His Е7 a-цепи заменен тирозином, фенольная группа которого образует ионную связь с ионом железа гема, не оставляя места для связывания молекулы кислорода. Аналогичная замена дистального гистидина на тирозин в ß-цепи приводит к образованию аномального гемоглобина Саскатун.
К весьма серьезным последствиям приводят замены аминокислот в зонах контактов между субъединицами. Так, замена Туr-35 в ß-цепи на фенилаланин дезорганизует a1 - ß1-контакт, так что белок распадается на мономеры.
Как уже отмечалось, нейтральными нередко оказываются мутации, затрагивающие аминокислотные остатки на поверхности молекулы. Однако в гемоглобине S (серповидно-клеточная анемия) замена поверхностного остатка Glu-6 в ß-цепи валином приводит к образованию дезоксиформой надмолекулярных агрегатов — протяженных пучков, а затем и кристаллических структур. По-видимому, появление гидрофобной аминокислоты в этой позиции недопустимо, так как ее боковая группа находит какую-то контактную площадку в другой части молекулы гемоглобина S, что и вызывает неконтролируемую агрегацию. Следует учитывать, что концентрация гемоглобина в эритроцитах очень велика и приближается к 35%, поэтому угроза образования агрегатов и даже осадков весьма реальна. Агрегаты гемоглобина S вызывают искажение формы эритроцитов, нарушая кровообращение в капиллярах.
Есть основания полагать, что мутация, приведшая к образованию гемоглобина S вместо гемоглобина А, произошла в средние века на Аравийском п-ове, откуда распространилась по путям миграции. В некоторых тропических районах распространения малярии эта мутация стала закрепляться, поскольку возбудитель болезни плохо адаптируется к существованию в эритроцитах, измененных присутствием агрегатов аномального гемоглобина. Это явление может служить простейшей моделью закрепления мутантных белков в популяции под давлением отбора.
Разумеется, аномальными могут быть не только гемоглобины, но и любые другие белки. В частности, описан ряд аномальных альбуминов сыворотки крови человека.