Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Систематика ферментов
Каждая из примерно 2-3 тыс. реакций обмена в клетке катализируется своим ферментом; следовательно, даже без учета видовых различий существует не менее 2-3 тыс. ферментов. Это число значительно вырастет, если учесть, что реакции одного и того же типа могут катализироваться ферментами различной природы, а также рассматривать ферменты, вовлеченные в передачу сигналов и процессы, свойственные многоклеточным (например, ферменты системы свертывания крови). Вероятно, общее число видов ферментов приближается к десяти тысячам.
Для строго обоснованной классификации столь большого числа ферментов пока недостаточно данных. Рациональной была бы систематика, основанная на эволюционных соотношениях между ферментами, глубоком знании их структурных и функциональных особенностей. Это позволило бы объединять в таксоны соответствующих рангов ферменты, возникшие в ходе эволюции одного предшественника. Такая систематика в настоящее время создается для некоторых групп ферментов, в частности для протеиназ.
Однако для практического применения систематики, базирующейся на эволюционных предпосылках, требуется не только предварительное изучение множества родственных ферментов, но и получение большого объема данных о свойствах и, главное, структуре классифицируемого фермента, на что трудно рассчитывать на первых этапах исследования.
Ввиду этого принятая официально классификация ферментов использует в качестве основного отличительного признака их субстратную специфичность, характер проводимых ими реакций, т.е. именно то свойство, которое определяется первым при обнаружении и выделении фермента. Этот признак практически удобен, однако следует учитывать, что он может объединять ферменты различного происхождения, структуры и даже механизма действия.
Международная классификация ферментов (КФ) разделяет ферменты в соответствии с типом катализируемых ими реакций на следующие шесть классов.
Оксидоредуктазы. К этому классу принадлежат все ферменты, катализирующие окислительно-восстановительные реакции. Субстрат, подвергающийся окислению, рассматривают как донор водорода, поэтому к ферментам данного класса нередко применяют термин дегидрогеназа, хотя это название отражает только одно из двух возможных направлений реакции. Термин оксидаза употребляют только в тех случаях, когда О2 выступает как непосредственный акдептор водорода.
Трансферазы. Ферменты этого класса переносят ту или иную группу от одного соединения к другому К их числу принадлежат, например, киназы — ферменты, переносящие фосфорильный остаток АТФ на различные субстраты, аминотрансферазы (трансаминазы), переносящие аминогруппу аминокислот на кетокислоты.
Гидролазы. Эти ферменты можно рассматривать как трансферазы, переносящие ту или иную группировку на молекулу воды. Выделение их в особый класс оправдано чрезвычайно широкой распространенностью гидролаз, вовлеченных, в частности, в процессы деградации биополимеров. Известны гидролазы, катализирующие гидролиз С—О, С—N, С—С, О—Р и ряда других связей. Иногда один и тот же фермент способен катализировать гидролиз связей разной природы. Так, некоторые протеиназы, расщепляющие пептидные связи в белках, могут даже с большей эффективностью гидролизовать сложные эфиры, выступая как эстеразы. Выбор термина протеиназа в таких случаях основан на представлениях о физиологической роли данного фермента и, следовательно, о характере его природного субстрата.
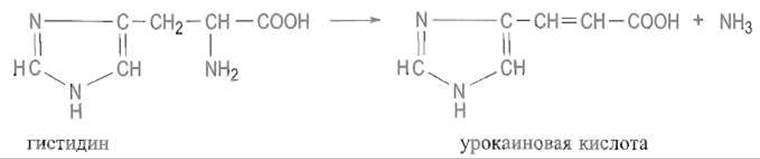
Лиазы. К ним относят ферменты, разрывающие связи С—С, С—О, С—N и некоторые другие путем элиминирования соответствующей молекулы с одновременным образованием двойной связи. В обратной реакции лиазы катализируют присоединение молекул воды, аммиака и т.д. по двойной связи. Таков, например, гистидинаммиаклиаза — фермент, отщепляющий аммиак от гистидина с образованием ненасыщенной урокаиновой кислоты:
Изомеразы. Ферменты этого типа катализируют геометрические или структурные перестройки, изомеризации в пределах одной молекулы. К ним, в частности, относятся рацемазы, таутомеразы, циклоизомеразы. В качестве примера укажем на рацемазу лактама лизина, катализирующую взаимный переход L- и D-изомеров этого соединения (см. гл. 1), триозофосфатизомеразу, катализирующую взаимопревращение фосфоглицерииового альдегида и диоксиацетонфосфата.
Лигазы (синтетазы). К этому классу относятся ферменты, катализирующие соединение двух молекул, сопряженное с гидролизом АТФ. Они играют ключевую роль в процессах биосинтеза, обеспечивая за счет энергии гидролиза АТФ протекание таких реакций, которые сами по себе были бы термодинамически невыгодными. Примером могут служить аминоацил-тРНК-синтетазы.
Каждый из перечисленных шести классов ферментов разбивают (опять-таки по признаку специфичности) на подклассы и под-подклассы, которым присваиваются порядковые номера в соответствии с Международной классификацией. Например, гидролазы, расщепляющие эфиры карбоновых кислот, относятся к классу 3 (гидролазы), подклассу 3.1 (ферменты, действующие на сложноэфирные связи) и подподклассу 3.1.1 (гидролазві эфиров карбоновых кислот). Конкретный фермент внутри подподкласса получает свой порядковый номер. Так, липаза, гидролизующая триацилглицерины, имеет номер 3.1.1.3.