Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Лизоцим
Лизоцим относится к классу гидролаз и представляет собой сравнительно небольшой фермент, избирательно гидролизующий гликозидные связи в муреине — сложном биополимере, из которого построены стенки бактериальных клеток. Структурную основу муреина (рис. 10.6) составляют полисахаридные цепи чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных 1,4-β-гликозидными связями. К карбоксильным группам лактильных остатков N-ацетилмурамовой кислоты присоединены своеобразно построенные пептидные цепочки, поперечно соединяющие полисахаридные цепи в протяженную двумерную структуру. Известны лизоцимы животных, содержащиеся преимущественно в секрете слизистых оболочек, которые они защищают от микроорганизмов, лизоцимы бактериофагов, используемые для проникновения в бактериальную клетку и выхода из нее зрелого фага. Наиболее подробно изучен лизоцим белка куриного яйца, который и будет рассматриваться далее. Он состоит из одной полипептидной цепи, содержащей 129 аминокислотных остатков.
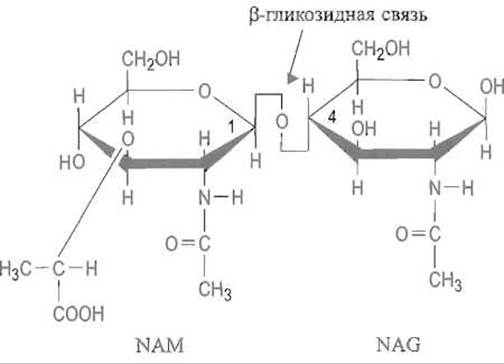
Рис. 10.6. Повторяющееся дисахаридное звено в полисахаридной цепи муреина.
К карбоксильной группе лактильного фрагмента N-ацетилмурамовой кислоты (NAM) присоединяются полипептидные мостики, соединяющие полисахаридные цепи. Лизоцим атакует ß-гликозидную связь между остатками NAM и N-ацетилглюкозамина (NAG), так что атом кислорода этой связи оказывается у N-ацетилглюкозамина
Имеющиеся сведения о механизме действия лизоцима основаны по преимуществу на данных рентгеноструктурного анализа фермента и его комплексов с аналогами субстрата — олигосахаридами, построенными из N-ацетилглкжозамина.
Образование комплекса протяженного полисахарида и фермента является результатом множественных нековалентных взаимодействий между ферментом и шестью последовательно расположенными моносахаридными звеньями А—В—С—В—Е—F, укладывающимися в зоне связывания субстрата (рис. 10.7).
По-видимому, наиболее прочно связывается звено С субстрата, расположенное неподалеку от расщепляемой гликозидной связи. С ним фермент образует четыре водородные связи — две за счет ацетамидной группировки субстрата, которая формирует нечто вроде ß-структуры с карбонильной группой остатка 107 и NH-группой остатка 59, и еще две связи за счет NH-групп индольных колец триптофана Тrр-62 и Тrр-63. Предшествующие звену С звенья А и В образуют с ферментом по одной водородной связи.
Определенную роль в формировании фермент-субстратного комплекса играют и ван-дер-ваальсовы взаимодействия, в частности между кольцом В и остатком Тrр-62. Впрочем, мутанты лизоцима, в которых этот остаток заменен на тирозин, фенилаланин или гистидин, обладают даже несколько большей активностью. Характерно, что укладка первых трех звеньев полисахаридной цепи — А, В и С — требует локальных изменений в прилегающих участках фермента. Так, индольное кольцо Тrр-62 перемещается на 0,7 А, освобождая место для плотного укладывания субстрата.
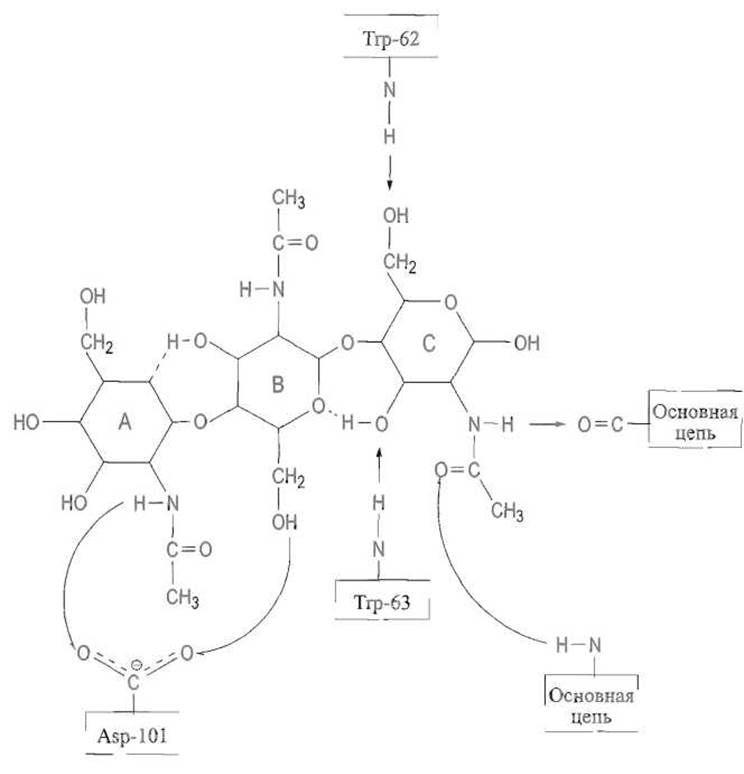
Рис. 10.7. Связывание субстрата в активном центре лизоцима.
Показана система водородных связей (обозначены стрелками), обеспечивающих связывание части субстрата — колец А, В, С. Эти связи дополняются ван-дер-ваальсовыми контактами, в частности с индольным кольцом триптофана
Есть основания полагать, что образование фермент-субстратного комплекса начинается со связывания моносахаридных звеньев А, В и С, вслед за которыми во впадину на поверхности фермента укладываются еще три звена: D, Е и F. Непосредственно наблюдать связывание этой части субстрата не удается, поскольку гексасахарид быстро расщепляется лизоцимом. Однако размещение модели гексасахаридного субстрата на пространственной модели фермента показало, что звенья Е и F не только легко укладываются, но и образуют ряд нековалентных взаимодействий в зоне связывания.
Сложнее обстоит дело с остатком D, а именно его В-гликозидная связь с остатком Е атакуется ферментом в гексасахариде. Это звено нельзя разместить в зоне связывания фермента в обычной для моносахаридов конформации «кресла» — оно не укладывается в субстратную щель из-за помех, вызываемых слишком близкими контактами атомов С-6 и 0-6 этого звена с лизоцимом. Эти помехи, однако, полностью снимаются, если звено D изменит свою конформацию и перейдет в напряженную конформацию «полукресла» (рис. 10.8). Таким образом, связывание субстрата должно благоприятствовать искажению конформации вблизи атома углерода С-1 звена D, который непосредственно участвует в реакции. Характерно, что аналоги субстрата, содержащие концевой глюконолактон, также имеющий конформацию полукресла, очень прочно связываются ферментом и выступают в качестве его ингибиторов.
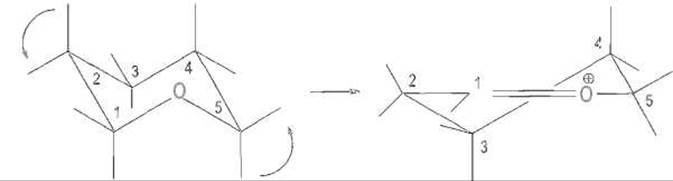
Рис. 10.8. Конформация «полукресла», свойственная шестичленным циклам (в том числе моносахаридам) с двойной связью в цикле
Предполагают, что дальнейшее действие лизоцима (рис. 10.9) обусловлено сближением гликозидной связи, соединяющей звенья D и Е, и карбоксильной группой остатка Glu-35, который входит в активный центр фермента. Эта карбоксильная группа находится в гидрофобном окружении, поэтому ее диссоциация привела бы к энергетически невыгодному образованию отрицательно заряженного карбоксилат-аниона в неполярной среде, где затруднена его гидратация. Как следствие, карбоксильная группа остатка Glu-35 является более слабой кислотой по сравнению с другими карбоксильными группами лизоцима (ее рКа близок к 6), и, как правило, в свободном ферменте она удерживает протон.
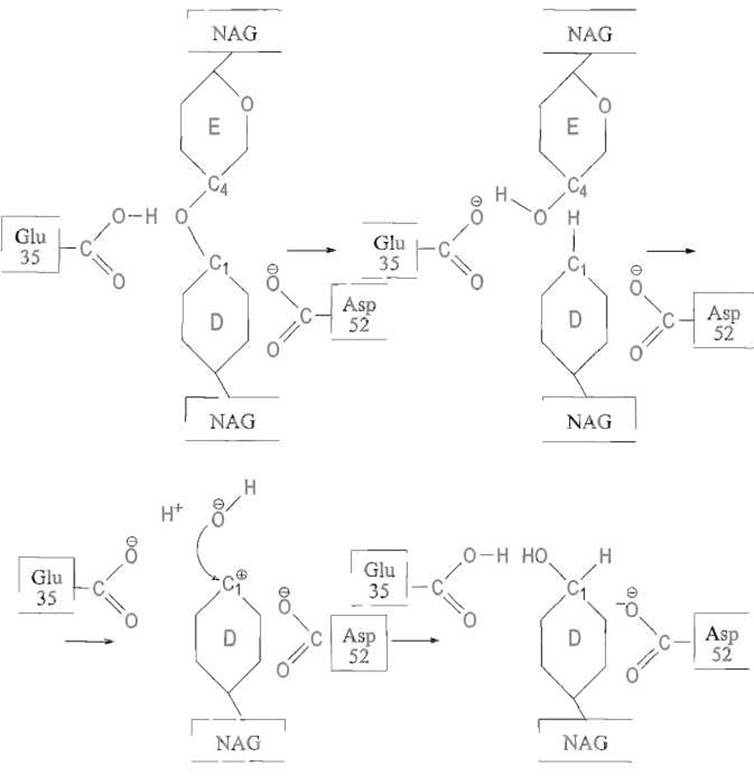
Рис. 10.9 Механизм действия лизоцима.
Протон карбоксильной группы Glu-35 переносится на сближенный с ним кислород гликозидной связи, образуя оксониевый ион. Далее электронная пара, обслуживавшая связь атома С-1 NAG и этого атома кислорода, переносится на последний, что приводит к разрыву гликозидной связи. В результате атом С-1 оказывается заряженным положительно, т.е. приобретает свойства карбокатиона, имеющего плоскую структуру, чему благоприятствует конформация полукресла. Дополнительно заряд стабилизируется взаимодействием с отрицательно заряженной карбоксилатной группой остатка Asp-52. На завершающей фазе реакции молекула воды занимает место ушедшего кислорода гликозидной связи, поляризуется зэ счет взаимодействия с анионной формой Glu-35 и образовавшийся гидроксил-ион атакует несущий положительный заряд атом С-1 (остальные пояснения см. в тексте)
При сближении с гликозидной связью субстрата в фермент-субстратном комплексе эта группа выступает как донор протона, присоединяющегося к гликозидному атому кислорода с образованием неустойчивого положительно заряженного оксониевсго иона:
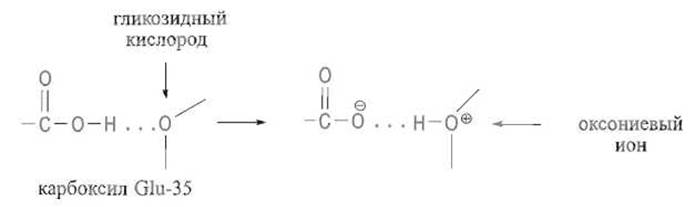
Далее оксониевый ион стабилизируется за счет перемещения к атому кислорода электронной пары, обслуживавшей его связь с C-1-атомом звена D. Следует разрыв связи между этими атомами и вместе с тем между звеньями D и Е, причем положительный заряд переносится на атом С-1 с образованием карбониевого иона Дисахарид Е—F или аналогичный фрагмент более длинного субстрата покидает после этого зону связывания субстрата, так как его соединяют с ней лишь немногие нековалентные взаимодействия, а связь с фрагментом А—В—С—D утрачена.
Остаток Glu-35 критически важен для каталитического механизма — его замена на глутамин, проведенная методом сайт-специфичного мутагенеза, лишает фермент активности.
Положительный заряд на С-1 стабилизируется двумя факторами
1. Устанавливается электростатическое взаимодействие между ним и отрицательно заряженным карбоксилат-анионом Asp-52, весьма эффективное в отсутствие воды, которая вытесняется с поверхности фермента при связывании субстрата. Заслуживает внимания то, что кислотные свойства карбоксильной группы этого остатка, в отличие от карбоксила Glu-35 усилены его гидрофильным окружением. Это объясняется тем, что анионная форма карбоксила Asp-52 стабилизируется путем включения в систему водородных связей с соседними остатками.
Следует обратить внимание на столь характерное для белков вообще изменение свойств функциональных групп за счет разницы в их микроокружении. Роль этой группы нельзя недооценить, но она, видимо, не абсолютно необходима: замена Asp-52 на аспарагин снижает удельную активность фермента примерно до 5% от исходной, но не приводит к полной его инактивации.
2. Положительный заряд на атоме С-1 частично компенсируется смещением электронной пары от соседнего с ним атома кислорода в цикле. При этом связь О—С+ приобретает характер частично двойной, что приводит к плоскостной конформации всего этого участка кольца D и переходу атома С-1 из обычной тетраэдрической в тригональную структуру:

Но именно такая конформация, необходимая для стабилизации карбокатиона, соответствует структуре полукресла и реализуется в фермент-субстратном комплексе за счет отмеченного выше искажения стереохимии кольца D при связывании олигосахарида. По-видимому, необходимая для этого энергия «заимствуется» из энергии связывания протяженного субстрата.
Таким образом, электростатические и стереохимические эффекты в каталитическом центре лизоцима действуют согласованно, стабилизируя структуру плоского карбокатиона, характерную для переходного состояния в фермент-субстратном комплексе.
Далее карбокатион подвергается атаке молекулой воды, которая связывается анионом остатка Glu-35, занимая примерно то же место, в котором находился кислород гликозидной связи перед ее расщеплением.
Анион Glu-35 поляризует молекулу воды, отрывая протон, что соответствует свойствам карбоксильной группы этого остатка как слабой кислоты. Образующийся сильный нуклеофил ОН--ион атакует положительно заряженный атом углерода С-1 с одновременной нейтрализацией зарядов. Поскольку молекула воды приближается к плоскому карбокатиону с той же стороны, где находился кислород гликозидной связи, стереохимия атома С-1 полностью восстанавливается и гидроксильная группа при этом атоме занимает, подобно кислороду гликозидной связи, ß-положение:
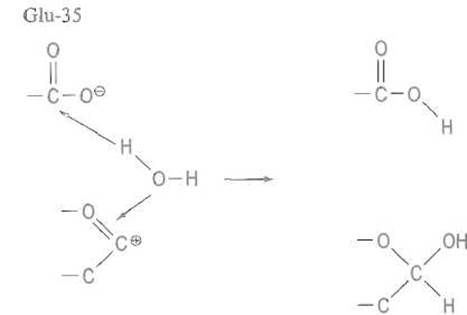
Этим завершается цикл ферментативной реакции, в результате которого ß-гликозидная связь в муреине оказывается гидролизо ванной, а лизоцим — готовым к последующим циклам каталитического механизма.
Характерно, что лизоцим фага Т4 действует на полисахарид бактериальных стенок аналогично, также используя перевод моносахаридного звена при атакуемой связи в конформацию полукресла, однако в каталитическом механизме этого фермента принимают участие иные функциональные группы. Искажение конформации субстрата как существенный элемент каталитического механизма предполагают и для некоторых других ферментов, атакующих гликозидные связи, в частности для фосфорилазы.
В заключение отметим главнейшие черты механизма действия лизоцима:
- организация системы нековалентных взаимодействий, фиксирующих протяженный субстрат;
- стерические ограничения на связывание именно того звена в субстрате, гликозидная связь которого расщепляется, и, как следствие, перевод его в необычную конформацию, выгодную для стабилизации карбокатиона в переходном состоянии;
- согласованное действие двух карбоксильных групп, одна некоторых выступает в качестве донора протона, а другая в анионной форме способствует стабилизации карбокатиона в переходном комплексе.