Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Посттрансляционная модификация белка
АДФ-рибозилирование
Реакция переноса АДФ-рибозного остатка НАД на белки, катализируемая специфическими ферментами, используется для регуляции активности ряда ферментов, в том числе глутаминсинтетазы, где модифицируется остаток тирозина.
Аналогичную реакцию переноса АДФ-рибозного фрагмента катализируют некоторые бактериальные токсины. Каталитический домен дифтерийного токсина, образующийся в результате ограниченного протеолиза, катализирует присоединение этого фрагмента к фактору элонгации EF-2 в клетках эукариот и архебактерий. Модификации подвергается производное гистидина (содержащееся в консервативном районе последовательности этого фактора) — дифтамид, в свою очередь образуемый многоступенчатой модификацией остатка гистидина.
На первом этапе аденозилметионин (AdoMet), обычно являющийся донором метальной группы, выступает при алкилировании имидазольного кольца как донор фрагмента —СН2—СН2—CH—СООН:
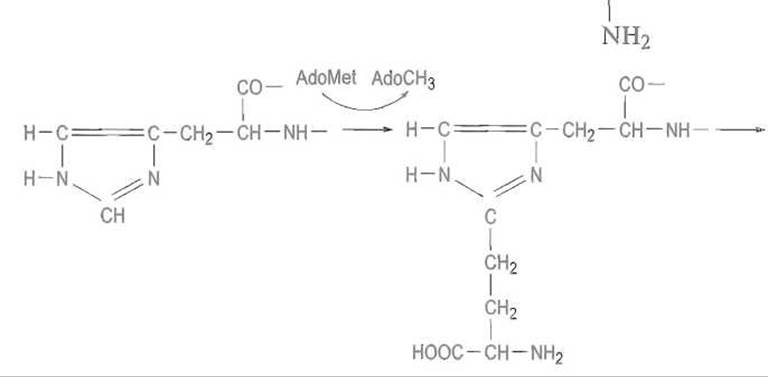
Затем происходит исчерпывающее метилирование аминогруппы присоединившегося фрагмента. В этом случае аденозилметионин является источником метальных групп, превращаясь в аденозилгомоцистеин (AdoHcy). Модификацию завершает амидирование карбоксильной группы, которое протекает с одновременным гидролизом АТФ и приводит к дифтамиду:
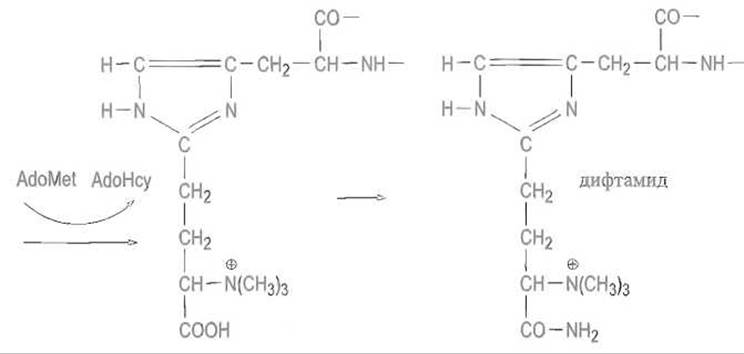
АДФ-рибозилирование дифтамида, катализируемое дифтерийным токсином, инактивирует фактор элонгации EF, прерывая тем самым трансляцию, что приводит к гибели клетки.