Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Посттрансляционная модификация белка
Липопротеины
К липопротеинам в строгом смысле этого термина принадлежат белки, содержащие ковалентно связанные липиды. Однако традиционно к ним относят белки, участвующие в транспорте липидов и образующие с ними нековалентные комплексы, например липопротеины крови. Мы рассмотрим только такие липопротеины, которые отвечают строгому определению.
11.7.1. Липопротеины с С-концевым гликолипидом
Обнаружено около 30 белков, которые встраиваются в мембраны животных клеток за счет гидрофобных взаимодействий между липидами мембраны и своеобразно организованной С-концевой частью белка, представляющей собой гликолипид (так называемые «PІG-tailed»-белки — «белки со свиными хвостиками», от англ. Phospho-Inositol-Glyсаn). К ним принадлежат щелочная фосфатаза, глобулярная форма ацетилхолинэстеразы, высоковариабельный гликопротеин поверхности трипаносом, адгезионный белок нервных. клеток и т.д.
По завершении биосинтеза полипептидной цепи С-концевой участок такого белка, содержащий от 17 до 31 остатка преимущественно гидрофобных аминокислот, отщепляется, заменяясь следующей структурой:
белок—СО—NH—СН2СН2О—гликан—глюкозамин—фосфоинозит—диацилглицерин этаноламин
Гликолипидный фрагмент несколько различается у разных белков строением гликана, содержащего галактозу, набором жирных кислот в диацилглицериновом звене, среди которых отмечено присутствие пальмитиновой и миристиновой кислот.
Весь гликолипидный фрагмент удается в некоторых случаях удалить при действии протеиназы. Связь между глюкозамином и фосфоинозитом расщепляется при действии азотистой кислоты. Особенно характерно отщепление липида при действии фосфолипаз D или С, которые гидролизуют соответственно фосфодиэфирные связи между инозитом и фосфатидовой кислотой или фосфоинозитом и диацилглицерином, что приводит к отделению белка от мембраны. Имеются сведения, что фосфолипаза С каким-то образом участвует в механизме действия инсулина, отщепляя гликолипидный фрагмент от липопротеинлипазы, В результате последняя утрачивает связь с наружной мембраной жировых клеток, что сказывается на катаболизме триглицеридов. Во всяком случае, очевидно, что в рассматриваемых белках гликозил-фосфатидил-инозит не является инертным «якорем».
11.7.2. Липопротеины с N-концевой липидной группировкой
Известны два способа присоединения липидной группировки к аминному концу белка. Простейший состоит в N-миристоилировании — переносе остатка миристиновой кислоты —СН3(СН2)12СО— от миристоилкоэнзима А на а-аминогруппу N-концевого остатка глицина белка. Гидрофобный миристоильный остаток участвует в удерживании белка в липидном слое мембраны или, возможно, связывается специальным белком-рецептором.
Некоторые белки микроорганизмов, например ß-лактамаза Bacillus cereus, взаимодействуют с липидами мембран при помощи своеобразного липидного якоря. Последний формируется на аминном конце полипептидной цепи после отщепления от нее сигнального пептида, обеспечивающего перенос полипептидной цепи белка через мембрану. В таких белках аминоконцевое положение неизменно занимает остаток цистеина. К его сульфгидрильной группе тиоэфирной связью присоединяется остаток диацилглицерина, затем еще один остаток жирной кислоты ацилирует а-аминогруппу цистеина, что приводит к следующей структуре:
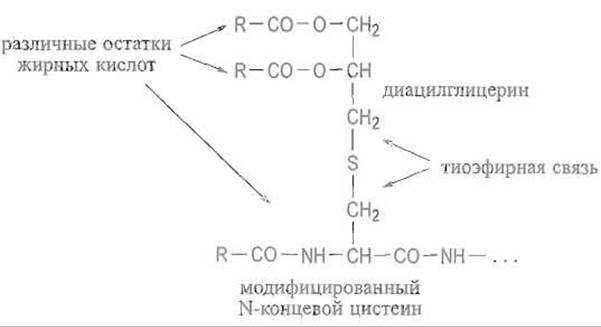
Сосредоточение сразу трех остатков жирных кислот у N-концевого цистеина делает аминоконцевую часть полипептидной цепи белка весьма гидрофобной, чем и обусловлена возможность его взаимодействия с липидами мембраны. Вся эта конструкция надежно удерживает белок связанным с мембраной, причем белковая глобула полностью погружена в среду, прилегающую к мембране, например в периплазматическое пространство бактериальных клеток.
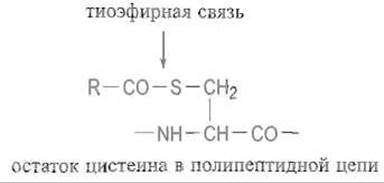
Сказанным не ограничиваются структурные типы липопротеинов. По-видимому, белок резус-фактора (Rh-белок), локализованный в мембране эритроцитов человека, содержит несколько (до четырех) остатков пальмитиновой кислоты, присоединенных тиоэфирньми связями к сульфгидрильным группам цистеина, что делает его очень гидрофобным:
11.7.3. Пренилированные белки
Реакции S-пренилировашя, заключающейся в присоединении изопреноидов к атому серы остатка цистеина, который локализован в С-концевом участке полипептидной цепи, подвергается около 100 белков, в частности белок Ras (см. гл. 12). Первоисточником пренильных группировок является изопентенилпирофосфат, изомеризующийся с перемещением двойной связи в диметилаллилпирофосфат:
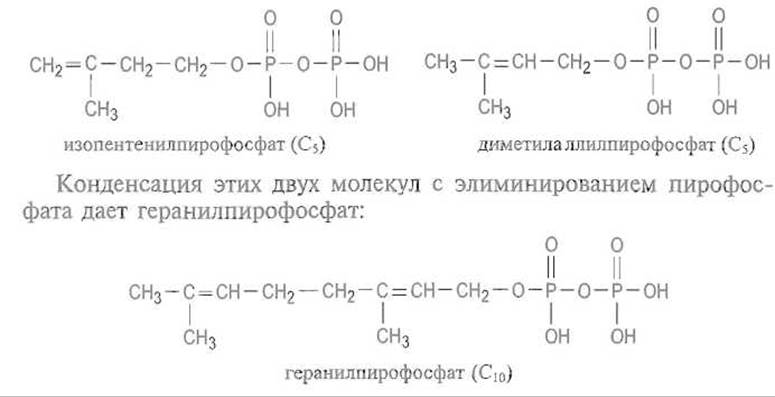
Далее молекула наращивается последовательным присоединением изопентенил-пирофосфата по такому же механизму, причем на каждом шаге присоединяется С5-звено. Это приводит к фарнезилпирофосфату (С15), являющемуся также предшественником стероидов и каротиноидов, и геранилгеранилпирофосфату (С20):
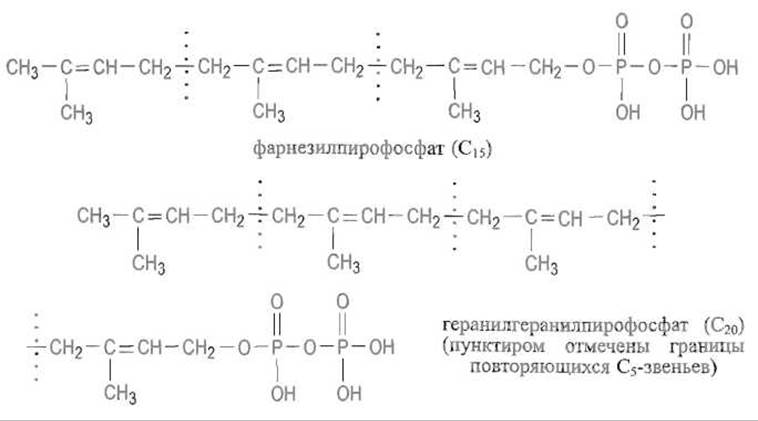
Фарнезильная или геранилгеранильная группы с отщеплением пирофосфата переносятся на атом серы остатка цистеина, который расположен вблизи С-конца полипептидной цепи в последовательности С—А—А—X (так называемом СААХ-боксе), где С — остаток цистеина, А — остатки алифатических аминокислот, X - С-концевая аминокислота, определяющая, какой из двух типов реакции пренилирования осуществится. Если X — серин, метионин или глутамин, то к цистеину присоединяется фарнезил (С15), если X — лейцин, то происходит присоединение геранилгеранила (С20) Пренилирование белков включает в себя следующую цепь превращений. Пренилтрансфераза переносит пренильный остаток соответствующего пренилпирофосфата на SH-группу остатка цистеина в белке, имеющем на С-конце СААХ-бокс. Затем специфическая пептидаза отщепляет выполнившую роль сигнала последовательность А—А—X, после чего с участием метилтрансферазы метальная группа S-аденозилметионина переносится на карбоксил пренилированного цистеина, превращая его в метиловый эфир:

Очевидно, что присоединение к белку крупной гидрофобной пренильиой группировки благоприятствует его включению в цитоплазматическую мембрану. При этом существенно, что от типа пренильной группы зависит ориентация белка в мембране — фарнезилированные белки встраиваются во внешнюю мембрану, белки же, содержащие геранилгеранильный остаток, — во внутреннюю мембрану, обращенную к цитоплазме. Впрочем, у этого правила могут быть исключения, кроме того, в адресовании пренилированных белков участвуют, вероятно, и другие элементы их структуры. Таким образом, реакция пронилирования — один из процессов, определяющих локализацию белков в биологических структурах, их топогенез.