ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 29. Иммунологические методы
■ Многие иммунологические методы основаны на взаимодействии антигена с антителом; высокая специфичность антител позволяет идентифицировать, выделять или количественно определятьисследуемый антиген.
■ Клеточные популяции можно выявить и идентифицировать по маркерам клеточной поверхности с помощью иммунофлуоресцентных и иммуногистохимических методов.
■ Выделение популяций клеток, несущих определенные поверхностные маркеры, можно осуществить различными методами, включая проточную цитофлуориметрию с использованием клеточного сортера, пэннинг и ультрацентрифугирование в градиенте плотности.
■ Основными показателями функциональной активности лимфоцитов служат продукция антител или цитокинов, пролиферативная реакция на антиген или цитотоксическая активность.
В иммунологии применяется целый ряд экспериментальных методов из других областей биологии. Так, выделение антигенов и антител производят с помощью биохимических методов фракционирования белков, гены иммунологически важных молекул секвенируют обычными молекулярно-генетическими методами. Вместе с тем в иммунологии разработаны и свои специальные методы исследования, основанные на взаимодействии антиген—антитело. Эти иммунологические методы в спою очередь нашли применение в различных областях биологии. В частности, любые молекулы, обладающие антигенными свойствами, можно выявлять в тканях иммуногистохимическими методами. Для количественного определения таких молекул, присутствующих в чрезвычайно низких концентрациях, применяют радиоиммуноанализ (РИА) и ферментный иммуносорбентный анализ (ELISA, от enzyme-linked immunosorbent assay). В настоящее время существуют сотни разнообразных иммунологических методов; наиболее широко применяемые из них описаны в этой главе.
ВЗАИМОДЕЙСТВИЕ АНТИГЕН-АНТИТЕЛО
Реакция преципитации
Одним из первых описанных проявлений взаимодействия антиген—антитело было образование преципитата при смешивании обоих реагентов в эквивалентных или близких к эквивалентным количествах. Оно наблюдается при постановке классической реакции преципитации с растворимыми антигенами и антителами (рис. 29.1). Если проводить эту реакцию в агаровом геле, можно дифференцировать отдельные реакции антиген-антитело, обусловленные различными популяциями антител, присутствующими в сыворотке. Такой метод, названный методом двойной иммунодиффузии, применяется также для проверки сходства между различными антигенами (рис. 29.2).
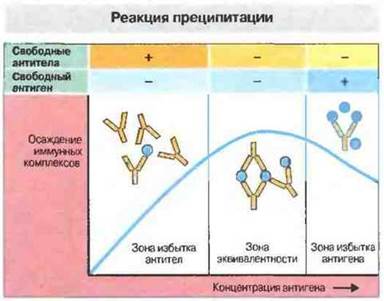
Рис. 29.1. Классический пример взаимодействия антиген-антитело in vitro - это реакция преципитации. Для ее получения антиген в возрастающих концентрациях добавляют к раствору антител. Количество осаждающихся иммунных комплексов вначале возрастает, а затем падает. Таким образом, кривая преципитации имеет три зоны.
Зона избытка антител: количества антигена недостаточно для того, чтобы в реакцию вступили все антитела: в супернатанте определяются свободные антитела.
Зона эквивалентности: количества антигена достаточно для связывания и осаждения всех имеющихся антител; свободные антигены и антитела в супернатанте отсутствуют.
Зона избытке антигена: количество антигена превышает необходимое для связывания всех антител, что ведет к снижению содержания антител в преципитате. Это обусловлено солюбилизацией комплексов антиген-антитело вследствие избытка антигена. Выраженность этого феномена варьирует в зависимости от типа антител и вида организма, от которого получены антитела.
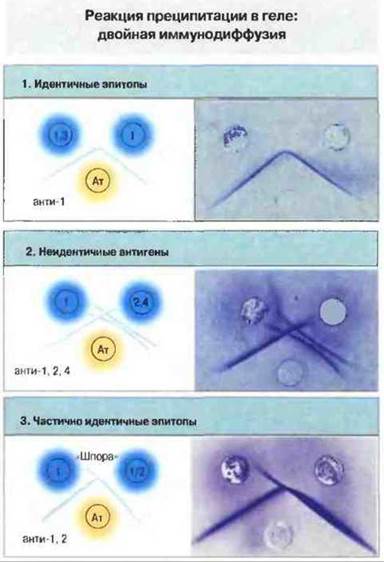
Рис. 29.2. Для проведения двойной иммунодиффузии агаровый гель наливают на предметные стекла, после застывания вырезают в нем лунки и заполняют их исследуемыми растворами антигена (Аг) и антител (Ат). Растворы диффундируют в гель, и на той линии, где происходит взаимодействие Аг и Ат (с перекрестным связыванием и осаждением иммунных комплексов), образуется линия (дуга) преципитации. Ее можно наблюдать визуально, если промыть гель (для удаления растворимых белков) и нанести на него краситель, выявляющий белки, например кумасси синий. Такой метод может быть использован для определения родства между антигенами (синие кружки) и в реакции с данными тест-антителами (желтый кружок). При этом возможны три основных типа результатов (цифры в синих кружках обозначают эпитопы антигена). В реакции (1) дуги преципитации, образованные антителами и двумя исследуемыми антигенами, сливаются: это показывает, что антитела взаимодействуют с идентичными эпитопами на двух антигенах (эпитоп 1). Такой результат не означает полную идентичность самих антигенов, но только их идентичность в том смысле, что данные антитела не выявляют различий между ними. В реакции (2) антитела выявляют 3 разных антигена, которые образуют независимые дуги преципитации. В реакции (3) антигены имеют общий эпитоп 1, однако один из них несет еще эпитоп 2. Этот случат: отличается от реакции (1) тем, что здесь антитела могут различить антигены, поскольку вступают в реакцию с обоими эпитопами. В результате взаимодействия с антиэпитопом 1 образуется линия идентичности, а там, где антиэпитоп 2 реагируете эпитопом 2, формируется «шпора», указывающая на лишь частичную идентичность двух антигенов.
Однако некоторые смеси антигенов слишком сложны для разделения просто путем диффузии и преципитации, и для анализа таких смесей был разработан метод иммуноэлектррфореза — прежде чем выявлять антигены визуально в реакции преципитации, их разделяют по заряду с помощью этого метода (рис. 29.3).
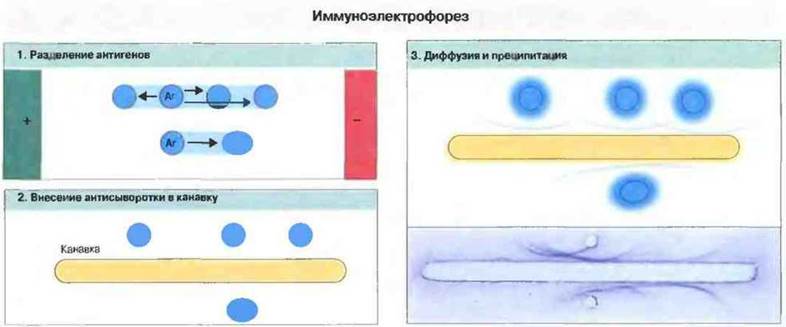
Рис. 29.3. Иммуноэлектрофорез позволяет разделять сложные смеси антигенов, например антигены, содержащиеся в сыворотке крови 1. Разделение осуществляют в агаровом геле, помещенном в электрическое поле, причем pH геля устанавливают так, чтобы положительно заряженные белки перемещались к катоду, а отрицательно заряженные - к аноду. 2. Затем между лунками вырезают канавку, которую заполняют раствором антител, диффундирующих в гель. 3. Антигены и антитела формируют дуги преципитации.
Методы, основанные на диффузии в геле, позволяют определять антигены и антитела лишь качественно, количественную же оценку реагирующих компонентов проводят разработанным позднее молодом простой радиальной иммунодиффузии (рис. 29.4).
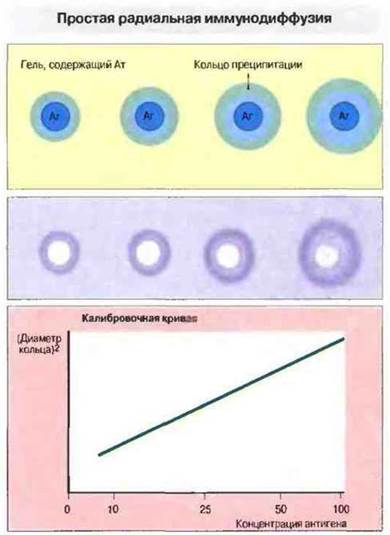
Рис. 29.4. Простая радиальная иммунодиффузия дает возможность количественно определять антигены (Аг). В агаровый гель добавляют антитела (Ат), затем наливают его на предметные стекла и оставляют для застывания. В застывшем геле вырезают лунки и вносят в них стандартный объем различных по концентрации растворов антигена. Стекла оставляют не менее чем на 24 ч. В течение этого времени антиген диффундирует в гель и образует с антителами растворимые комплексы (при избытке антигена). Комплексы продолжают диффундировать, связывая все больше антител, пока не будет достигнута точка эквивалентности и не произойдет осаждение комплексов с образованием кольца. По радиусу зоны, ограниченной кольцом преципитации, определяют ее площадь. Величина площади пропорциональна концентрации антигена, которую вычисляют с помощью калибровочной кривой (график внизу). Для определения концентрации антител применяют тот же метод, но в обратной постановке, т. е. в гель добавляют антиген, а антитела вносят в лунки.
Иммунодиффузию в электрическом поле можно производить с одновременным встречным движением антигенов и антител; этот способ назван встречным электрофорезом. Аналогичная модификация простой радиальной иммунодиффузии получила название ракетный электрофорез (рис. 29.5).
Описанные методы используются для определения антигенов и антител в концентрации от 20 мкг/мл до 2 мг/мл.
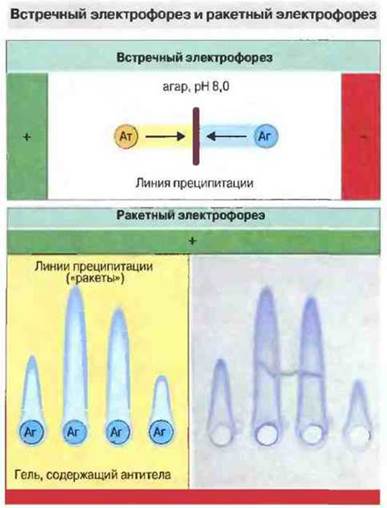
Рис. 29.5. Встречный электрофорез проводят в агаровом геле, pH которого устанавливают так, чтобы антитела (Ат) несли суммарный отрицательный заряд, а исследуемый антиген (Аг) - положительный. В электрическом поле антиген и антитела движутся навстречу друг другу и преципитируют. Принцип метода тот же самый, что и при двойной иммунодиффузии, однако чувствительность выше в 10-20 раз. Ракетный электрофорез позволяет количественно определять антиген в антителосодержащем геле, pH которого подбирают с таким расчетом, чтобы движения антител не происходило, а антиген нес суммарный отрицательный заряд. Линия преципитации очерчивает область в виде ракеты, длина которой пропорциональна концентрации антигена. Определить эту концентрацию можно по калибровочной кривой. Внизу справа - фотография окрашенного геля. Оба метода основаны на различии суммарных зарядов антигена и антител при выбранном pH; для большинства антигенов такие различия существуют, так как антитела имеют более высокую изоэлектрическую точку (т е. несут нейтральный заряд при более высоком значении pH, чем большинство антигенов). Если заряды антигена и антител существенно не различаются, можно химически модифицировать антиген, чтобы сдвинуть изоэлектрическую точку. Ракетный электрофорез проводят и в обратной постановке, если требуется определить концентрацию антител; здесь важно подобрать правильно гель и pH для иммобилизации антигена, чтобы не нарушалась его структура и не возникло препятствий для реакции антиген-антитело. (R - диаметр кольца преципитации.)
Реакции гемагглютинации и связывания комплемента
Если антитела присутствуют в столь низких концентрациях, что их не удается обнаружить и количественно определить при помощи встречного и ракетного электрофореза, применяют реакцию гемагглютинации. Она основана на способности антител перекрестно связываться с эритроцитами, взаимодействуя с их поверхностными антигенами (рис. 29.6).
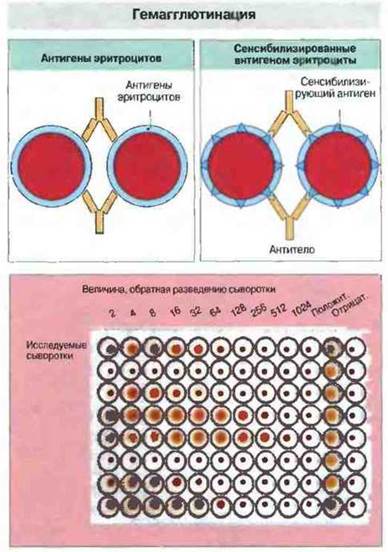
Рис. 29.6. Реакцию активной гемагглютинации (вверху слева) используют для выявления антител к антигенам эритроцитов. Сыворотку последовательно разводят (обычно используют двукратные разведения) физиологическим раствором и вносят в лунки планшета (внизу; ряды 1-10 слева направо). Ряды 11 и 12 служат для положительного и отрицательного контролен. В данном примере исследовано 8 разных антисывороток (А - Н). В каждую лунку вносят суспензию эритроцитов (содержащую особый белок для предотвращения неспецифической агглютинации эритроцитов) до концентрации клеток 1 %. Если количество антител в лунке достаточно для агглютинации (перекрестного связывания) всех эритроцитов, они осаждаются на дно лунки, образуя пятно. Если же антител недостаточно, клетки, скатываясь по стенкам лунки на дно, формируют небольшую плотную «пуговку». Некоторые антитела плохо агглютинируют эритроциты и для их выявления необходимо ставить реакцию непрямой агглютинации: в лунки добавляют другие антитела, которые соединяются с неагглютинирующими антителами, уже связавшимися с эритроцитами. С помощью реакции гемагглютинации можно определять и другие, не эритроцитарные антигены, ковалентно или нековалентно присоединенные к эритроцитам. Для того чтобы связать антиген с поверхностью эритроцитов (сенсибилизировать их), используют хлорид хрома, танниновую кислоту, глутаровый альдегид и ряд других химических агентов.
Реакция антиген-антитело ведет к образованию иммунных комплексов, которые связывают комплемент при его активации по классическому пути, и на этом основан один из количественных методов определения антигенов и антител (рис. 29.7). С помощью реакций гемагглютинации и связывания комплемента удается выявлять антитела, присутствующие в концентрации <1 мкг/мл.
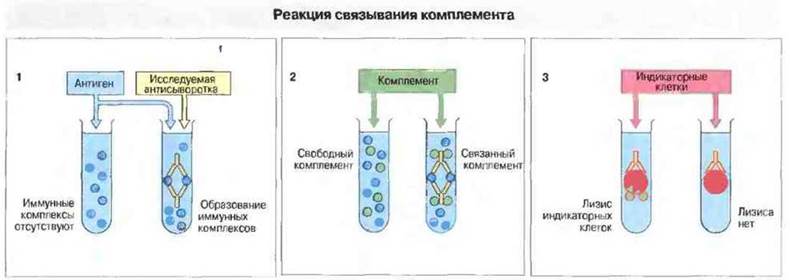
Рис. 29.7. Определение антител на основе реакции связывания комплемента. 1. Готовят последовательные двукратные разведения исследуемой сыворотки разливают их по пробиркам (или вносят в лунки) и в каждую добавляют фиксированное количество антигена. Если сыворотка содержит антитела, образуются иммунные комплексы. 2. К смеси добавляют комплемент. Если комплексы присутствуют, они связывают комплемент и «потребляют» его. 3. На конечном этапе постановки реакции в смесь вносят индикаторные клетки (эритроциты) вместе с субагглютинирующим количеством антиэритроцитарных антител. Если в смеси осталось какое-то количество комплемента, клетки будут лизированы; если же комплемент связан иммунными комплексами на этапе (2), его не хватит для лизиса эритроцитов. Применяют такое количество комплемента, которого как раз достаточно, чтобы лизировать индикаторные клетки при отсутствии потребления комплемента иммунными комплексами. Тест часто проводят на пластиковых планшетах. Данную реакцию можно также использовать для определения антигенов, применяя фиксированное количество антител и антиген в различных разведениях. В этом случае особое значение приобретает постановка соответствующих контролен, так как некоторые препараты антител потребляют комплемент еще до того, как добавлен антиген. Например, это может произойти в том случае, если сыворотка уже содержит иммунные комплексы. Некоторые антигены также обладают антикомплементарной активностью. Поэтому необходимы два контроля с внесением только антител и только антигена; ни тот, ни другой реагент не должен сам по себе связывать комплемент.
Прямая и непрямая иммунофлуоресценция
Иммунофлуоресцентные методы широко используются для обнаружения аутоантител и антител к тканевым и клеточным антигенам (рис. 29.8). Хотя эти методы технически более сложны, чем описанные выше, они имеют явное преимущество в тех случаях, когда требуется определить число видов антител. Используя срезы тканей (содержащих большое число антигенов), на одном предметном стекле можно выявить антитела к нескольким разным антигенам, установив при этом их внутритканевое (клеточное) или внутриклеточное распределение.
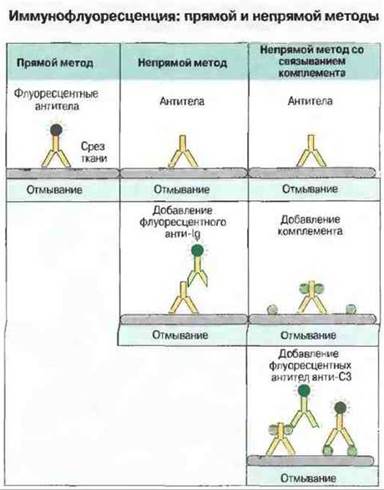
Рис. 29.8. Иммунофлуоресценцию используют с целью определения антигена in situ. Для этого готовят на криостате срезы из блока глубокозамороженной ткани. Такая процедура обеспечивает сохранность лабильных антигенов при воздействии фиксирующих агентов.
Прямой иммунофлуоресцентный метод. Раствор антител, меченных флуоресцентным красителем, наносят на поверхность среза; препарат инкубируют, после чего отмывают от избытка антител. Затем связавшиеся антитела выявляют при помощи флуоресцентного микроскопа. Пучок УФ-лучей, направленный на срез через объектив, позволяет видеть темное поле со светящимися зеленым цветом участками, где локализованы связанные антитела. Распределение флуоресценции на срезе имеет характерный вид для каждого тканевого антигена.
Непрямой иммунофлуоресцентный метод. Раствор немеченных антител наносят на срез, а затем выявляют их при помощи меченных флуорохромом антииммуноглобулиновых антител.
Непрямой иммунофлуоресцентный метод со связыванием комплемента. Этот вариант метода разработан для определения комплементсвязывающих антител (см. рис. 29.7). После обработки среза антителами на него наносят в качестве источника комплемента свежую сыворотку. Комплемент связывается в участках, где фиксированы антитела. В результате эффекта усиления при активации комплемента по классическому пути (см. гл. 5) одна молекула антител может вызвать связывание многих С3b-молекул на срезе; их выявляют, обрабатывая срез флуоресцентно меченными антителами анти-С3b.
Кроме того, с помощью иммунофлуоресцентных тестов можно идентифицировать отдельные клетки в клеточной суспензии, т. е. выявлять антигены на поверхности живых клеток. Для этой цели суспензию живых клеток, флуоресцентно окрашенных специфичными реагентами, пропускают через проточный флуоресцентный клеточный сортер — прибор, измеряющий интенсивность свечения каждой клетки в разных областях спектра и затем разделяющий клетки по параметрам свечения. Данный метод позволяет выделять различные клеточные популяции, т. е. разделять клетки, несущие специфические поверхностные антигены и соответственно этому окрашенные различными флуоресцентно меченными антителами (рис. 29.9). В гл. 13 приведены данные о том, как используется этот метод для определения субпопуляций развивающихся гимоцитов (см. рис. 13.19).
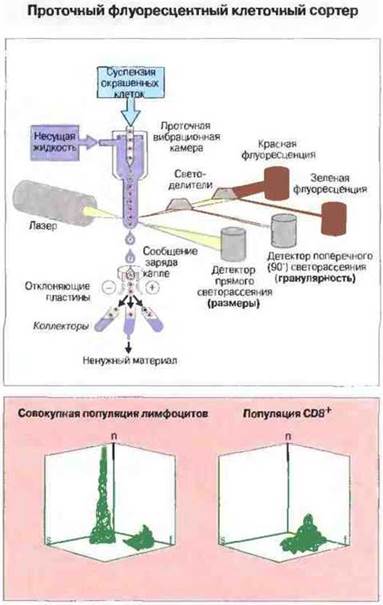
Рис. 29.9. Клетки в исследуемом образце окрашивают специфическими флуоресцентными реагентами для определения поверхностных молекул и вносят в проточную вибрационную камеру прибора. Выходящие из камеры клетки попадают в поток несущего буферного раствора. Клетки проходят через лазерный луч, и с помощью детекторов определяются размеры (детектор светорассеяния) и гранулярность (детектор света, расположенный под прямым углом к лазерному лучу) каждой клетки, а также цвет флуоресценции (красный и зеленый) соответственно двум разным поверхностным маркерам. Под влиянием вибрации поток жидкости, несущей клетки, разбивается на капли; им сообщается заряд, благодаря чему с помощью отклоняющих пластин (под контролем компьютера) можно получить раздельно различные клеточные популяции в соответствии с измеренными параметрами. На трехмерной диаграмме показаны размеры (s), число (n) и флуоресценция (f) лимфоцитов цельной клеточной популяции и популяции CD8+, полученных на клеточном сортере с использованием антител анти-СD8.
Иммунологический анализ антигенов и антител с помощью меченых реагентов
Методы этой категории отличаются очень высокой чувствительностью и экономичностью в расходовании реагентов (рис. 29.10). Наиболее распространенный из всех иммунологических методов - это, вероятно, иммуносорбентный анализ антител с применением лигандов, меченных радиоизотопами или ферментами (ELISA, рис. 29.11); он позволяет исследовать большое число образцов в относительно короткое время. (Вместо радиоактивных меток теперь все чаще применяют флуоресцентные или хемилюминесцентные маркеры.) Количество антигена можно измерять при помощи метода «двойной антигенной ловушки» или конкурентного иммуноанализа с применением любого маркера для определения (рис. 29.12).
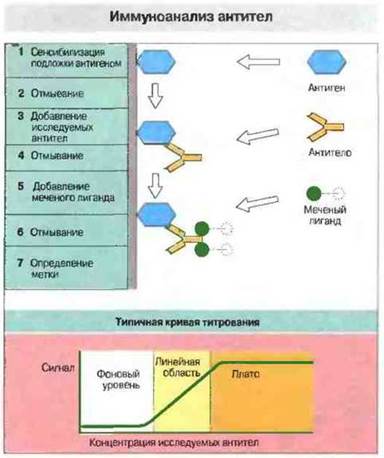
Рис. 29.10. Иммуноанализ антител. 1. Антиген в солевом растворе инкубируют на пластиковой подложке или в пробирках, в результате чего небольшое его количество адсорбируется на поверхности пластика. 2. Свободный антиген удаляют путем отмывания. (Подложку затем можно обработать избытком постороннего белка, чтобы предотвратить последующее неспецифическое связывание белков.) 3. Добавляют исследуемые антитела, которые связываются с антигеном. 4. Несвязавшиеся белки удаляют отмыванием. 5. Антитела определяют при помощи меченого лиганда. Лигандом может служить, например, стафилококковый белок А, который связывается с Fc-областью IgG; чаще используют другие антитела, специфичные по отношению к исследуемым антителам. Применяя лиганд, который связывается с антителами определенного класса или подкласса, можно дифференцировать изотипы антител. 6. Несвязанные антитела удаляют отмыванием. 7. Определяют связавшуюся метку. Типичная кривая титрования представлена внизу. С повышением количества антител интенсивность сигнала возрастает линейно от фонового значения до уровня плато. Титр антител можно определить правильно лишь в линейной области. Уровень плато, как правило, в 20-100 раз выше фонового. Чувствительность метода обычно составляет приблизительно 1-50 нг специфических антител в 1 мл. Специфичность метода можно проверить, добавив свободный тест-антиген в повышающихся концентрациях к исследуемым антителам на этапе (3). Антиген связывается с антителами и блокирует их соединение с антигеном, фиксированным на подложке. Добавление возрастающих количеств свободного антигена снижает интенсивность сигнала.
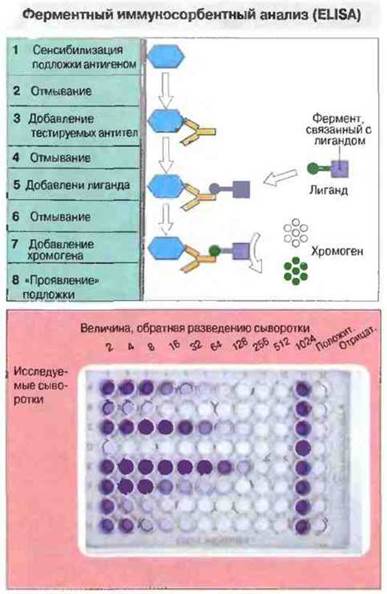
Рис. 29.11. Планшет (подложку) для проведения ELISA готовят точно так же, как для иммуноанализа антител (см. рис. 29.10) до этапа 4. В этой системе лигандом служит молекула, способная выявить антитела и ковалентно связанная с ферментом, например пероксидазой. Лиганд соединяется с тестируемыми антителами, и после предварительного удаления несвязавшегося лиганда отмыванием (6) связанный лиганд можно визуализировать путем добавления хромогена (7) - бесцветного субстрата, который под влиянием связанного с лигандом фермента превращается в окрашенный продукт реакции. Внизу - фотография «проявленного» планшета (8). Количество тестируемых антител определяют по содержанию окрашенного продукта реакции путем сканирования оптической плотности.
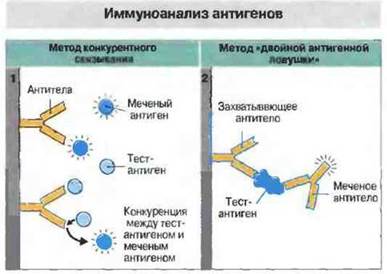
Рис. 29.12. 1. Конкурентный иммуноанализ. Исследуемый антиген вместе с меченым антигеном наносят на подложку, покрытую специфическими антителами. Чем больше исследуемого антигена содержит раствор, тем меньше количество связывающегося стандартного меченого антигена. Анализ этого типа часто используют для определения антигенов, присутствующих в относительно высоких концентрациях, или гормонов, которые имеют только один антигенсвязывающий центр. 2. Метод двойного захвата антигена. На подложку с фиксированными антителами наносят исследуемый раствор, и если в нем присутствует антиген, он захватывается антителами. После отмывания несвязавшегося материала определяют захваченный антиген при помощи меченых антител к другому эпитопу данного антигена. Поскольку антиген определяют с использованием антител двух разных типов, причем вторые добавляют в избытке, метод является высокоспецифичным и чувствительным.
Иммуноблоттинг и иммунопреципитация
Описанные выше методы обычно применяют для определения уровня конкретных известных антигенов и антител, однако часто необходимо идентифицировать и охарактеризовать не известные заранее антигены, содержащиеся в многокомпонентной смеси. Для этой цели особенно подходит иммуноблоттинг.
При проведении иммуноблоттинга сложную смесь антигенов вначале подвергают гель-электрофорезу, а затем фракционированные пептиды переносят (блоттинг) на лист нитроцеллюлозы для идентификации индивидуальных антигенов при помощи специфических антисывороток. Производя предварительное разделение в геле с додецилсульфатом натрия или в геле для изоэлектрического фокусирования можно получить данные о размерах и изоэлектрической точке исследуемых антигенов, а также о сходстве между ними (родстве) (рис. 29.13).
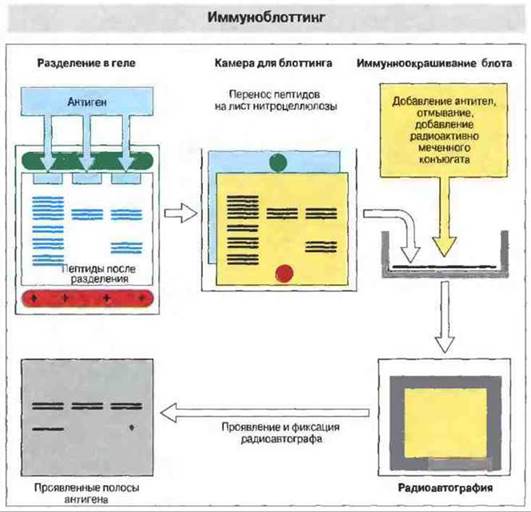
Рис. 29.13. Для проведения иммуноблоттинга исследуемые антигены сначала разделяют методом электрофореза в геле, например в полиакриламидном геле с додецилсульфатом натрия или в геле для изоэлектрического фокусирования. Полученные фракции переносят электрофоретически на лист нитроцеллюлозы (блот), помещенный в специальную камеру. Затем блоты обрабатывают антителами к специфическому антигену, отмывают и добавляют радиоактивно меченный конъюгат для определения связавшихся с антигеном антител. Принцип подобен тому, который используется в РИА или ELISA. После повторного отмывания лист нитроцеллюлозы помещают в кассету с рентгеновской пленкой для радиоавтографии; на проявленной пленке видны полосы локализации антигена, связавшего меченые антитела. Метод можно модифицировать, используя хемилюминесцентную метку или конъюгат антител с ферментом (как в ELISA), выявляющий связанный материал при нанесении непосредственно на нитроцеллюлозный лист вместе с хромогеном.
В некоторых случаях в результате электрофореза в геле и процедуры блоттинга антиген денатурирует так, что некоторые из его эпитопов разрушаются и теряют способность связываться со специфическими антителами. В такой ситуации вместо блоттинга следует использовать иммунопреципитацию, чтобы установить, какой антиген связывают антитела. Данный метод может быть применен для определения как растворимых, так и мембранных антигенов (рис. 29.14).
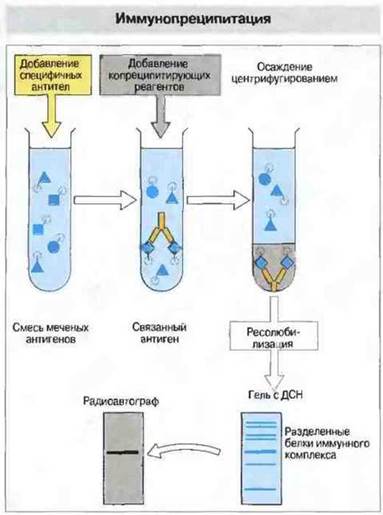
Рис. 29.14. При постановке реакции иммунопреципитации исследуемые антигены метят изотопом 131I и добавляют к ним антитела, связывающиеся только со специфическим антигеном. Комплексы преципитируют путем добавления копреципитирующих агентов, таких как антииммуноглобулиновые антитела или белок А стафилококков. Затем нерастворимые комплексы осаждают центрифугированием и осадок промывают до полного удаления несвязанных меченых антигенов. Преципитат ресолюбилизируют (например, в растворе додецилсульфата натрия) и затем разделяют компоненты методом гель-электрофореза. После промывания производят радиоавтографический анализ гелей для обнаружения специфического меченого антигена. Часто объекты исследования представляют собой поверхностные антигены радиоактивно меченных клеток и их предварительно солюбилизируют с помощью детергентов. Возможно также использовать в качестве метки биотин; определение проводят хроматографически, применяя для этой цели стрептавидин (белок, связывающий биотин), конъюгированный с ферментом, например с пероксидазой (ср. ELISA).
(ДСН - додецилсульфат натрия.)