Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Электрохимия белков. Взаимодействие белков с водой
Аминокислоты как диполи. Ионизация аминокислот
Аминокислоты являются амфотерными электролитами, содержащими как амино-, так и карбоксигруппы. Благодаря этому они могут образовывать соли и с кислотами, и с основаниями. В водных растворах они могут существовать либо в виде нейтральных молекул H2N—R—СООН, либо в виде диполей H3N—R—СОО-. Какая из этих форм соответствует действительности длительное время было неизвестно. Между тем установление истинной формы аминокислот имело большое значение как для понимания механизмов их взаимодействия с кислотами и щелочами, так и для определения констант диссоциации карбоксильных и аминогрупп.
Впервые предположение о дипольном строении аминокислот было высказано в 1916 г. Адамсом и несколько позже Бьеррумом. Это предположение не могло быть проверено непосредственно опытами по изучению электропроводности их растворов, ибо при нейтральном pH молекулы аминокислот не перемещались в электрическом поле. Доказательства дипольного строения аминокислот были получены на основе изучения диэлектрической постоянной их растворов, явления электрострикции, определения констант и теплот ионизации.
Хорошо известно, что при растворении в воде неполярных соединений ее диэлектрическая постоянная уменьшается. При растворении же аминокислот она увеличивается, причем это увеличение (диэлектрический инкремент) достигает 23—35%. Такое увеличение можно объяснить только дипольным строением молекул аминокислот. Это заключение хорошо подтверждается явлением электрострикции, т. е. значительным уменьшением парциального моляльного объема (см § 5) аминокислот по сравнению с объемом незаряженной изомерной молекулы. Уменьшение объема достигает порядка 13 см3/моль, если аминогруппа находится в a-положении к карбоксилу, и 15 см3/моль — если она находится в ß-положении. Явление электрострикции обусловлено ориентацией и плотной упаковкой части молекул воды вокруг ионных групп аминокислот и сопровождается уменьшением теплоемкости и сжимаемости растворов биполярных ионов.
Существенным подтверждением дипольного строения аминокислот явилось определение теплоты ионизации их карбоксильной и аминной групп. Напомним, что теплота ионизации определяется числом калорий на 1 моль, поглощенных при реакции ионизации в условиях постоянства температуры и давления. При соответствующих определениях было найдено, что теплота ионизации аминокислот в кислых растворах составляла в среднем около 0,5 ккал/моль и в щелочных растворах — около 11 — 12 ккал/моль. Эти величины очень близки к теплотам ионизации алифатических карбоновых кислот и аминов (в среднем 1 ккал/моль и 12 ккал/моль соответственно) и говорят о том, что кислота реагирует с карбоксильными группами аминокислот, а щелочь — с их основными группами.
Таким образом, ионы водорода реагируют не с Н2N-группой превращая ее в группу ![]() а с группой СОО-. И наоборот, гидроксильные ионы реагируют не с карбоксильной группой, а с группой
а с группой СОО-. И наоборот, гидроксильные ионы реагируют не с карбоксильной группой, а с группой ![]()
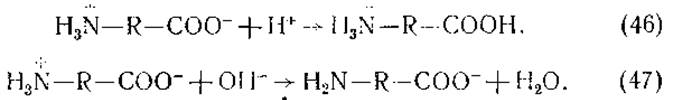
В результате аминокислоты в кислой среде находятся в виде катионов, а в щелочной — в виде анионов.
О том, что и твердые аминокислоты существуют, вероятнее всего, в форме диполей, свидетельствуют их значительная плотность и высокие точки плавления. Оба эти свойства указывают на сильное электростатическое притяжение между противоположно заряженными ионизированными группами смежных молекул, в результате чего их оказывается значительно труднее разделить, чем смежные нейтральные молекулы.
Новое представление о дипольном строении аминокислот позволило правильно рассчитать константы диссоциации, их кислых и основных групп. При расчете констант на основе старых уравнений получались величины, которые значительно отличались от постоянных диссоциации алифатических карбоновых кислот и аминов. Так, константа диссоциации для кислых групп была рассчитана равной ~10-9 и для аминогруппы — ~10-11, в то время как для уксусной кислоты она составляет 1,8 ∙ 10-5 и для этиламина 1,2 ∙ 10-13. Эти противоречия устраняются, если принять дипольную форму аминокислот.
Прежде чем перейти к рассмотрению диссоциации кислых и основных групп аминокислот, необходимо коротко остановиться на теории кислот и оснований Брёнстеда и на понятии константы диссоциации? Согласно Бренстеду, кислотой называются все те вещества, которые способны отдать протон, а основанием — все те, что способны его связать. С этой точки зрения ионизацию простой кислоты и константу диссоциации можно выразить следующим образом:
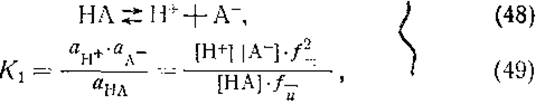
где НА — кислота, А- — основание, К1 — константа диссоциации кислоты, а — активности,![]() — коэффициенты активности ионов и
— коэффициенты активности ионов и![]() — коэффициент активности недиссоциированной кислоты. В случае разбавленных растворов коэффициенты активности близки к единице и активности кислоты, основания и ионов водорода заменяются их молярными концентрациями. Логарифмируя обе части уравнения (49), получим
— коэффициент активности недиссоциированной кислоты. В случае разбавленных растворов коэффициенты активности близки к единице и активности кислоты, основания и ионов водорода заменяются их молярными концентрациями. Логарифмируя обе части уравнения (49), получим
![]()
где pН = — lg [Н+] и pK1 = — lgK1.
При термодинамическом равновесии концентрации обеих форм слабой кислоты будут равны, т. е. концентрация донора протонов НА будет равна концентрации акцептора протонов А-. В этих условиях константа диссоциации кислоты будет равна концентрации ионов водорода, которая и будет мерой диссоциации кислоты, а величина рК1 будет соответственно равна pH раствора:
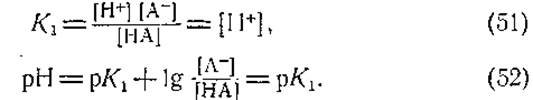
Говоря иными словами, константа диссоциации кислоты указывает нам ту концентрацию протонов, при которой отношение концентраций обеих форм кислоты равно единице, т. е. рК1 равно тому pH. при котором 50% кислоты находится в диссоциированной и 50%—в недиссоциированной форме.
При рассмотрении аминокислот с точки зрения теории Брёнстеда группы СООН и H3N следует считать кислотами, а группы СОО- и H2N — основаниями. Соответственно ионизацию карбоксильной и аминной групп и константы диссоциации этих групп (К1 и К2) можно выразить следующими уравнениями:
![]()
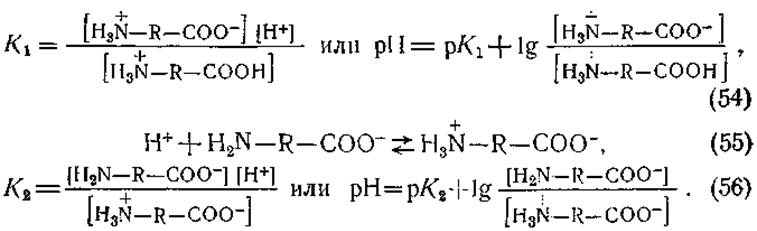
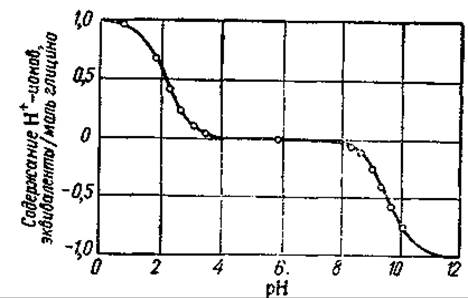
Рас. 42. Кривая диссоциации глицина (по Майстеру, 1961).
Исходя из вышеизложенного, можно заключить, что константы диссоциации К1 или К2 (показатели рК1 или рК2) численно равны концентрации водородных ионов (значениям pH), при которой отношение
![]()
![]()
равно единице, т. е.
50% аминокислоты находится в виде диполей, а 50% — в виде катионов или анионов. Для основной массы аминокислот величины К1 и К2 рассчитанные из уравнений (53) — (56), оказались равными приблизительно 10-2—10-3 и 10-9—10-10 соответственно (рК1 приблизительно равно 2—3 и рК0 —9—10). Более высокие значения К1 по сравнению с константой ионизации уксусной кислоты (1,8∙10-5) обусловлены присутствием группы NH3, усиливающей ионизацию карбоксильной группы. Точные значения этих постоянных, равно как и значения констант диссоциации боковых групп (рК3) даются в табл. 6) Величины рК1 и Кр2 можно определить с помощью этектрометрического титрования. Кривая титрования глицина соляной кислотой и едким натром представлена на рис. 42. Видно, что в точке, соответствующей pH 2,34, одна молекула кислоты отдает 0,5 эквивалента ионов водорода. Следовательно, в этой точке мы имеем 50% аминокислоты в виде диполя и 50% —в виде катиона, и рK1 для глицина равен 2,34. В точке, соответствующей pH 9,6, аминокислота поглощает 0,5 эквивалента ионов Н+; здесь 50% аминокислоты находится в виде аниона (МН2—R—СОО-) и 50% —в виде диполя, т. е. рК2 = 9,6. Таким образом, значения р/С будут равны тому значению pH, которое на кривой титрования соответствует 0,5 эквивалента кислоты или щелочи, связываемого одной молекулой аминокислоты.
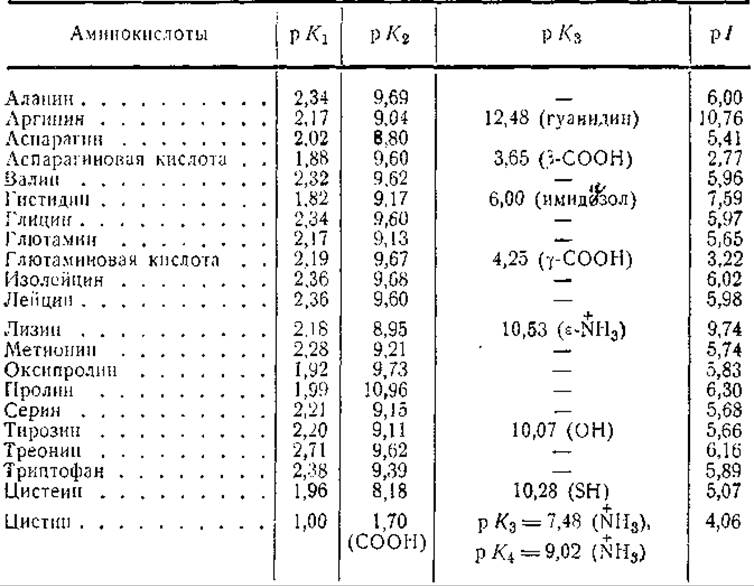
Таблица 6 Значения констант диссоциации и изоэлектрической точки аминокислот, обычно встречающихся в белках
Кривые диссоциации тех аминокислот, молекулы которых содержат более двух диссоциирующих групп, имеют дополнительные точки перегиба. Например, для гистидина имеются перегибы не только при pH 1,82 (pK1) и pH 9,17 (рК2), но и при pH 6,0 (рK3, имидазол).
Изоэлектрической точкой аминокислоты (рI) называется то значение pH, при котором молекула электронейтральна; при этом значении не происходит передвижения аминокислоты в электрическом поле. Изоэлектрическую точку для моноаминомонокарбоновых кислот можно найти путем деления суммы pK1 и рК2 на 2. Если бы степень ионизации карбоксильной и аминогруппы была одинакова, то изоточка моноаминомонокарбоновых аминокислот лежала бы в нейтральной среде. Но так как ионизация карбоксильной группы оказывается выше, чем ионизация аминогруппы, то эти кислоты являются слабокислыми веществами, изоэлектрическая точка которых лежит около pH 6,0. У дикарбоновых кислот и диаминокислот изоэлектрические точки лежат соответственно в кислой и щелочной среде, точные значения рI для отдельных аминокислот даны в табл 6.