Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Электрохимия белков. Взаимодействие белков с водой
Ионизация белка. Соединение с водородными ионами
Основой молекулярной структуры всех белков являются полипептидные цепи, в которых а-аминогруппы и а-карбоксильные группы различных аминокислот соединены пептидными связями. Поэтому все а-карбоксильные и а-аминогруппы, за исключением концевых групп, не могут ионизироваться при обычных условиях, и их нельзя рассматривать как кислотные или основные группы. Ионизируемые группы белков содержатся преимущественно в боковых цепях остатков трехвалентных аминокислот, к ним относятся β- й у-карбоксильные группы глютаминовой и аспарагиновой кислот, не связанные в амидах, имидозольная группа гистидина, ε-аминогруппа лизина, гуанидиновая группа аргинина, фенольная группа тирозина и сульфгидрильная группа цистеина. Эти ионогенные группы боковых цепей и представляют собой главную причину появления электрического заряда на поверхности белковой молекулы. В зависимости от pH окружающей среды протоны присоединяются к боковым группам или отщепляются от них, в результате чего меняются состояние ионизационного равновесия этих групп и знак заряда белковой молекулы (значения рК для отдельных боковых групп белков довольно близки к значениям рК3, представленным в табл. 6). А так как соотношения этих группировок различны для разных белков, то и изоэлектрические точки этих белков будут соответствовать различным значениям pH. Подчеркнем, что под изоэлектрической точкой белковой молекулы обычно понимают то значение pH, при котором ее средний свободный (эффективный) заряд равен нулю.
Изоэлектрическую точку белка не следует смешивать с его изоионной точкой, поскольку эти величины не всегда совпадают. Изоионной точкой белка называется то значение pH, при котором число протонов, связанных основными группами, равно числу протонов, отданных диссоциированными кислыми группами в белковой молекуле. Изоэлектрическая и изоионная точки белка совпадают только в том случае, когда в растворе этого белка нет никаких других ионов, кроме ионов водорода и гидроксила. В присутствии других анионов и катионов они различны. Для пояснения этого положения рассмотрим тот случай, когда белок находится в растворе, pH которого равен изоточке белка и который не содержит никаких других ионов, кроме Н+ и ОН-.
В этом случае число протонов, освобожденных при диссоциации кислых групп СООН и NH3, будет равно числу протонов, связанных основными группами СОО- и NH2, т. е. изоэлектрические и изоионные точки белка совпадают. При добавлении к такому раствору хлористого натрия будет происходить связывание небольшого количества анионов Сl- кислыми группами![]() и катионов Na+ основными группами СОО-, что вызовет дополнительную диссоциацию группы СООН и уменьшение диссоциации группы NH3.
и катионов Na+ основными группами СОО-, что вызовет дополнительную диссоциацию группы СООН и уменьшение диссоциации группы NH3.
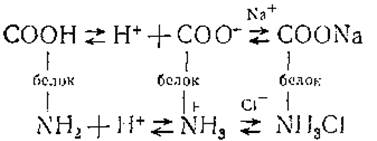
Если бы связывание анионов кислыми группами происходило так же интенсивно, как связывание катионов основными, то уменьшение числа протонов, отщепляемых группой ![]() компенсировалось бы за счет повышенной диссоциации карбоксильной группы. В результате изоионное состояние сохранялось бы. Однако связывание анионов Сl- идет интенсивнее, чем катионов Na+, благодаря чему изоиония нарушается и общее число протонов уменьшается.
компенсировалось бы за счет повышенной диссоциации карбоксильной группы. В результате изоионное состояние сохранялось бы. Однако связывание анионов Сl- идет интенсивнее, чем катионов Na+, благодаря чему изоиония нарушается и общее число протонов уменьшается.
Для восстановления изоионного состояния необходимо еще более понизить концентрацию протонов, т. е. подщелочить раствор, чтобы увеличить диссоциацию карбоксильной группы. Правда, часть диссоциированных протонов будет связываться основными группами NH2, что приведет к увеличению числа групп ![]()
Однако реакция ионизации карбоксильной группы идет быстрее, чем реакция связывания протонов, благодаря чему и происходит восстановление изоионного состояния. Таким образом, относительно более быстрое связывание анионов белком при соответствующем замедлении связывания протонов и являются причиной повышения изоионной точки белка в присутствии солей. Показано, например, что изоионная точка серумальбумина в присутствии 0,15 М хлористого натрия повышалась от pH 4,8—4,9 до 4,27, причем это изменение возрастало с увеличением концентрации белка. Влияние солей натрия на изоионную точку сывороточного альбумина представлено на рис. 43.
Приведенное выше определение изоионной точки не указывает на способ экспериментального измерения соответствующих pH. Изоионные точки белков могут быть определены различными методами. Наиболее употребительный из них состоит в следующем Раствор белка подвергают тщательному электродиализу, с помощью которого из него удаляют все ионы электролитов, кроме ионов водорода и гидроксила. Белок, полученный из такого раствора, можно считать изоионным веществом. При растворении его в воде он задает раствору определенный pH, который и можно считать его изоионной точкой. Таким образом, одним из экспериментально обоснованных определений изоионной точки может быть следующее: изоионная точка — это pH раствора изоионного вещества в воде.
Что же касается изоэлектрической точки, то, согласно ряду экспериментальных приемов, используемых для ее оценки, она может быть определена как то значение pH, при котором электрофоретическая подвижность белка равна нулю. Растворимость, мембранный потенциал и осмотическое давление при этом имеют минимальное значение, а вязкость и диэлектрическая постоянная раствора — максимальное.
Итак, электрический заряд на поверхности белковой молекулы и ее изоэлектрическая точка определяются ионогенными группами боковых цепей аминокислот, ибо в зависимости от pH окружающей среды эти группы способны либо присоединять протоны, либо отдавать их. Количество этих группировок и их тип могут быть определены с помощью электрометрического титрования, кривые которого показывают зависимость числа связанных белком протонов от pH окружающей среды. Однако необходимо сразу же заметить, что в белковой молекуле может содержаться очень большое число титруемых групп, в силу чего перекрывание областей ионизации различных групп может быть значительным. Это, естественно, затрудняет вычисление точного количества данного вида групп по кривой титрования, равно как и дифференцирование количества а-карбоксильных групп белков от β- и у-карбоксильных групп дикарбоновых кислот, так же как и концевых а-аминогрупп от гуанидиновых групп гистидина.
Электрометрическое титрование производится при добавлении к изоионному раствору белка сильных кислот, обычно соляной кислоты, или сильных оснований, например едкого натра. Величину pH титруемого раствора измеряют непосредственно, число связанных протонов и гидроксильных ионов необходимо вычислять по специальным формулам, учитывающим количество изоионного белка (g в граммах) и количество протонов (гидроксильных ионов) в исходном растворе кислоты (щелочи) и после сдвига pH раствора от pH1 до рН2 (соответственно C1 и С2 в моль/л):
![]()
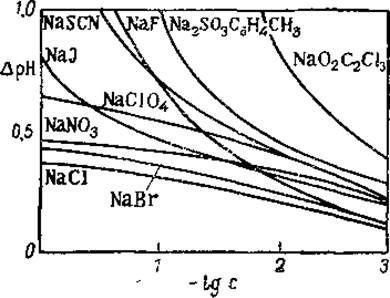
Рис. 43. Влияние натриевых солей на изоионную точку сывороточного альбумина человека (из Нейрата и Бэйли, 1956).
Ветвь кривой титрования в кислой области рассматривают как функцию связывания водородных ионов, а ветвь кривой в щелочной области — как функцию связывания гидроксильных ионов. В действительности гидроксильные ионы взаимодействуют не с белком, а с отщепленными от него протонами, образуя молекулы воды. Таким образом, восходящая ветвь кривой дает возможность рассчитать общее число боковых и а-карбоксильных групп, тогда как нисходящая ветвь — общее число основных групп. На рис. 44 представлена кривая потенциометрического титрования яичного альбумина.
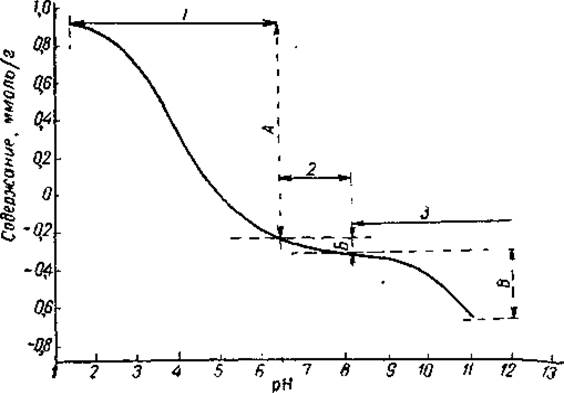
Рис. 44. Потенциометрическое титрование яичного альбумина в воде (по Кенчингтону, 1963).
Интервалы титрования: 1 — карбоксильных групп, 2 — имидазольных и а-аминогрупп, 3 — ε-аминогрупп, ОН-групп тирозина и SH-групп цистеина; содержание: А — карбоксильных групп, В — имидазольных и а-аминогрупп, В — ε-аминогрупп, OН-групп тирозина и SH-групп цистеина.
При рассмотрении кривой титрования яичного альбумина видно, что она имеет отчетливо выраженные точки перегиба при pH 3—4 и 9—10, возникающие в результате буферного действия карбоксильных и аминогрупп, и разделена на ряд участков, или интервалов титрования. Каждый интервал соответствует области ионизации определенных боковых групп белка, что позволяет рассчитать число этих групп по количеству протонов, связанных или отданных на данном участке титрования. Так, титрование от pH ~ 6,5 до точки максимального связывания протонов (pН порядка 1,5) обусловлено свободными карбоксильными группами аспарагиновой и глютаминовой кислот и а-карбоксильными группами. Поэтому общее число карбоксильных групп будет равно числу эквивалентов кислоты, необходимых для титрования от pH около 6,5 до pH 1,5. В растворах высокой ионной силы максимальное связывание протонов происходит уже при pH 2—2,5. Метод потенциометрического титрования не позволяет также определить группы CОNH2, присутствующие в боковых цепочках.
Титрование от pH 8,5 до pH 6,5 обусловлено взаимодействием протонов с имидазольными группами гистидина и с концевыми а-аминогруппами, которые присутствуют в белке в небольшом количестве. Общее число этих групп будет соответственно равно числу эквивалентов кислоты, необходимых для титрования в этой области pH. И, наконец, общее число ε-аминогрупп лизина, гидроксильных групп тирозина и сульфгидрильных групп цистеина равно числу эквивалентов основания, необходимых для титрования от pH 8,5 до pH 11 —12. Аргинин при титровании непосредственно не определяется, так как константа диссоциации гуанидиновой группы настолько высока (рК3 несколько выше 13), что эта группа при любом значении pH, допускающем точные измерения, не может в заметном количестве перейти в ионизированную форму. Поэтому максимальное связывание основания белком нельзя определить достаточно точно.
Из данных титрования от изоионной точки до точки максимального связывания протонов вблизи pH 1,5 можно определить содержание основных групп (имидазольных, аминных и гуанидиновых) независимо от того, какие группы действительно играют роль в процессах ионного равновесия. На первый взгляд, кажется непонятным, что общее число основных групп определяется титрованием в кислой области pH. Для пояснения этого необходимо вернуться к определению изоионной точки белка. Как уже говорилось выше, изоионная точка белка соответствует тому значению pH, при котором число протонов, освобождаемых кислотными группами белковой молекулы, равно числу протонов, связываемых ее основными группами. Это означает, что в изоионной точке число протонов, освобождаемых молекулой белка, равно максимальному заряду, который может получить белок за счет максимального связывания протонов. Поскольку же при pH максимального поглощения кислоты (pH максимального связывания протонов) все азотсодержащие группы несут положительный заряд, тогда как все другие группы являются незаряженными, постольку заряд белковой молекулы максимален и число азотсодержащих групп может быть определено по количеству связанной кислоты. Иными словами, общее число основных групп равно числу эквивалентов кислоты, необходимых для титрования от изоионной точки до pH 1,5.
Результаты электрометрического титрования для многих белков достаточно хорошо совпадают с результатами химического определения аминокислотного состава. Так, общее число анионных и катионных групп, определенное электрометрически в яичном и сывороточном альбуминах и лактоальбумине, почти совпадало с числом кислых и основных аминокислот, найденных при соответствующем химическом анализе. В других белках, однако, как, например, в инсулине, был обнаружен большой избыток групп, титруемых в щелочной области. Последнее может быть объяснено лишь наличием в инсулине большого числа конечных а-аминогрупп.
В заключение необходимо отметить, что при интерпретации кривых титрования белков возникает ряд трудностей, зависящих от целого ряда обстоятельств. Так, белки содержат очень большое число ионогенных групп, связывающих и отдающих протоны. Кривые титрования показывают, что на 1 г белка требуется около 1 ммоля кислоты и 1 ммоля, основания. При молекулярном весе белка порядка 100 000 на одну белковую молекулу приходится, следовательно, около 100 кислых и 100 основных групп. Однако точно установить число тех или иных основных групп затруднительно, поскольку на кривой титрования имеется некоторое перекрывание в области pH между 8 и 12. Следовательно, pH 8,5 принимается в качестве конечной точки нейтрализации а-аминогрупп и имидазольных групп до некоторой степени произвольно. Па характере кривой титрования сказывается и взаимодействие белков с другими ионами, кроме водородных. В частности, белки образуют прочные связи с такими двухвалентными ионами, как ионы кальция, магния, фосфата и карбоната, а также одновалентными ионами хлора. Как уже говорилось, такое взаимодействие приводит к сдвигу изоионной точки и изменению электрохимических свойств белка за счет нейтрализации ионогенных групп, что приводит к искажению кривой титрования. Сдвиг изоионной точки особенно велик тогда, когда в растворе находятся ноны фосфатов, которые наиболее прочно связываются основными группами.
Говоря о нейтрализации боковых групп, необходимо помнить, что этот процесс может быть обусловлен не только взаимодействием с неорганическими ионами, но и взаимодействием между самими белковыми молекулами. Между положительными и отрицательными группами соседних молекул могут возникать электростатические (солеобразные) связи, в силу чего белковые молекулы могут образовать агрегат. Это взаимодействие не только затрудняет интерпретацию кривых титрования, но часто делает невозможным получение изоионного раствора белка методом электродиализа, поскольку здесь происходит удаление нейтральных солей, необходимых для предотвращения агрегации и осаждения белка.
Наконец, значительная трудность получения кривых титрования ряда белков связана с их лабильностью. Некоторые белки денатурируются при pH выше 2 или ниже 11, вследствие чего точное определение ионизации нативных белков в этих областях становится невозможным. Для преодоления этой трудности титрование ведут при низких температурах или берут серию проб изоионного раствора белка, в каждую из которых добавляют определенное, все возрастающее от пробы к пробе количество кислоты или щелочи. После добавления кислоты (щелочи) немедленно замеряют pH. Поскольку нейтрализация ионизированных групп происходит мгновенно, а денатурация наступает несколько позже, то этим приемом удается отделить друг от друга обе реакции. На основании полученных значений pH для каждой точки можно построить кривую титрования данного белка и рассчитать число ионизированных групп в денатурационных областях pH.