Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Ферменты - биологические катализаторы
Факторы, влияющие на действие ферментов
Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (pH); температура; присутствие активаторов и ингибиторов.
Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата (рис. 38, а). В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов.
При постоянной концентрации фермента скорость ферментативной реакции повышается с увеличением концентрации субстрата до насыщения фермента субстратом, достигает максимальной величины (Vmax) и далее не увеличивается (рис. 38, б). Каждая ферментативная реакция характеризуется константой Михаэлиса (Кm), определяемой как концентрация субстрата, при которой скорость ферментативной реакции составляет половину максимальной. Величины Vmax и Кm используют для характеристики каталитической способности ферментов.
Активная реакция среды. Каждый фермент имеет узкий диапазон значений pH, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях pH, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные ферменты проявляют высокую активность в сильно кислой среде, например пепсин (pH 2,0), сахараза (pH 4,5), или щелочной среде, например трипсин (pH 8,0), липаза (pH 9,0), аргиназа (pH 9,7).
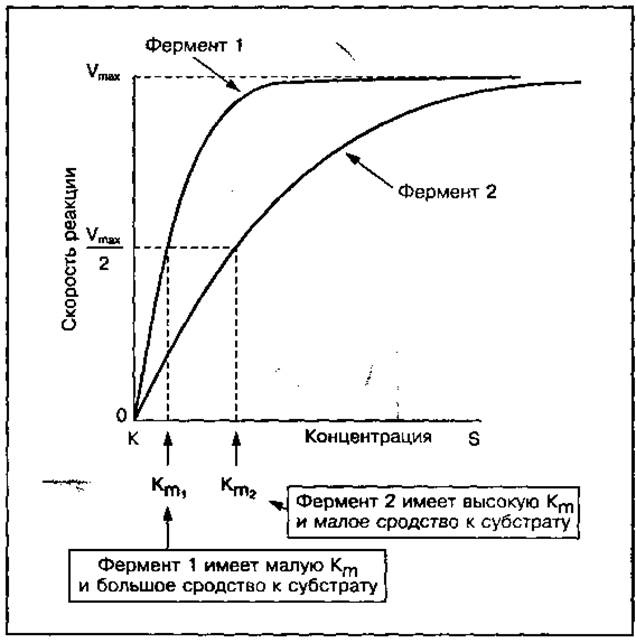
Рис. 38 Влияние концентрации субстрата на активность ферментов
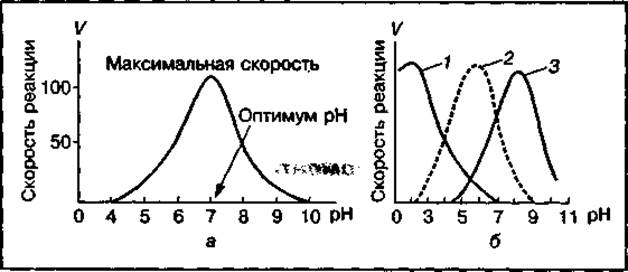
Рис. 39 Влияние pH на активность ферментов (а); оптимум pH (б) для ферментов пепсина (1), трипсина (2) и щелочной фосфатазы (3)
Влияние pH среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н+ или гидроксилов (ОН-), что в первую очередь влияет на структуру активного центра фермента.
В организме человека в состоянии относительного покоя диапазон колебаний pH незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливается молочная кислота, способная закислять среду и снижать активность многих ферментов.
Температура. При повышении температуры от 0 до 40 °С активность ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37—40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации.
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение.
В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg2+, Zn2+, Mn2+, Со2+, Cu2+, Fe2+, Са2+. Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn2+, креатинкиназа — ионами Мg2+; АТФ-аза миозина мышц активируется ионами Са2+, для каталитической активности ферментов дыхательной цепи необходимы ионы Сu2+ и Fe2+.
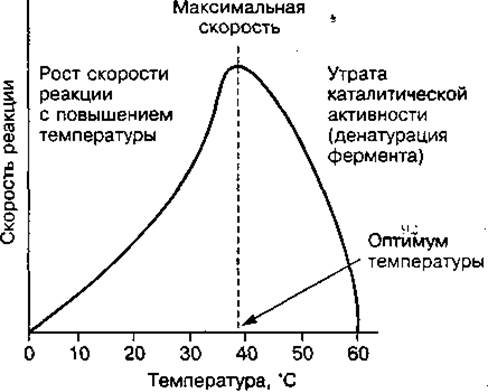
Рис. 40 Влияние температуры на активность ферментов
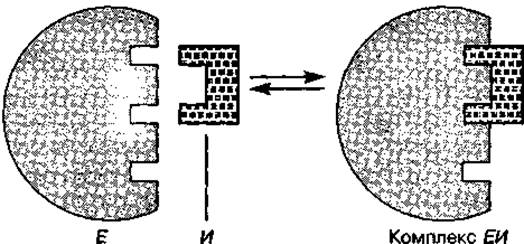
Рис. 41 Схема действия конкурентного ингибитора
Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCl активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами.
В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру.
Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. Как видно из рис. 41, в случае конкурентного торможения ингибитор (И) присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны.
Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.