Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Интеграция и регуляция обмена веществ - биохимическая основа процессов адаптации
Регуляторные системы обмена веществ и их роль в адаптации организма к физическим нагрузкам
Скорость обмена веществ в организме человека определяется наследственными факторами и регулируется разными регуляторными системами. Выделяют три основные системы регуляции обмена веществ: внутриклеточную (авторегуляция), гормональную и нервную (рис. 103). Под их воздействием изменяется количество и активность ферментов, коферментов, субстратов, что обеспечивает необходимую скорость и направленность биохимических процессов. Эти системы управляют механизмами общей адаптации организма к физическим нагрузкам и другим воздействиям, а также адаптивной перестройкой метаболизма при систематическом воздействии физических нагрузок (тренировке).
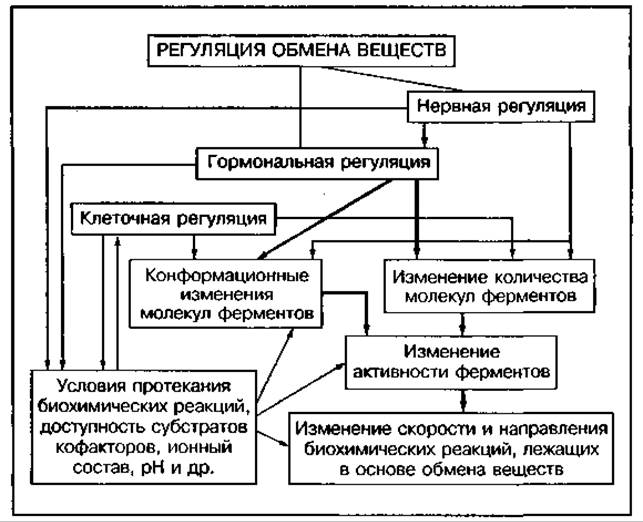
Рис. 103 Схема регуляции обмена веществ
Внутриклеточная система регуляции
Обмен веществ на клеточном и субклеточном уровнях регулируется прежде всего путем изменения активности имеющихся в клетках ферментов или изменения их количества.
Регуляция активности ферментов. На активность ферментов могут влиять многие факторы, в частности концентрация субстрата и кофермента, наличие активаторов и ингибиторов, величина pH среды, температура, водная среда, состояние биологических мембран, химическая модификация структуры фермента путем фосфорилирования, протеолизом и др. Наиболее простым регуляторным воздействием является концентрация субстрата и кофермента. Если фермент функционирует в области полунасыщения субстрата, то даже незначительные изменения в его концентрации могут привести к существенному изменению скорости биохимической реакции. Изменение концентрации коферментов НАД, НАДФ, ФАД, КоА и др., а также витаминов, входящих в их состав, тоже влияет на скорость ферментативных реакций. Многообразие ферментативных процессов, скорость которых зависит от наличия витаминов, показано на рис. 104.
Быстрой и "тонкой" регуляцией является так называемая аллостерическая регуляция активности фермента посредством веществ, воздействующих на аллостерический центр фермента и изменяющих их конформацию. Как правило, такой фермент расположен в начале метаболического пути. Однако он может ингибироваться конечным продуктом данного обмена при его накоплении или несколькими метаболитами — его аллостерическими регуляторами. Примером может служить ключевой фермент гликолиза — фосфофруктокиназа (ФФК), имеющий около 10 аллостерических регуляторов, от взаимодействия с которыми изменяется его активность. Это такие вещества, как АТФ, АДФ, АМФ, Фн, лимонная кислота, жирные кислоты, а также pH и другие факторы. В состоянии относительного покоя ФФК в скелетных мышцах не активна, так как ингибируется высокими концентрациями АТФ и лимонной кислоты. При интенсивной мышечной деятельности концентрация АТФ снижается, а концентрация АДФ и АМФ повышается. Это активирует ФФК и скорость гликолиза. Когда же баланс АТФ в мышцах восстанавливается, что происходит при улучшении снабжения кислородом, активность ФФК снижается и скорость гликолиза падает. Мышцы переключаются на аэробный механизм энергообразования с постепенным переходом на утилизацию жиров.
Одним из распространенных способов регуляции активности ферментов являются модификации молекул ферментного белка путем фосфорилирования — дефосфорилирования, протеолизного отщепления части белка либо другими воздействиями. Путем фосфорилирования с участием АТФ и Мg2+, а также дефосфорилирования, катализируемого ферментами (фосфатазой), регулируется активность тканевых липаз, расщепляющих нейтральные жиры, и фосфорилазы, расщепляющей гликоген (рис. 105). Часто процессы фосфорилирования — дефосфорилирования ферментов в цитоплазме клеток связаны с процессами гормональной регуляции посредством цАМФ, Са2+ или других передатчиков действия гормона.
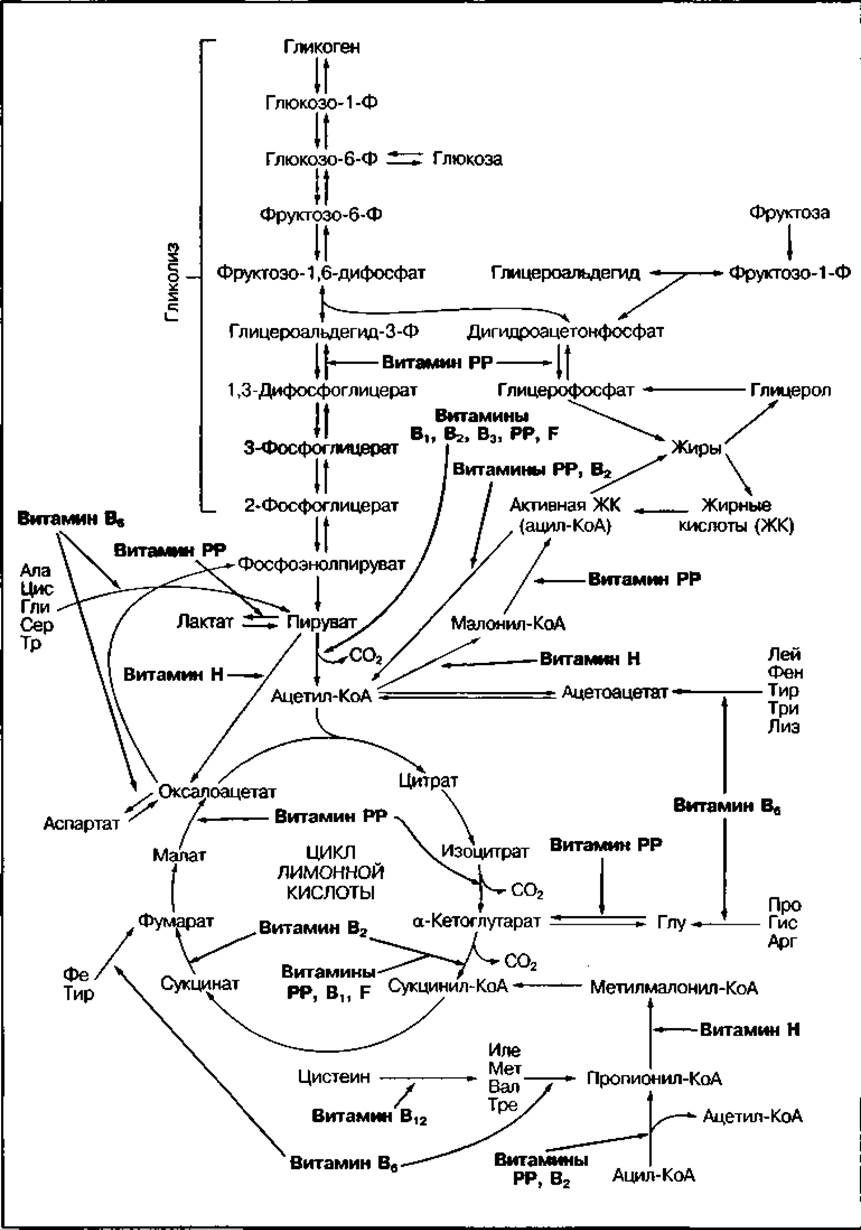
Рис. 104 Влияние водорастворимых витаминов на метаболизм углеводов, жиров и аминокислот
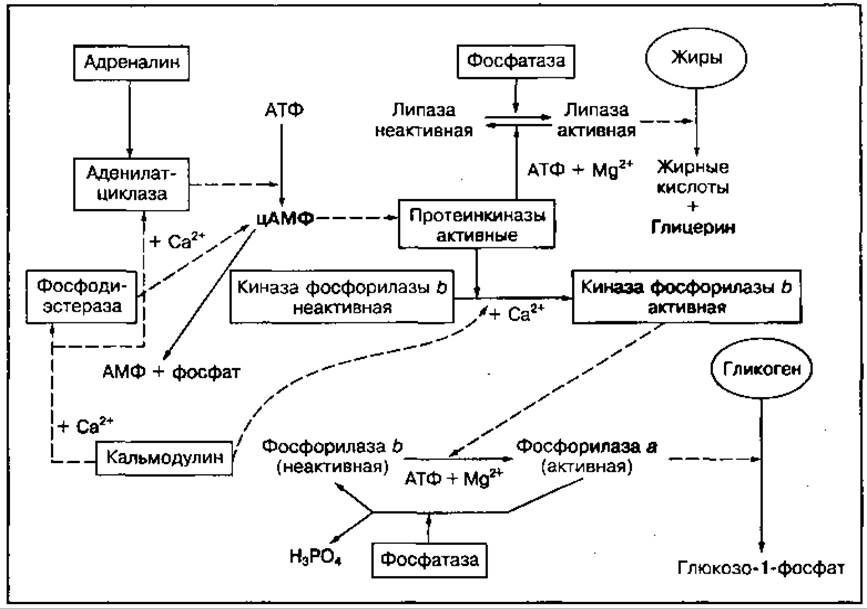
Рис. 105 Регуляция активности ферментов углеводного и липидного обмена при участии цАМФ-зависимого фосфорилирования их молекул
Рассмотренные механизмы регуляции активности ферментов способны изменять скорость обменных процессов очень быстро — в течение нескольких секунд или минут и относятся к механизмам срочной регуляции метаболизма. Они активируют энергетические и другие процессы при мышечной деятельности.
Регуляция синтеза ферментов. В живых клетках на уровне генетического аппарата запрограммировано относительное постоянство количества белков, в том числе так называемых конституционных ферментов. Однако при изменении питания, длительном голодании, спортивных тренировках количество отдельных белков изменяется. Существует адаптивный контроль биосинтеза белка на уровне отдельных генов, вызывающий индукцию (усиление) или репрессию (уменьшение) скорости синтеза РНК. Индукторами или репрессорами могут быть субстраты ферментов либо продукты данной реакции. Индукция синтеза определенного фермента приводит к его накоплению при увеличении концентрации его субстрата либо при необходимости усиления скорости его обмена. Репрессия происходит в случаях, когда отсутствует субстрат и фермент уже не нужен или когда клетка экономит свои энергетические ресурсы.
Регуляция синтеза ферментов на уровне генетического аппарата клетки может привести к увеличению или уменьшению количества фермента, изменению ферментного состава в клетке, появлению новых изоформфермента. Такая регуляция осуществляется сравнительно медленно — от нескольких часов до нескольких дней и рассматривается как "грубая" регуляция обмена веществ. Она играет основную роль в долговременной адаптации метаболизма организма к физическим нагрузкам.
Многие наследственные нарушения метаболизма связаны с изменением генов (мутации), кодирующих синтез ферментов, или системы адаптивного контроля. Это приводит к изменению количества и активности фермента, что вызывает изменение скорости обменных реакций, накопление продукта обмена или субстрата и развитие определенного заболевания.
В процессе приспособления организма к различным факторам среды, при заболеваниях изменяется регуляция изоферментного спектра отдельных ферментов. Появление новых изоформ фермента может служить диагностическим показателем адаптационных изменений на уровне процессов синтеза белка или развития определенного заболевания.
На процессы биосинтеза ферментов на генетическом уровне, кроме субстратов, влияют многие метаболиты и гормоны. В индукции адаптивного синтеза белка при мышечной деятельности и тренировке большую роль играет дефицит АТФ и креатинфосфата, а также такие гормоны, как глюкокортикостероиды, тироксин, инсулин, соматотропин и андрогены, которым свойственно приспособительное анаболическое действие. Как показано в работах А.А. Виру и др., регуляторное воздействие этих гормонов на активность генома и процессы синтеза белка лежит в основе обеспечения перехода срочных адаптивных реакций в организме спортсмена в долговременную адаптацию.
Гормональная регуляция
Обмен веществ регулируется гормонами, которые выделяются в кровь эндокринными железами. Участие отдельных гормонов в регуляции метаболизма рассмотрено в главе 8. Остановимся более подробно на общих закономерностях гормональной регуляции адаптационной перестройки обмена веществ при мышечной деятельности.
Эндокринная железа отвечает на различные воздействия увеличением или снижением выброса гормонов в кровь относительно его стационарного уровня:
При мышечной деятельности уровень отдельных гормонов может изменяться разнонаправленно в зависимости от интенсивности физических нагрузок и функционального состояния организма. При напряженной мышечной деятельности активность многих эндокринных желез увеличивается, особенно тех, гормоны которых регулируют мобилизацию, окисление и восстановление энергетических источников. В результате повышается концентрация норадреналина и адреналина (в 5—10 раз активнее норадреналина), глюкагона, глюкокортикостероидов и соматотропного гормона в крови. Однако концентрация инсулина чаще всего снижается. Указанные гормоны участвуют в регуляции концентрации глюкозы в крови следующим образом:
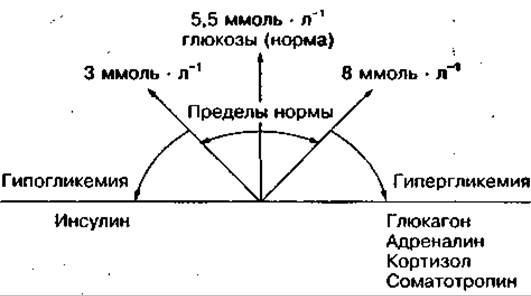
Снижение концентрации инсулина при физических нагрузках уменьшает поступление глюкозы в ткани и способствует увеличению ее уровня в крови, а повышение концентрации гормонов — антагонистов инсулина (глюкагона, адреналина, кортизола, соматотропина) увеличивает уровень глюкозы за счет мобилизации ее из печени или активации глюконеогенеза. Изменение соотношения этих гормонов влияет на метаболические процессы в работающих мышцах и других тканях.
Согласно теории Г. Селье, в адаптации организма к стрессовым факторам, в том числе к напряженной физической нагрузке, наиболее важную роль играют гормоны гипофиза и надпочечников. Развитие так называемого общего адаптационного синдрома контролируется гипоталамусом. Гипоталамус интегрирует информацию, полученную из всех частей тела, в том числе иЦНС, и запускает гормональный механизм поддержания относительного метаболического гомеостаза (рис. 106). В первую очередь усиливается секреция катехоламинов адреналина и норадреналина мозговым слоем надпочечников. Они активируют распад гликогена в печени и повышают уровень глюкозы в крови, а также распад жиров, т. е. мобилизуют энергетические резервы организма и улучшают энергообеспечение органов и тканей. Далее при повышении концентрации катехоламинов в крови усиливается синтез АКТГ в гипофизе, которые активируют синтез глюкокортикостероидов (кортизола) в коре надпочечников. Кортизол запускает реакции адаптивного синтеза ферментов, активирует процессы новообразования глюкозы в печени из веществ неуглеводной природы и мобилизацию жиров, а также снижает синтез белков в тканях, что ведет к повышению уровня аминокислот, необходимых для адаптивного синтеза веществ. Все это создает условия для поддержания высокой скорости энергообразования в условиях повышенной потребности тканей в энергии. Адреналин и кортикостероиды при стрессе работают однонаправленно и обеспечивают большую скорость катаболизма мобилизованных энергетических источников. Поэтому эти гормоны называются адаптивными.
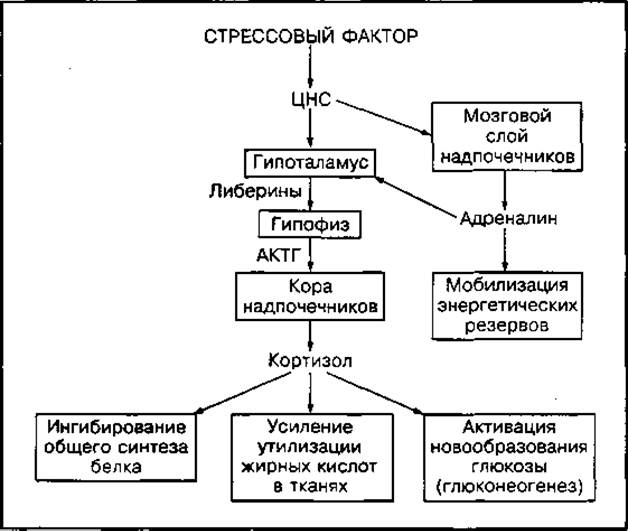
Рис. 106 Участие гормонов гипофиза и надпочечников в обеспечении общей адаптации организма к стрессу
В условиях стресса активируется секреция и других гормонов — глюкагона, гормона роста, вазопрессина. Они также усиливают мобилизацию энергетических ресурсов — углеводных и жировых. Гормон роста усиливает общий белковый синтез, что приводит к гипертрофии (увеличению массы) надпочечников, а при систематических физических нагрузках — и к гипертрофии скелетных мышц и миокарда. Гипертрофия надпочечников повышает их секреторную функцию. Повышение концентрации катехоламинов и глюкокортикостероидов в крови при длительных физических нагрузках способствует повышению спортивной работоспособности. При стрессовых воздействиях повышается уровень вазопрессина, который регулирует водно-солевой обмен, уменьшая объем выделяемой мочи и увеличивая объем плазмы крови, что весьма важно для поддержания давления крови и функции сердечно-сосудистой системы. Таким образом эндокринная система обеспечивает адаптационные изменения метаболизма в условиях изменения среды.
В тренированном организме изменяется реакция эндокринных желез на физическую нагрузку. У спортсменов, специализирующихся в видах спорта, требующих проявления выносливости, не отмечается значительного увеличения в крови концентрации адреналина, глюкагона, соматотропина и кортизола под действием физических нагрузок, а концентрация инсулина при этом снижается в меньшей степени. Такая гормональная адаптация к тренировке, вероятно, отражает приспособляемость обмена веществ. Формируется она достаточно быстро (уже через несколько недель) и сохраняется после пяти недель детренировки.
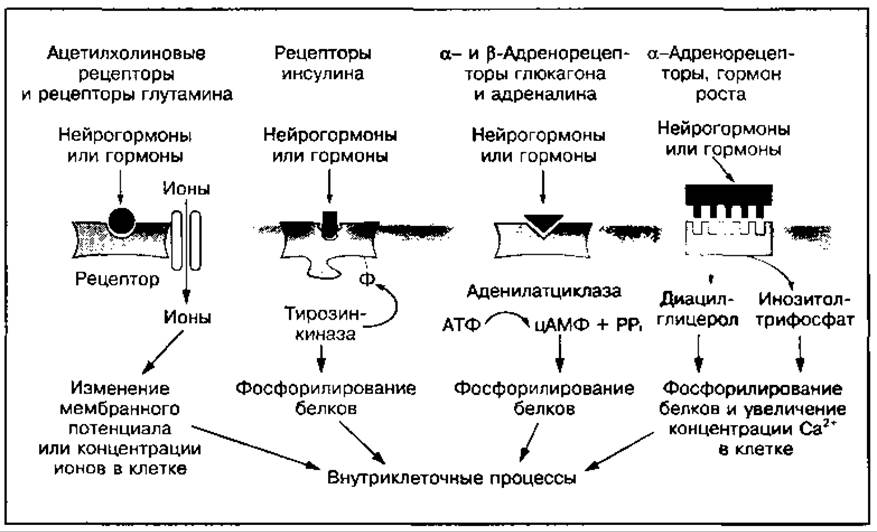
Рис. 107 Механизмы передачи гормонального действия на внутриклеточные процессы
В процессе адаптации организма к физическим нагрузкам наблюдается повышение чувствительности клеток к гормонам и нейрогормонам. Это может вызывать изменения различных процессов в регулируемом органе, так как имеется несколько видов гормонрецепторных взаимодействий и путей передачи их влияния на внутриклеточные процессы. Как следует из рис. 107, связывание гормона с рецептором, расположенным на внешней стороне плазматической мембраны клетки, может приводить к различным конформационным изменениям в мембране, вызывающим:
✵ открытие ионных каналов в нервных и мышечных тканях, изменение мембранного потенциала и уровня ионов в клетке;
✵ активацию фермента тирозинкиназы под воздействием инсулина, которая усиливает синтез белка и процессы фосфорилирования ферментов;
✵ активацию аденилатциклазы, катализирующей синтез цАМФ и связанные с цАМФ процессы;
✵ образование инозитолтрифосфата или диацилглицерина, которые регулируют скорость процессов фосфорилирования или уровень свободного кальция в клетке.
Опыты на животных показали повышение чувствительности цАМФ-зависимых протеинкиназ к цАМФ как к вторичному передатчику отдельных гормонов в скелетных мышцах под воздействием длительной физической нагрузки. Это может свидетельствовать о возможности более тонкой регуляции внутриклеточных процессов при незначительных изменениях уровня гормона в крови, что характерно для тренированного организма. Следовательно, при адаптации к физическим нагрузкам гормональная система становится более экономичной, что создает условия для экономного использования энергетических ресурсов и более эффективного энергообеспечения мышечной деятельности.
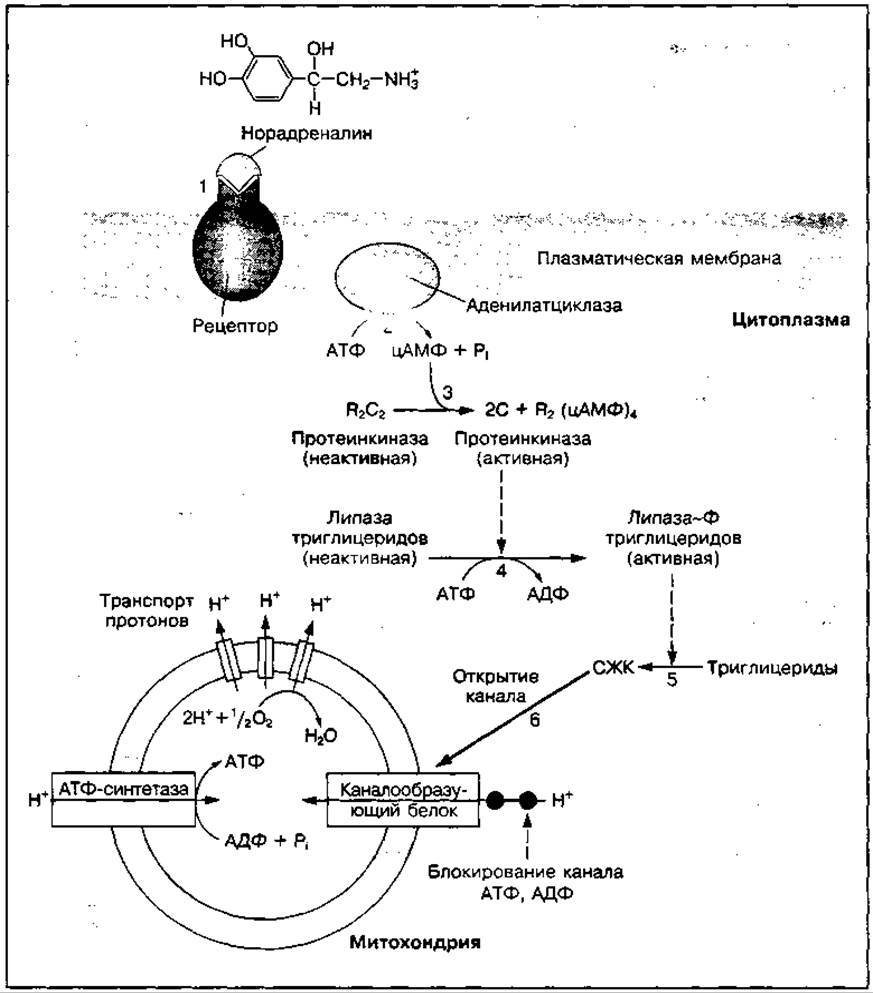
Рис. 108 Схема механизма гормональной регуляции образования АТФ в митохондриях
Механизмы гормонального контроля внутриклеточных процессов довольно сложные, о чем свидетельствует раскрытый в последнее время гормональный контроль образования АТФ в процессе окислительного фосфорилирования в митохондриях жировой ткани, представленный на рис. 108. Механизм гормональной активации синтеза АТФ в митохондриях включает:
✵ связывание гормона норадреналина с рецептором на внешней мембране клетки;
✵ активацию аденилатциклазы, синтезирующей цАМФ из АТФ;
✵ связывание цАМФ с цАМФ-зависимой протеинкиназой и ее активацию;
✵ цАМФ-зависимое фосфорилирование гормоночувствительной липазы, которая расщепляет триглицериды;
✵ открытие блокированного канала в мембране митохондрий, по которому протоны водорода (Н+) поступают в митохондриальное пространство;
✵ активацию протонами Н+ АТФ-синтетазы, синтезирующую АТФ.
Нервная система регуляции
Важную роль в интеграции и регуляции биохимических процессов на уровне организма играет нервная система: ЦНС постоянно информирует органы и ткани о воздействии внешних факторов и координирует обмен веществ в них, подготавливая организм к мышечной деятельности или кратковременным стрессовым ситуациям обмена веществ. Нервная система включает около 1010 нервных клеток — нейронов, которые способны принимать, проводить и передавать сигналы. Нейроны состоят в основном из трех частей — тела, дендритов, принимающих сигналы, и аксона — отростка клетки, который передает сигнал к регулируемым органам (рис. 109, а). Аксон может ветвиться и одновременно передавать сигнал на многие клетки. Нервные клетки, регулирующие сокращение мышц, называются мотонейронами (двигательные нейроны).
Длина аксона мотонейрона, например мотонейрона, иннервирующего мышцы стопы, может достигать 1 метра. Однако нервный импульс передается очень быстро. Скорость возбуждения может достигать 100 м ⋅ с-1. Это осуществляется за счет работы Na+-К+-АТФ-азы, которая откачивает Na+ из клетки в обмен на К+ за счет энергии АТФ и создает движение электрического потенциала (рис. 109, б).
Электрический потенциал покоя на мембране аксона поддерживается в пределах — 70 мВ. Потенциал действия создается быстрым током ионов Na+ из внеклеточного пространства внутрь нервного окончания, обусловленным избирательным открытием Na+-канала в мембране при раздражении нервной клетки. Одновременно увеличивается проницаемость мембраны для ионов К+, которые выходят из нервного волокна. Восстановление потенциала покоя происходит благодаря выкачиванию ионов Na+ наружу и закачиванию ионов К+ внутрь с участием Nа+-К+-АТФ-азы, находящейся в мембране (см. рис. 109, б).
Передача действия нервного импульса на другие клетки происходит в специальных образованиях, которые называются синапсами. Синапсы — это места контакта нервного окончания с поверхностной мембраной регулируемой клетки. Они включают пресинаптическую и постсинаптическую мембраны, а также синаптическую щель (рис. 110). Выделяют электрические и химические синапсы. В химических синапсах передача нервного импульса происходит с участием нейромедиаторов (нейротрансмиттеров). Нейромедиаторами являются такие химические вещества, как ацетилхолин, адреналин, норадреналин, а также дофамин, серотонин, глутамин, глицин, ГАМК и др. Синапс приспособлен к быстрому выбросу нейромедиатора, образующегося в эфферентных нервных клетках в синаптических пузырьках. Поэтому нервная система оказывает быстрое воздействие на довольно ограниченный участок органа. Поскольку скелетные мышцы регулируются химическими синапсами с участием нейропередатчика ацетил-холина, рассмотрим, каким образом осуществляется такой регуляторный контроль.
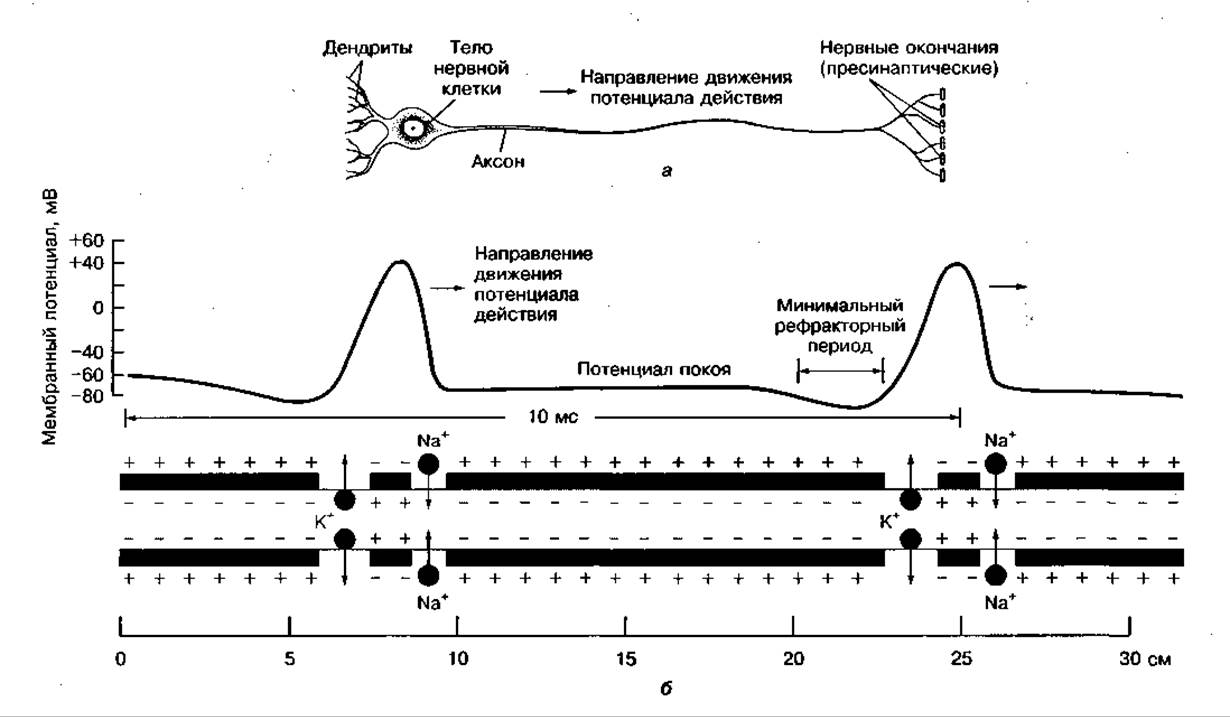
Рис. 109 Строение нейрона (а) и процесс образования электрического потенциала действия на аксоне (б)
Ацетилхолин синтезируется из ацетил-КоА и холина в нервных отростках с участием фермента холинацетилтрансферазы:
![]()
При передаче нервного импульса ацетилхолин выделяется в синаптическую щель и взаимодействует со специфическим рецептором на постсинаптической мембране рабочего органа (см. рис. 110). Под воздействием ацетилхолина запускается процесс транспорта ионов через мембрану и ряд других биохимических реакций, обеспечивающих специфическую функцию органов. Ацетилхолин в течение нескольких миллисекунд после прекращения действия нервного импульса может расщепляться ферментом ацетилхолинэстеразой до ацетата и холина и прекращает свое медиаторное действие:
![]()
Таким образом нервная система обеспечивает регуляцию и интеграцию многочисленных процессов в органах и тканях, создавая условия для нормального функционирования организма при воздействии различных внешних и внутренних факторов. При нарушении нервной регуляции (денервации) в контролируемом органе изменяется интенсивность и направленность обмена веществ, что может вызвать патологические изменения его функции.
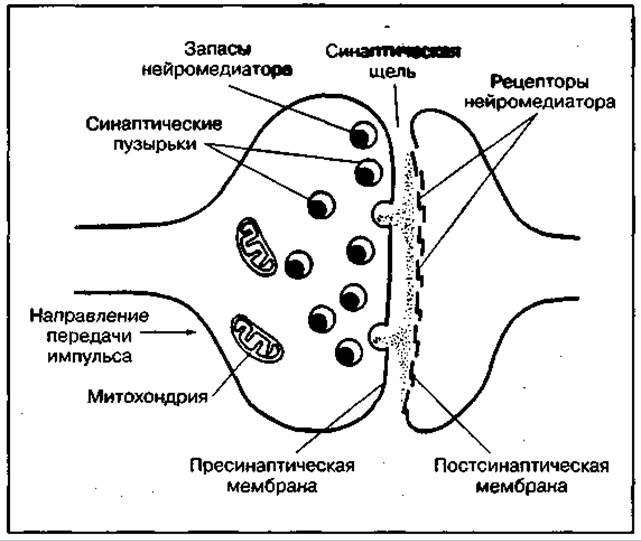
Рис. 110 Основные функциональные компоненты синапса
При двигательной активности процесс сокращения скелетных мышц регулируется нервной системой. Ее регуляторное воздействие может проявляться следующим образом:
✵ вовлечением разного количества мышечных волокон (двигательных единиц) в процесс сокращения;
✵ изменением частоты иннервации или активации двигательных единиц;
✵ подключением разных по величине мононейронов — малых с низкой возбудимостью или больших с высокой возбудимостью;
✵ подключением различных типов мышечных волокон — быстрых или медленных, которые имеют свои механизмы энергообеспечения;
✵ изменением концентрации ионов в волокнах, которые активируют или ингибируют многие ферментные системы.
В процессе тренировочных занятий совершенствуется нервная регуляция в скелетных мышцах, сердце и других органах, что способствует более экономичной их работе.
Нервные и гормональные сигналы могут усиливать, ослаблять или видоизменять эффекты друг друга. Примером одновременного и согласованного регуляторного их влияния может служить изменение активности фермента киназы фосфорилазы, стимулирующей распад гликогена (гликогенолиз). Как видно из рис. 105, этот фермент активируется ионами Са2+, которые поступают в клетки мышц и печени при воздействии нервного импульса или цАМФ, образующегося при участии гормона адреналина. При одновременном их влиянии фермент становится высокоактивным. Таким образом осуществляется тонкая регуляция основного механизма энергообразования при интенсивной мышечной деятельности в соответствии с потребностями в энергии.
Описанные механизмы не исчерпывают всего многообразия типов регуляции метаболизма и не раскрывают всей их сложности. Важную роль в интеграции обмена веществ и его адаптации при мышечной деятельности выполняют определенные органы и ткани.