Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, приводящие к запасанию энергии
Улавливание энергии света биомолекулами
Фотосинтез
Фотосинтез представляет собой высокоэффективный процесс запасания энергии видимого света и трансформирования ее в энергию химических связей биологических молекул. Осуществляется данный процесс в клетках растений, водорослей и фототрофных бактерий, причем у большинства перечисленных организмов фотосинтез сопровождается использованием в качестве донора электронов воды и выделением молекулярного кислорода (уравнение 13.1). И только у аноксигенных бактерий, относящихся к классу Anoxyphotobacteria, вместо воды роль доноров электронов могут выполнять некоторые иные восстановленные соединения, например сероводород. При этом не происходит образования О2 (уравнение 13.2).
CO2 + H2O → (CH2O) + O2 (13.1)
CO2 + 2H2S → (CH2O) + H2O + 2S (13.2)
Данное наблюдение принадлежит Корнелису ван Нилю, который в 1931— 1933 гг., будучи еще студентом-дипломником, исследовал особенности фотосинтеза у разных бактерий и сделал смелое предположение, перевернувшее взгляды исследователей на закономерности фотосинтеза. Исходя из выведенного им уравнения фотосинтеза для пурпурных серных бактерий (13.2), К. ван Ниль предположил, что не углекислота, а вода разлагается при фотосинтезе у растений, образуя молекулярный кислород, и предложил общее уравнение фотосинтеза (13.3):
CO2 + 2H2A → (CH2O) + H2O + 2A (13.3)
В последнем уравнении H2A представляет собой донор электронов, которым у оксигенных организмов служит вода, а у аноксигенных бактерий — другие вещества (сероводород, молекулярный водород, изопропанол и др.). При этом выделяется дегидрированный донор электронов (А) и происходит восстановление углекислоты до органического соединения (СН2О). Эти превращения и составляют суть процесса фотосинтеза.
Интересно отметить, что вода является очень плохим донором электронов и ни один из окислителей, которыми располагают живые организмы, не является достаточно мощным, чтобы отщепить от молекулы Н2О атомы водорода. Это становится возможным лишь в результате фотохимических превращений особых молекул хлорофиллов, которые становятся сильными окислительными агентами и приобретают способность окислять воду.
Процесс фотосинтеза требует обязательного участия мембран. У прокариот эту роль выполняют впячивания плазматической мембраны, а у эукариот — мембраны тилакоидов, расположенные в хлоропластах. Тилакоиды находятся в строме хлоропластов, образуя стопки (граны). Внутреннее содержимое тилакоидов называют люменом.
В мембранах тилакоидов располагаются компоненты транспорта электронов, сгруппированные в 2 фотосистемы, и АТР-синтаза. Фотосистемы используются для переноса электронов и сопряженного с ним перевода протонов в люмен, в результате чего на тилакоидной мембране создается протонный градиент. Энергия протонного градиента запускает синтез АТР, подобно тому, как это имеет место при окислительном фосфорилировании. Однако, в отличие от дыхательной цепи, в фотосистемах электроны движутся от плохого донора (молекулы воды) к плохому акцептору (NADP+), т. е. в противоположном по сравнению с дыханием направлении. Соответственно и энергия при таком направленном «вверх» потоке электронов должна затрачиваться. Действительно, для восстановления NADP+ электроны должны дважды возбудиться светом.
Характеристика компонентов фотосистем. Компоненты фотосистем представляют собой белковые комплексы, содержащие фоточувствительные молекулы (пигменты) и переносчики восстановительных эквивалентов.
Пигменты представлены в основном хлорофиллами, каротиноидами и фикобилинами. Основную роль в процессе фотосинтеза играет зеленый, содержащий ионы магния тетрапиррольный пигмент — хлорофилл a (рис. 13.1). Этот хромофор представляет собой магнийпорфирин и похож по структуре на гем (железопорфирин). Однако у хлорофилла a имеются следующие основные отличия: с одним из пиррольных колец слито пятое, циклопентановое кольцо; одно из пиррольных колец частично восстановлено; одна из кислотных боковых цепей представляет собой эфир фитола — двадцатиуглеродного высокогидрофобного спирта. Остаток фитола придает молекуле хлорофилла амфифильные свойства и служит «якорем», с помощью которого хромофор может удерживаться в липидном бислое тилакоидной мембраны. При этом гидрофильная голова (магнийпорфирин) находится на поверхности мембраны, обращенной к водной фазе стромы, и расположена параллельно плоскости мембраны. Таким образом, достигается ориентация хлорофилла в хлоропластах, способствующая наиболее эффективному улавливанию световой энергии.
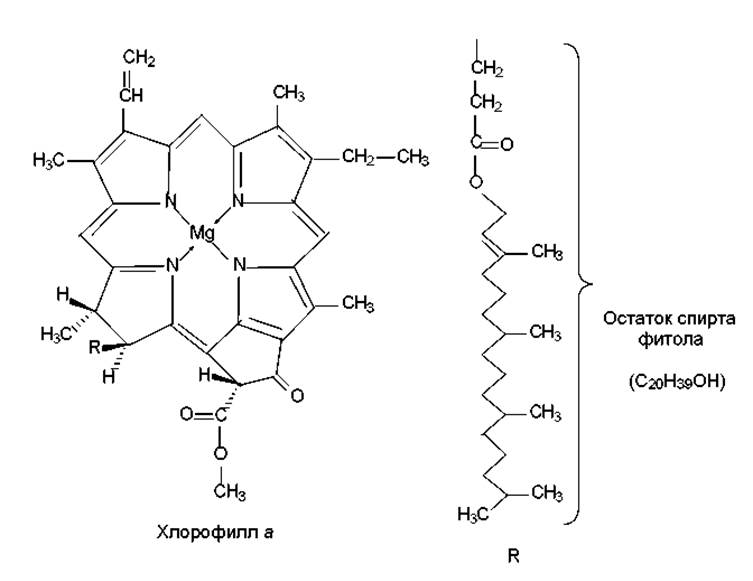
Рис. 13.1. Структура молекулы хлорофилла а
Другие хлорофиллы зеленых растений (b, c, феофитин), а также хлорофиллы некоторых водорослей и бактерий (хлоробиум-хлорофилл, бактерио-хлорофиллы) отличаются от хлорофилла а структурой заместителей у пиррольных колец, отсутствием иона магния (феофитин), спектрами поглощения. Существование в клетке хлорофиллов с разными спектрами поглощения позволяет увеличить диапазон улавливаемого излучения.
Каротиноиды и фикобилины служат вспомогательными пигментами. Они еще больше увеличивают спектр поглощаемой организмом энергии, а кроме того, защищают хлорофиллы от избытка света и от окисления кислородом, который выделяется при фотосинтезе. Каротиноиды — это желтые, оранжевые, красные или коричневые пигменты, сильно поглощающие в фиолетовой области спектра. В хлоропластах присутствуют две группы каротиноидов — каротины (углеводороды, бульшую часть которых составляют тетратерпены, подробно рассматриваются в главе 17) и ксантофиллы (по химическому строению сходны с каротинами, но содержат кислород). Фикобилины характерны для цианобактерий и хлоропластов красных водорослей.
Для более полного улавливания световой энергии пигменты в фотосистемах собраны с помощью белков в антенные комплексы. В каждом антенном комплексе насчитывается по несколько сотен молекул пигментов, и их основная функция состоит в передаче поглощенной энергии хлорофиллу а. Таким образом, можно сравнить антенный комплекс с воронкой, «загоняющей» энергию к хлорофиллу реакционного центра фотосистемы. Энергия возбуждения (экситон) передается от молекулы к молекуле посредством электрического поля возбужденного электрона (очевидно, возбужденный электрон в молекуле, поглотившей квант света, передает свою энергию близлежащей молекуле таким образом, что в той тоже возбуждается электрон).
Транспортирующие электроны компоненты фотосистем представлены комплексом цитохрома b/f (агрегат интегральных мембранных белков, содержащий два цитохрома: b563 и f), феофитином, мембраносвязанными пластохинонами (QA и QB), а также мобильными переносчиками, функции которых выполняют пластохинон QP, пластоцианин и ферредоксин. Пластохинон по структуре и функциям очень напоминает убихинон (рис. 12.1). Пластоцианин представляет собой белок с одним атомом меди, координационно связанным с боковыми цепями аминокислот: при переносе электрона Cu находится попеременно в степени окисленности +1 и +2. Ферредоксин является железосерным белком типа 4Fe, 4S2-, переносящим электроны. Цепь переносчиков замыкает фермент, транспортирующий электроны на NADP+.
Установлено, что фотосинтез требует участия двух фотосистем: II и I. Фотосистема II содержит в реакционном центре хлорофилл а, имеющий оптимум поглощения при 680 нм (Р680), а в реакционном центре фотосистемы I (Р700) содержится хлорофилл а с оптимумом поглощения 700 нм.
Световые реакции фотосинтеза. Процесс фотосинтеза условно можно разделить на 2 этапа: световые и темновые реакции. Световые реакции требуют участия видимого света и осуществляются в тилакоидных мембранах. Их итогом является восстановление NADP+ и синтез АТР. Темновые реакции могут осуществляться и в условиях отсутствия видимого света, в строме, и под ними обычно подразумевают восстановление СО2 при участии АТР и NADPH.
У растений фотосинтетический перенос электронов начинается с фотосистемы II. Энергия поглощенного света поступает от антенных комплексов к хлорофиллу а реакционного центра Р680 и переводит один из его электронов в возбужденное состояние. Возбужденный электрон сразу передается на расположенный рядом феофитин, а в молекуле хлорофилла появляется положительно заряженная «дырка» с очень высоким сродством к электрону, т. е. возникает положительно заряженный радикал Р680. «Дырка» очень быстро заполняется электроном, извлеченным из воды водорасщепляющим ферментом (Н2О → 2Н+ + SО2 + 2к) при участии ионов марганца. Возбужденный электрон мигрирует по цепи переносчиков (рис. 13.2) и достигает второй «дырки» в Р700 фотосистемы I, которая, в свою очередь, образовалась при переносе «горячего» электрона на электронный акцептор (по-видимому, пластохинон). Здесь электрон возбуждается вторично и далее по переносчикам фотосистемы I передается на NADP+ (рис. 13.2). Такое движение электронов по цепи переносчиков называется нециклическим потоком, или Z-схемой. Важной отличительной особенностью этого процесса является то, что электрон дважды возбуждается в реакционных центрах двух фотосистем, и поэтому его энергии хватает для восстановления NADP+. Реакцию образования NADPH катализирует ферредоксин-NADP-редуктаза, содержащая FAD в качестве простетической группы. Следует отметить, что для восстановления никотинамидных кофакторов требуются гидрид-ионы: 2 электрона от двух молекул восстановленного ферредоксина конвергируют, а протон поступает из стромы.
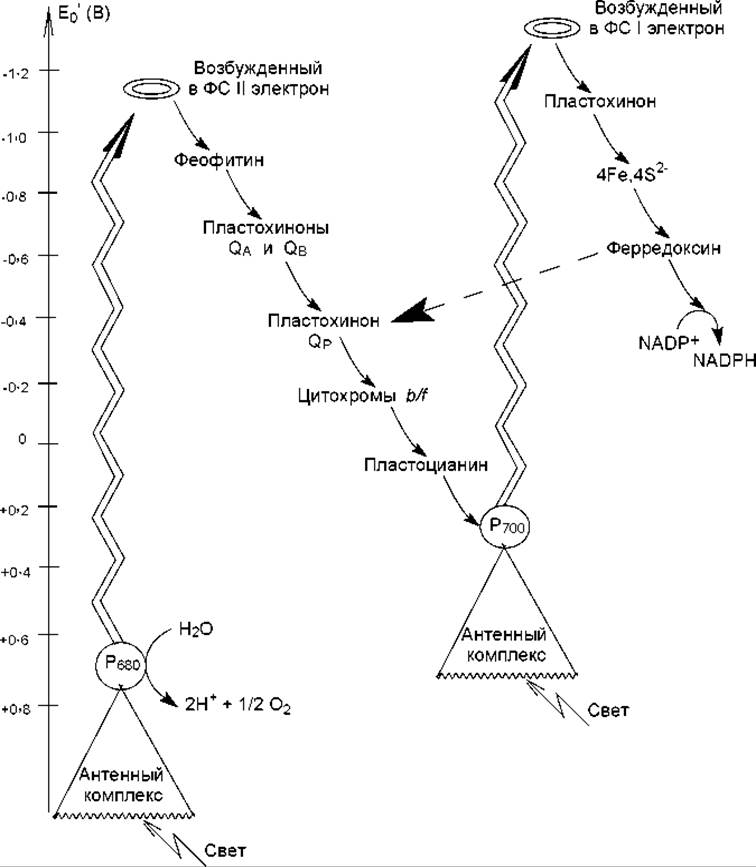
Рис. 13.2. Схема потоков электронов в фотосистемах тилакоидных мембран. Зигзагообразные стрелки символизируют фотохимическое возбуждение электронов и переход их на более высокий энергетический уровень; обычные стрелки указывают путь электронов в нециклическом потоке; пунктирная стрелка указывает путь электронов при их поступлении в циклический поток
Кроме образования NADPH, нециклический поток электронов обусловливает перенос протонов в люмен и создание на тилакоидной мембране электрохимического градиента. Это происходит на этапе переноса водорода от восстановленного пластохинона QP на комплекс цитохромов b/f которые, как известно (глава 12), являются переносчиками электронов. Когда протоны, согласно закономерностям облегченной диффузии, выходят из люмена в строму, они используют каналы АТР-синтазы, и происходит синтез АТР. Этот механизм запасания энергии носит название фотофосфорилирование, и его принцип сходен с механизмом окислительного фосфорилирования.
Кроме описанного выше нециклического потока, в тилакоидных мембранах могут осуществляться циклические потоки электронов. В них электрон возбуждается только единожды, в реакционном центре фотосистемы I, и не происходит образования NADPH. Поток становится циклическим, когда электроны от ферредоксина передаются не на NADP+, а обратно, к пластохинону QP (рис. 13.2, 13.3, пунктирные стрелки). Такое движение электронов обеспечивает клетку только АТР, но не NADPH. Циклический поток электронов преобладает при низких концентрациях NADP+, что обусловлено накоплением в клетке NADPH.
На рис. 13.3 показано расположение компонентов фотосистем, их субстратов, а также продуктов. Можно видеть, что основные продукты световых реакций фотосинтеза — NADPH и ATP — накапливаются в строме, т. е. там, где они должны расходоваться в темновых реакциях.
Темновые реакции фотосинтеза. К темновым реакциям фотосинтеза относят фиксацию, т. е. восстановление и включение в состав органических соединений, СО2. У большинства фотосинтезирующих организмов этот процесс осуществляется в цикле Кальвина (цикл носит имя Мелвина Кальвина, получившего за его открытие Нобелевскую премию).
Цикл Кальвина условно можно разделить на три этапа: 1) карбоксилирование рибулозодифосфата; 2) восстановление 3-фосфоглицерата до альдегида; 4) регенерация рибулозодифосфата — акцептора СО2.
Углекислота, восстанавливаемая в цикле Кальвина, поступает в строму хлоропластов зеленых растений через устьица в листьях и зеленых стеблях, а в клетки водорослей и цианобактерий — в растворенном виде. Ключевой реакцией восстановления СО2 является карбоксилирование рибулозодифосфата. Данную реакцию катализирует необычный фермент — рибулозодифосфат-карбоксилаза/оксигеназа, обладающая двумя активностями: карбоксилазной и оксигеназной (рис. 13.4).
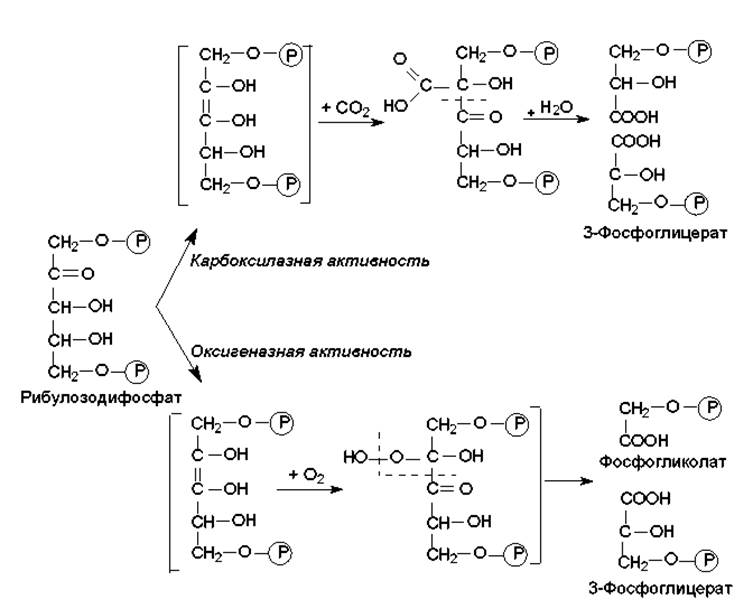
Рис. 13.4. Реакции превращения рибулозодифосфата, катализируемые рибулозодифосфат-карбоксилазой/оксигеназой
Оксигеназная активность реализуется в отсутствии СО2 и в присутствии О2, а продукты этой реакции участвуют в фотодыхании. Рибулозодифосфат-карбоксилаза/оксигеназа очень медленно работает: скорость ее катализа в сотни раз меньше, чем для большинства других ферментов. Поэтому в хлоропластах этот фермент может составлять до половины всего белка. Считается, что это самый распространенный на Земле белок, преобладающий в количественном отношении над другими белками. На уровне данного фермента осуществляется регуляция скорости цикла Кальвина.
Восстановление продуктов карбоксилазной реакции (2 молекул 3-фосфоглицерата) происходит с участием фосфоглицераткиназы и глицеральдегид-3-фосфатдегидрогеназы. Обратные реакции, катализируемые этими ферментами, имеют место в гликолизе (рис. 9.3). В этом процессе затрачивается энергия АТР и восстановительные эквивалентны, поставляемые NADPH.
Регенерация рибулозодифосфата осуществляется в результате межмолекулярных перестроек с участием трансальдолаз и транскетолаз (принимают также участие в пентозофосфатных путях, описаны в главе 9). В превращения вступают 3 соединения: глицеральдегид-3-фосфат, образующийся из него в ходе изомеризации дигидроксиацетонфосфат, а также фруктозо-1,6-дифосфат, который образуется в реакции альдольной конденсации из двух триозофосфатов (см. Гликолиз, глава 9).
В результате описанных превращений из 6 молекул СО2 в ходе 6 оборотов цикла Кальвина синтезируется 1 молекула гексозы. При этом затрачивается 18 молекул АТР и 12 молекул NADPH (рис. 13.5). Таким образом, фиксация углекислоты обходится клетке очень дорого: на включение лишь одной молекулы СО2 в органическое соединение расходуется 3 молекулы АТР и 2 молекулы NADPH.
Цикл Кальвина изображают замкнутым, однако, как и в ЦТК, многие его промежуточные продукты используются в качестве предшественников для биосинтеза клеточных соединений. Так, 3-фосфоглицерат может превращаться в пируват (реакции гликолиза); эритрозо-4-фосфат — в ароматические аминокислоты; рибозо-5-фосфат — в нуклеотиды; гексозофосфаты — в полисахариды (последние три промежуточных соединения формируются на стадии межмолекулярных перестроек). Так же, как и в других циклах, существуют анаплеротические реакции, не позволяющие циклу прерываться.
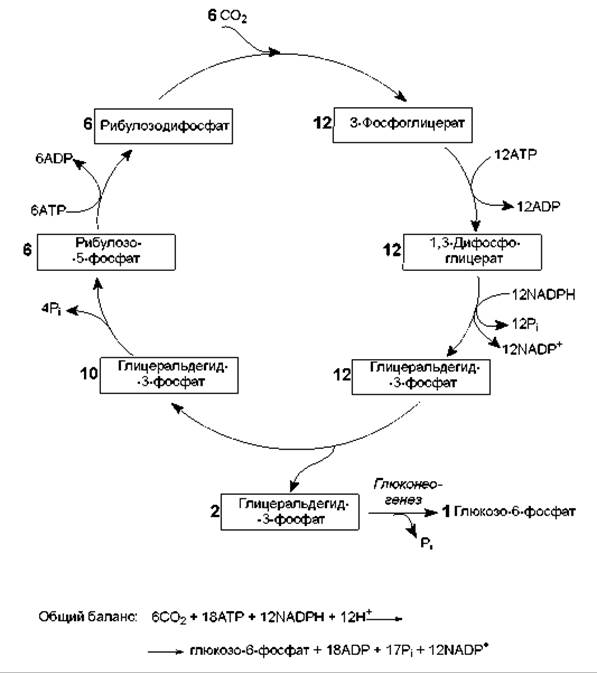
Рис. 13.5. Цикл Кальвина
Скорость цикла Кальвина строго регулируется, поскольку на фиксацию СО2 не должно расходоваться чересчур много клеточной энергии. Основной принцип регуляции цикла состоит в том, чтобы «подогнать» скорость фиксации СО2 к скорости световых реакций фотосинтеза, где образуются необходимые для фиксации АТР и NADPH. Поэтому, не смотря на то что цикл Кальвина не требует непосредственного участия видимого света, наиболее интенсивно он все же протекает в условиях освещения. Основной стадией, лимитирующей скорость фиксации углекислоты, является карбоксилирование рибулозодифосфата. Активность карбоксилазы значительно увеличивается при освещении, чему способствуют следующие причины:
1) карбоксилаза аллостерически активируется фруктозо-6-фосфатом и ингибируется фруктозо-1,6-дифосфатом. В свою очередь, содержание этих продуктов контролирует фермент фруктозо-1,6-дифосфатаза, которая активируется светом и катализирует расщепление фруктозодифосфата;
2) еще одним аллостерическим активатором карбоксилазы является NADPH, а его количество возрастает на свету при интенсивном нециклическом потоке электронов;
3) скорость рассматриваемой ферментативной реакции возрастает при повышении рН от 7 до 9. Фермент работает в строме, а ее защелачивание является следствием закисления люмена при создании протонного градиента на тилакоидной мембране;
4) карбоксилаза активируется ионами марганца, которые высвобождаются в строму при переносе протонов в люмен в процессе транспорта электронов.
Кроме этого, свет активирует еще один фермент цикла Кальвина — глицеральдегид-3-фосфат-дегидрогеназу, который, очевидно, меняет свою специфичность (от NADH к NADPH) под действием света.
С4-путь фиксации СО2. Описанный выше процесс включения СО2 в состав 3-фосфоглицерата (результат карбоксилазной реакции рибулозодифосфат-карбоксилазы/оксигеназы) называется С3-путем, а растения, в которых он осуществляется — С3-растениями. В то же время существует альтернативный С4-путь (цикл Хэтча—Слэка), отличающийся присутствием дополнительной начальной стадии — фиксации СО2 в составе четырехуглеродного соединения (оксалоацетата). Эту реакцию катализирует фосфоенолпируват-карбоксилаза — фермент, работающий гораздо быстрее, чем рибулозодифосфат-карбоксилаза/оксигеназа. В результате у С4-растений углекислота включается в состав оксалоацетата намного эффективнее, чем у С3-растений в состав 3-фосфоглицерата. Однако С4-путь требует дополнительных стадий и затрат энергии: на фиксацию одной молекулы СО2 здесь затрачивается 5 молекул АТР вместо 3 в С3-пути (рис. 13.6). Тем не менее, С4-растения (кукуруза, сахарный тростник, сорго, многие сорняки, произрастающие в умеренной зоне и др.) растут гораздо быстрее, чем С3-растения (пшеница, рожь, овес, рис и др.). Причиной такого несоответствия служит фотодыхание — расточительный процесс, характерный для всех С3-растений и практически отсутствующий растений.
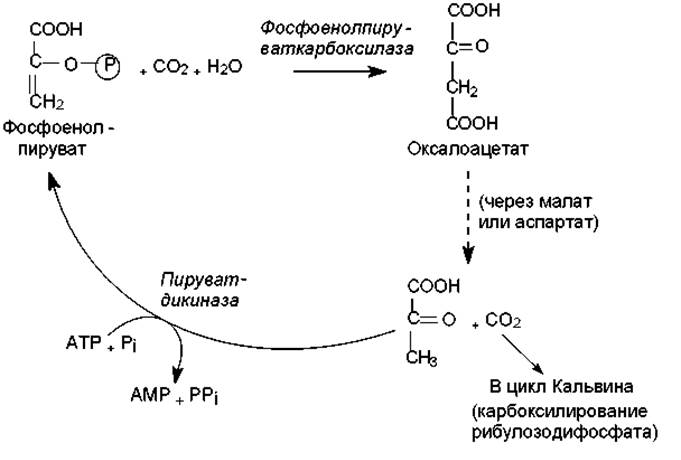
Рис. 13.6. Цикл Хэтча—Слэка (С4-путь фиксации СО2)
Фотодыхание. Этот процесс обязан существованию оксигеназной активности рибулозодифосфат-карбоксилазы/оксигеназы. Молекулярный кислород конкурирует с СО2 за активный центр данного фермента, и часть рибулозодифосфата превращается в фосфогликолат (рис.13.4). Этого не происходит у С4-растений, поскольку большинство их имеет своей родиной тропические страны, где высокое испарение влаги заставило растения выработать механизм закрывания устьиц, через которые ткани вентилируются газами, в самые жаркие часы дня (при максимальном солнечном освещении). Чтобы такой механизм не привел к снижению скорости фиксации СО2, растения запасают углекислоту в составе малата или аспартата (образуются из оксалоацетата в цикле Хэтча—Слэка), а затем расходуют по мере надобности (реакции декарбоксилирования). В этом случае концентрация СО2 в зеленых частях растений всегда находится на высоком уровне и отсутствует конкуренция О2 за активный центр фермента, поскольку молекулярный кислород поступает в клетки в ограниченных количествах при закрывании устьиц.
Субстратом фотодыхания служит гликолат, который образуется при дефосфорилировании фосфогликолата. При фотодыхании (в отличие от митохондриального дыхания, тоже характерного для растений в темноте) потребление О2 и выделение СО2 не связано с запасанием энергии, наоборот, здесь расходуются восстановительные эквиваленты и ATP, а фиксированный в цикле Кальвина углерод бесполезно теряется в виде СО2. Показано, что фотодыхание может приводить к реокислению и выделению до 50% углерода, фиксированного в цикле Кальвина. До сих пор не разгадана целесообразность этого столь неэкономного и ограничивающего эффективность роста растений процесса.
Последовательность событий фотодыхания изображена на рис. 13.7. Можно видеть, что отдельные стадии этого процесса осуществляются в разных органеллах. Итогом фотодыхания является образование одной молекулы фосфоглицерата (3 атома «С») из двух молекул гликолата (4 атома «С»), а участие кислорода приводит к окислению четвертого атома углерода в углекислоту. По-видимому, назначение сложной последовательности превращений в фотодыхании состоит в том, чтобы вернуть в цикл хотя бы часть углерода из гликолата, который накапливается в избытке.
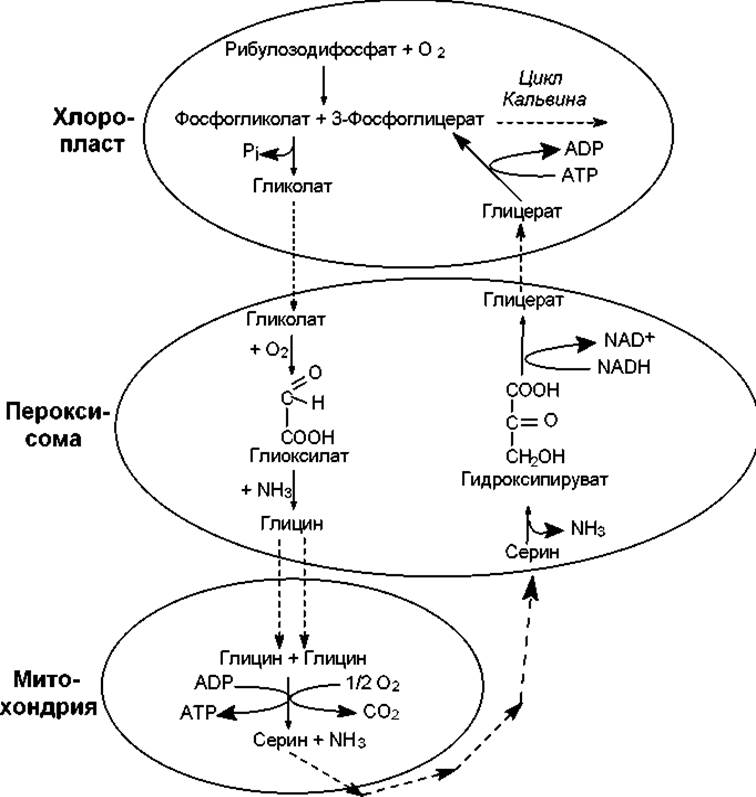
Рис. 13.7. Фотодыхание
При фотодыхании происходит потеря одного атома углерода из каждых четырех, причем следует учитывать, что на фиксацию этого атома углерода уже затрачена энергия в цикле Кальвина. Кроме этого, при окислении глицина и дезаминировании серина выделяется аммиак, на включение которого в состав аминокислот снова придется затрачивать энергию. В результате фотодыхание снижает потенциальную урожайность С3-растений на 30—40%.