Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Кинетика простых ферментативных реакций с одним и двумя субстратами
Определение параметров в уравнении Михаэлиса - Ментен
В своей первоначальной форме уравнение Михаэлиса — Ментен (3.3) неудобно для определения кинетических параметров vmах и Km. Как показано на рис. 3.7, по графику зависимости v от s довольно сложно определить точное значение vmax. Путем ряда несложных преобразований уравнения (3.3) нетрудно, однако, найти приведенные ниже уравнения, более пригодные для изображения результатов в графической форме и для графического определения параметров:
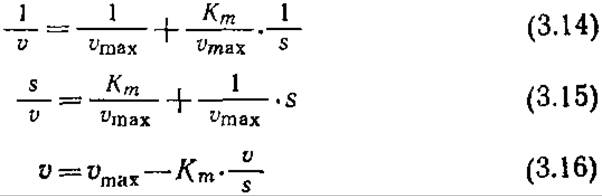
Каждое из приведенных уравнений отражает линейную зависимость одной величины от другой. В то же время при определении кинетических параметров по таким зависимостям следует принимать во внимание ряд свойственных им ограничений и недостатков. В графическом выражении уравнения (3.14) в виде зависимости 1/v от 1/s (известном под названием графика Лайнуивера—Бэрка) четко разделены зависимая и независимая переменные (рис. 3.11, а). Определяемые с наибольшей точностью значения скоростей реакций, близкие vmax, концентрируются возле исходной точки, а менее точно определяемые значения и удалены от нее и таким образом в наибольшей степени влияют на наклон прямой Km/vmах; поэтому в таких случаях нельзя применять метод наименьших квадратов. Второе уравнение (3.15) обеспечивает более равномерное распределение больших значений v и, таким образом, более точное определение наклона кривой 1/vmах, однако отрезок, отсекаемый прямой на координатной оси, часто слишком мал, что не позволяет достаточно точно определить этим методом Кm. В третьем методе применяется так называемый график Эди—Хофсти, представляющий собой график зависимости v от v/s (рис. 3.11,6); здесь наименее точно определяемая переменная v является составной частью как функции, так и аргумента.
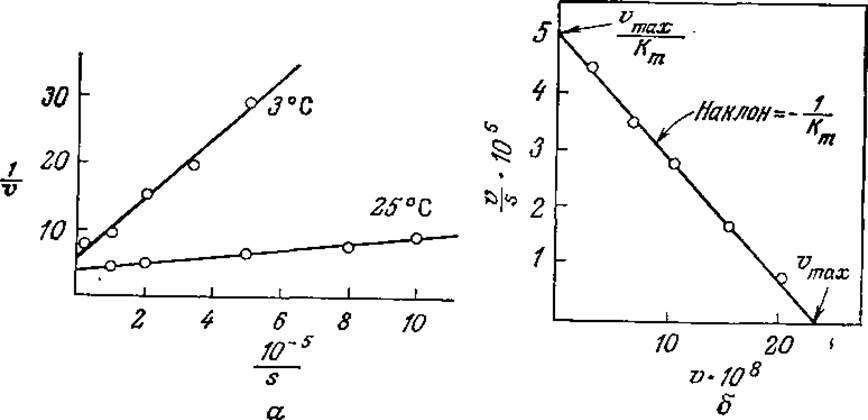
РИС. 3.11. а — результаты экспериментального изучения ферментативной активности пепсина в координатах Лайнуивера — Бэрка; б — экспериментальные данные по изучению катализируемого химотрипсином гидролиза метилового эфира дигидрокоричной кислоты в координатах Эдн — Хофсти. [Воспроизведено с разрешения из работы: Laidler К. J., The Chemical Kinetics of Enzyme Action, pp. 65—66, The Clarendon Press, Oxford, 1958.]
Приведенные выше соображения диктуют следующую стратегию определения vmax и Кm: сначала определяют vmах по графику уравнения (3.14) (находят точную величину отрезка, отсекаемого прямой на оси 1/v) или уравнения (3.15) (точно определяют наклон прямой). Затем возвращаются к графику зависимости v от s и находят s1/2, т. е. такую концентрацию субстрата, при которой v равно vmaх/2. Как мы уже упоминали при обсуждении уравнения (3.3), Кm по величине и размерности равно s 1/2.
Важно представлять себе, в каких диапазонах могут изменяться эти кинетические параметры. В табл. 3.4 приведен ряд параметров, характерных для различных ферментов. Обратите внимание на то, что величина k2, может изменяться в очень широких пределах, а Кm, напротив, обычно имеет значения 2∙10-3—10∙10-3 М. Почти все приведенные в табл. 3.4 данные были получены при умеренной температуре и почти нейтральном pH. Исключение составляет пепсин, основная биологическая функция которого сводится к гидролизу белков в кислой среде желудка и который поэтому наиболее активен при низких значениях pH; эти значения, естественно, использовались и при экспериментальном определении его кинетических параметров. Модели, отражающие влияние pH и температуры на кинетику ферментативных реакций, мы рассмотрим в разд. 3.6.