Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Стехиометрия и энергетика метаболических превращений
Принципы термодинамики
Чтобы определить, пойдет ли данная химическая реакция в клетке в прямом или обратном направлении, нам придется принять ряд упрощений, поскольку полный анализ всех путей метаболизма практически нереален. Прежде всего отметим, что в случае элементарной химической реакции
![]()
изменение свободной энергии ∆G' может быть записано в виде
![]()
Как и в предыдущих главах, строчными буквами а, b и т. д. мы будем обозначать молярные концентрации соединений А, В и т. д. Поскольку концентрации веществ в биологических растворах обычно невысоки, то в уравнении (5.2) вместо активностей можно подставить концентрации реагентов. Надстрочный индекс (') над символами ∆G означает, что все расчеты относятся к водным растворам при pH 7; это позволяет не включать концентрации воды и Н+ в последний член уравнения (5.2), даже если Н2O и Н+ участвуют в реакции (5.1). Таким образом, стандартное изменение свободной энергии ∆G°'обозначает изменение свободной энергии в реакции (5.1) в нейтральном водном растворе, когда концентрации всех других реагентов и продуктов реакции равны 1 М (см. [1]).
В закрытой системе реакция будет протекать слева направо только в том случае, если ∆G' отрицательно. Отсюда следует, что в состоянии равновесия ∆G' равно нулю; таким образом мы получим хорошо известное выражение для равновесной реакции:
![]()
где
![]()
Запомните, что если в реакции участвуют вода или Н+, то их концентрации не входят в правую часть уравнения (5.4); эти параметры уже учтены в К'еq (при pH 7).
В последующем обсуждении время от времени мы будем считать отрицательные значения ∆G⁰' свидетельством в пользу того, что реакция идет слева направо. Такое допущение, безусловно, справедливо только в самом первом приближении, поскольку, во-первых, клетка не представляет собой закрытую систему и, во-вторых, концентрации реагентов обычно не достигают 1 М. Полезность этого допущения для понимания основных принципов биоэнергетики хорошо освещена в книге Ленинджера [1], рекомендуемой для дополнительного чтения.
В то же время следует отчетливо представлять себе и те ограничения, которые накладывает такой приближенный подход. В сложной метаболической схеме типа изображенной на рис. 5.1 направление основного пути реакции в метаболизме клетки не всегда можно установить путем изучения изолированной реакции. Рассмотрим, например, реакцию между двумя изомерами, являющимися промежуточными соединениями при расщеплении глюкозы по пути Эмбдена — Мейергофа:
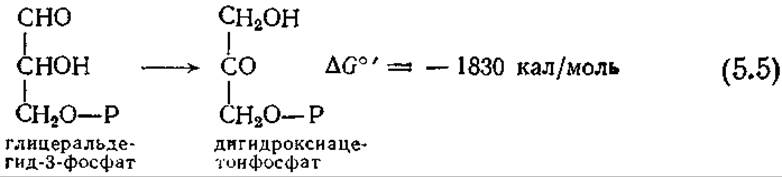
Здесь Р — фосфатная группа. Отрицательная величина изменения свободной энергии обусловливает смещение равновесия в сторону дигидроксиацетона до отношения 22:1. Однако, как показано на рис. 5.1, в пути Эмбдена — Мейергофа глицеральдегидфосфат постоянно вовлекается в другую последовательность реакций, приводящую в конце концов к пирувату, в результате чего равновесие смещается и реакция (5.5) протекает справа налево.
Многие биологические реакции и процессы, связанные с энергообменом, включают стадии окисления-восстановления типа
![]()
Для определения направления таких реакций часто используют параметр, называемый изменением стандартного потенциала ∆Е⁰' и определяемый следующим образом:
![]()
Здесь E°'(AOX/Ared) — стандартный электродный потенциал полуреакции
![]()
В качестве точки отсчета для таких электродных потенциалов применяют водородный электрод, потенциал которого при давлении водорода 1,01 ∙ 105 Па и активности ионов гидроксония в растворе, равной 1, принимают равным нулю:
![]()
Изменения свободной энергии и соответствующие изменения электродного потенциала связаны соотношением
![]()
Здесь n — число участвующих в реакции электронов, а ℱ — константа Фарадея [ℱ = 23,062 ккал/(В ∙ моль) ]. Согласно уравнению (5.10), слева направо протекают только реакции с положительными значениями ∆Е'. Если необходимо определить значение ∆Е' для нестандартных условий, можно воспользоваться уравнениями (5.2) и (5.10).