Основы биохимии - Филиппович Ю. Б. 1999
Белки
Форма белковых молекул
O форме белковых молекул судят на основании математической обработки данных, получаемых при ультрацентрифугировании белковых растворов. Для этой же цели широко используют метод двойного лучепреломления в потоке. Он основан на изменении оптической характеристики раствора белка, находящегося в движении, по сравнению с раствором, находящимся в покое: в первом происходит ориентация вытянутых белковых частиц по направлению движения раствора, и это сопровождается феноменом двойного лучепреломления. Кроме того, форма белковых частиц может быть установлена при непосредственном наблюдении в электронном микроскопе. Исчерпывающие данные о форме белковых молекул и топографии их поверхности дает рентгеноструктурный анализ.
С помощью этих методов выяснено, что белковые частицы бывают и шарообразными, и сильно удлиненными — до нитевидных образований. В большинстве случаев они имеют вытянутую форму и построены асимметрично. Степень асимметрии выражают отношением длинной оси частицы b к ее короткой оси а. Данные о степени асимметрии (b/а) молекул некоторых белков приведены в табл. 2, а их форма показана на рис. 16.
Белки, у которых степень асимметрии равна 1 (частицы шарообразны), довольно редки. Чаще всего эта величина бывает в пределах от 3 до 6 (эллипсовидные или палочкообразные молекулы). В некоторых случаях степень асимметрии достигает 200 и более (нитевидные белковые частицы). В общем, длина белковых молекул средней молекулярной массы лежит в пределах нескольких десятков, а толщина — нескольких нанометров.
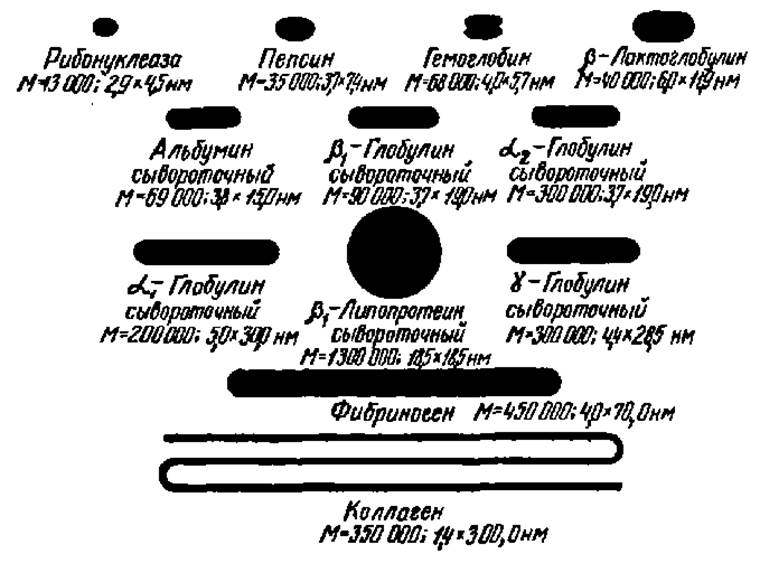
Рис. 16. Форма молекул некоторых белков
Под названием каждого белка указаны его молекулярная масса в дальтонах и размеры молекулы в нанометрах
Более поздние работы, в которых была детально раскрыта полная структура некоторых белков, показали, что белковые молекулы асимметричны во всех трех измерениях. Так, молекула миоглобина — одного из белков мышечной ткани (М = 17 600) — имеет размеры 2,5 х 3,5 х 4,5 нм (см. с. 71 и 72). Многим белкам, особенно ферментам, присуща многолопастная структура с наличием в их молекулах глубоких расщелин, выпячиваний и впадин, на дне которых располагаются функционально активные центры.