Основы биохимии - Филиппович Ю. Б. 1999
Белки
Молекулярная масса белков
Молекулярную массу белка измеряют различными физическими методами: гравиметрическим, вискозометрическим, осмометрическим, ультрафильтрационным, гельфильтрационным, электрофоретическим, оптическим. Полученную величину принято называть физическим значением молекулярной массы белка; она определяется с точностью в несколько сотен, а иногда и тысяч дальтон. У многих белков в настоящее время выяснена первичная структура, что дает возможность рассчитать молекулярную массу с точностью до сотых долей дальтона, т. е. получить химическое значение молекулярной массы белка. Обычно оперируют значениями физических молекулярных масс белков, варьирующих для всего спектра природных белков в очень широких пределах (табл. 3).
Таблица 3 Молекулярная масса, степень асимметрии молекул и изоэлектрические точки некоторых белков
Белок |
Молекулярная масса |
Степень асимметрии молекулы |
Изоэлектрическая точка |
Миоглобин кашалота |
17600 |
3,0 |
7,0 |
Пепсин |
35000 |
4,0 |
1,1 |
Альбумин яичный |
46000 |
4,4 |
4,6 |
Гемоглобин лошади |
68000 |
4,3 |
6,6 |
у-Глобулин человека |
160000 |
6,0 |
7,3 |
Каталаза |
250000 |
5,8 |
6,7 |
Фибриноген человека |
450000 |
17,5 |
5,4 |
Уреаза |
483000 |
4,3 |
4,9 |
Тиреоглобулин свиньи |
630000 |
9,2 |
4,5 |
Антипневмококковый сывороточный глобулин лошади |
920000 |
20,1 |
4,4 |
гемоцианин улитки |
6600000 |
4,8 |
4,7 |
Определение молекулярной массы белка гравиметрическим методом ведут в аналитических ультрацентрифугах (рис. 15). Принцип количественного изучения размеров взвешенных частиц в центробежном поле А. В. Думанский выдвинул еще в 1913 г., и он же пытался определить размеры частиц по скорости оседания в обычных лабораторных центрифугах. Однако первая ультрацентрифуга с оптической приставкой, позволяющей наблюдать и фотографировать процесс седиментации (оседания) частиц, была построена шведским физико-химиком Т. Сведбергом десятью годами позже. При вращении ее ротора развивалось центробежное ускорение, превышающее ускорение силы тяжести всего в 150 раз.
В современных типовых ультрацентрифугах это превышение достигает 300000, а в специализированных — 900000—1200000. Данную величину называют относительным центробежным ускорением или фактором разделения: Фр = ω2r/g, где ω — угловая скорость ротора, рад/с; r — расстояние от центра ротора до середины ячейки с раствором белка, см; g — ускорение силы тяжести, см/с2. Таким образом, например, запись 100 000 g означает, что центробежное ускорение в месте расположения ячейки в роторе ультрацентрифуги превышает ускорение силы тяжести в 100000 раз. Величина достигаемого в ультрацентрифуге фактора разделения — одна из важнейших ее характеристик.
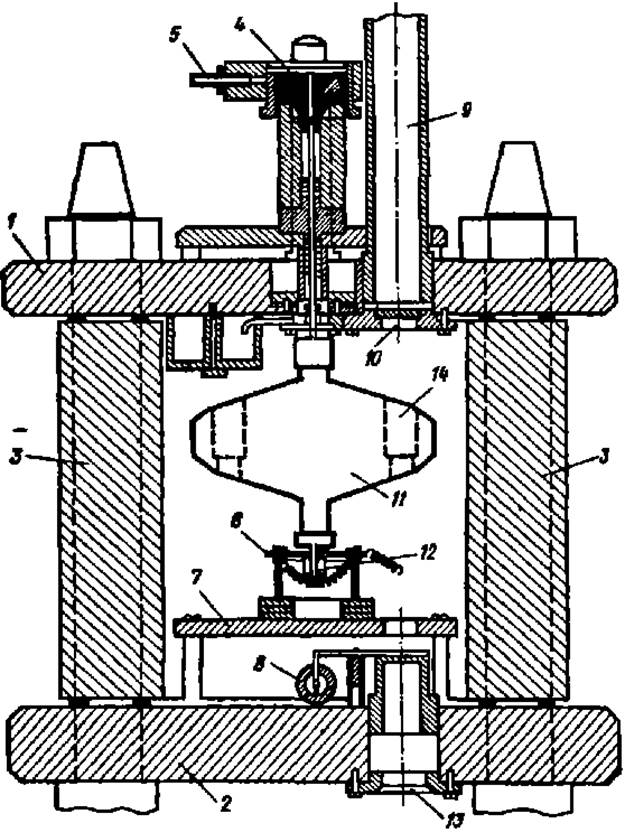
Рис. 15. Устройство ультрацентрифуги:
1 и 2 — верхняя и нижняя стальные плиты; 3 — стенка стального цилиндра; 4 — стальная игла с подвешенным ротором (ІІ); S — привод ротора; 6 — термопара; 7 — монтажная плита; 8 — электромагнитный затвор; 9 — металлический патрубок, соединяющий вакуумную камеру с фотоаппаратом; 10, 13 — верхнее и нижнее кварцевые окна; 12 — стальной хвостовик ротора в направляющей втулке; 14 — гнездо ротора для ячейки, в которой наблюдают оседание белковых частиц
Исследуемый раствор белка помещают в небольшую прозрачную для световых лучей ячейку, которую вставляют в специальное гнездо ротора. Молекулы белка в этой ячейке под действием центробежной силы, развиваемой при вращении ротора, постепенно оседают на дно. Фотоприставка к ультрацентрифуге позволяет делать снимки содержимого ячейки через определенные промежутки времени и определять таким образом скорость оседания белковых частиц. Определение молекулярной массы белка методом ультрацентрифугирования ведут двумя способами: по скорости седиментации белковых молекул и по седиментационному равновесию.
В первом случае измеряют скорость перемещения в ячейке ультрацентрифуги границы растворитель — белок, относя ее к величине развиваемого центробежного ускорения т. е. находят константу седиментации: s = v/ω2r, где V — скорость перемещения границы растворитель — белок, см/с, ω2r — центробежное ускорение, см/с2. Размерность s выражают в секундах. Величина константы седиментации, равная 10-13 с, принята за единицу и названа сведбергом (S, или Св). Вводя значение экспериментально найденной константы седиментации в формулу, рассчитывают молекулярную массу белка:
![]()
где R — газовая постоянная; Т — температура (по шкале Кельвина); D — коэффициент диффузии; р — плотность растворителя; σ — плотность белковых частиц.
Во втором случае измеряют концентрацию белка с1 и с2 в двух точках ячейки на расстоянии х1 и х2 от центра ротора в тот момент, когда после определенного срока работы ультрацентрифуги в ячейке установится седиментационное равновесие, т. е. равенство между числом оседающих и диффундирующих в обратном направлении молекул белка. Расчет молекулярной массы белка ведут по формуле, вводя в нее экспериментально найденные значения с1, с2, х1 и х2:
![]()
где to — угловая скорость, а остальные обозначения те же, что в предыдущей формуле.
Из остальных перечисленных выше физических методов определения молекулярной массы белков широко применяют еще два: гельфильтрационный и электрофоретический.
Первый состоит либо в определении объема элюента, необходимого для выноса белка из колонки с гелем сефадекса (Ve), и соотнесении его со свободным объемом колонки (V0), либо в установлении длины пробега белка в тонком слое сефадекса на пластинке. И тот и другой показатели связаны зависимостью со значением молекулярной массы белка. Пользуясь калибровочными графиками, построенными по Ve/V0 или по длине пробега маркерных (т. е. с известной молекулярной массой) белков, находят молекулярную массу исследуемого белка.
Второй метод состоит в измерении пути, пройденного белком при электрофорезе в полиакриламидном геле; здесь тоже существует зависимость между молекулярной массой белка и длиной пробега. Еще более отчетливо она выявляется при сопоставлении торможения пробега белка при переходе от электрофореза его в геле с меньшим содержанием акриламида к электрофорезу в геле с большим содержанием акриламида. В этом случае также строят калибровочные графики по маркерным белкам и по ним находят молекулярную массу неизвестного белка.
Другие физические методы определения молекулярных масс белков: по светорассеянию, вязкости и осмотическому давлению белковых растворов, по данным рентгеноструктурного анализа и электронной микроскопии — используют крайне редко.
Некоторое распространение имеет химический метод. Сущность его заключается в количественном определении в составе белка элемента или аминокислоты, содержащихся в нем в наименьшем количестве. Затем проводят расчет минимальной молекулярной массы, исходя из того, что в молекуле белка не может быть менее одного атома элемента или одного аминокислотного остатка. Однако об истинной молекулярной массе белка этот метод не всегда дает правильное представление. Например, гемоглобин (белок крови человека и животных) содержит 0,34% железа. Так как в гемоглобине не может содержаться менее одного атома Fe, то минимальная молекулярная масса гемоглобина рассчитывается по пропорции: 0,34 части Fe соответствует 100 частям белка, 56 частей Fe (один атом) соответствуют х частям белка, отсюда х = (56 ∙ 100)/ 0,34 = 16 500. Истинная молекулярная масса гемоглобина равна 66000—68000, т. е. учетверенной минимальной молекулярной массе. Это естественно, так как молекула гемоглобина содержит 4 атома Fe. Таким образом, химический метод определения молекулярной массы белков в определенной мере условен.