Основы биохимии - Филиппович Ю. Б. 1999
Белки
Аминокислотный состав белков
Одним из наиболее распространенных методов исследования химического состава белковых тел является гидролиз. Белок нагревают с растворами кислот или щелочей при температуре 100—105° С примерно в течение суток. Чаще всего используют 20%-ный раствор НСl, обеспечивающий глубокий гидролиз белка с минимальным разрушением аминокислот, из которых он построен. В последнее время для ускорения реакции гидролиза белков используют иммобилизованные (закрепленные на носителях) протеолитические ферменты и ионообменные смолы, что обеспечивает полное соответствие содержания аминокислот в гидролизате соотношению их в белке.
Впервые А. Браконно (1820), используя кислотный гидролиз, выделил из белка (желатины) аминокислоту — глицин, а Н. Любавин (1871) установил, что при ферментативном гидролизе белки распадаются до аминокислот. В последующее время было доказано, что аминокислоты являются почти единственными продуктами гидролиза белков. Первая аминокислота была получена из сока спаржи в 1806 г. С тех пор из растений, животных и микроорганизмов выделено несколько сотен различных аминокислот; в составе белков их обнаружено около 30, остальные существуют в свободном виде.
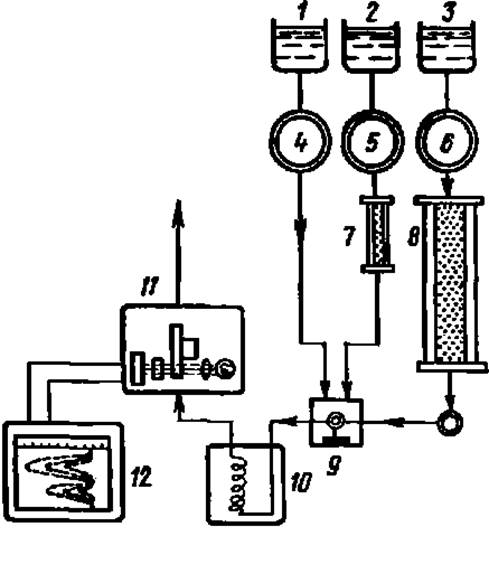
Рис. 17. Принципиальная схема определения аминокислот в гидролизате с помощью автоматического анализатора:
1, 2, 3 — сосуды с раствором нингидрина, буферным раствором для малой колонки, буферным раствором для большой колонки соответственно, 4. 5, 6 — насосы для подачи соответствующих растворов; 7, S — малая и большая хроматографические колонки; 9 — смеситель; 10 — реакционная баня; 11 — фотоэлектроколориметр; 12 — самописец
В настоящее время фракционирование аминокислот белковых гидролизатов ведут методом ионообменной хроматографии. В колонках с ионообменными смолами удается разделить набор белковых аминокислот на составляющие в течение 1,5—2 ч. Поток проявителя из колонки направляют в смеситель, куда поступает раствор нингидрина, реагируя с которым каждая из аминокислот образует сине-фиолетовый Руэмана. Подробно эта реакция описана в практикуме по общей биохимии1. Краска подается далее в фотоэлектроколориметр, связанный с самописцем, на ленте которого плотность окраски записывается в виде пиков; высота и ширина их соответствуют содержанию аминокислоты в гидролизате белка. Будучи скомпонованы в единый агрегат, перечисленные элементы и дополнительные устройства к ним образуют прибор, получивший название автоматического анализатора аминокислот (рис. 17). Этот прибор работает автоматически по заданной программе и определяет содержание аминокислот в гидролизате белка (включая и выполнение необходимых расчетов) за несколько часов почти без участия экспериментатора. Если анализатор оборудован компьютером, то на это уходит не более 2 ч.
1 Здесь и далее даны ссылки на «Практикум по общей биохимии» Ю. Б. Филипповича, Т. А. Егоровой и Г. А. Севастояновой. 2-е изд., М., 1982.
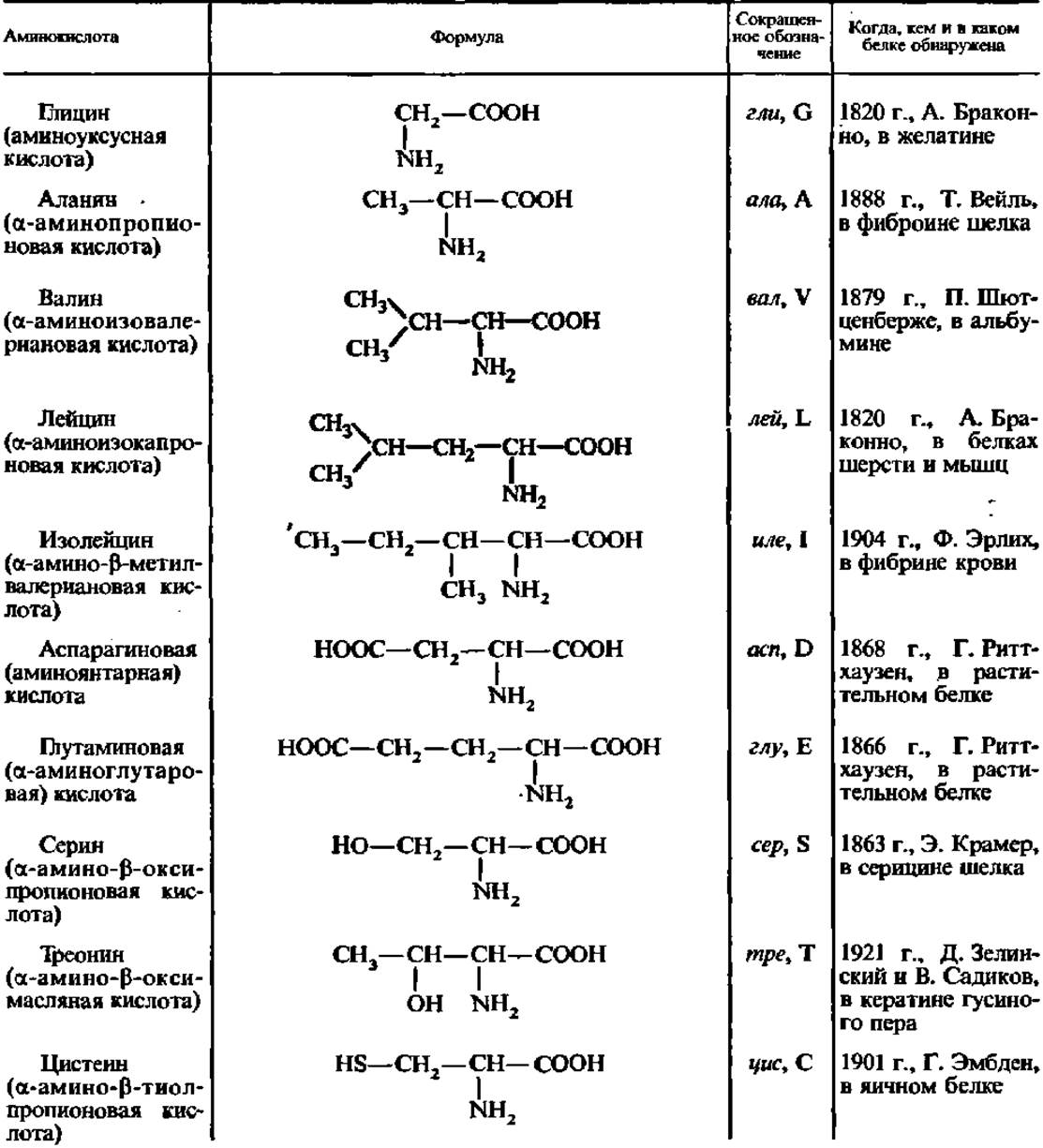
Найденные в белках аминокислоты принято делить на две категории: постоянно встречающиеся и иногда встречающиеся в белках. Постоянно встречающихся в белках аминокислот насчитывается 18. Их названия, формулы и сокращенные обозначения приведены в табл. 4.
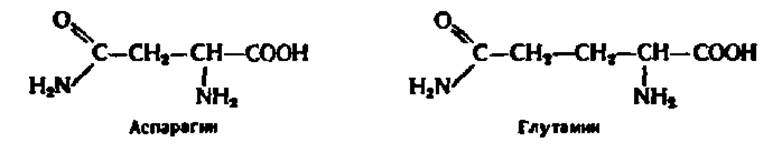
Кроме 18 аминокислот в состав белков постоянно входят еще два амида: амид аспарагиновой кислоты — аспарагин и амид глутаминовой кислоты — глутамин (сокращенно асн и глн, либо N и Q):
К группе иногда встречающихся в составе белков аминокислот принадлежат оксипролин (оксипирролидин-а-карбоновая кислота); оксилизин (а, ε-диамино-6-оксикапроновая кислота); орнитин (а, δ-диаминовалериановая кислота); 3,5-дииодтирозин; а-аминоизомасляная кислота; N-метил-N,N’-диметил- и N,N,N-триметиллизин; N-метил-, N,N'-диметил- и N,N'-диметиларгинин; у-карбоксиглутаминовая кислота (гла); ß-карбоксиаспарагиновая кислота (аса); 3-N-метилгистидин; N,N-диметилпролин; метиловые эфиры асп и глу и некоторые другие аминокислоты. Их структуры легко вывести исходя из формул, приведенных в табл. 4; строение орнитина, а-аминоизомасляной и у-карбоксиглутаминовой кислот таково:
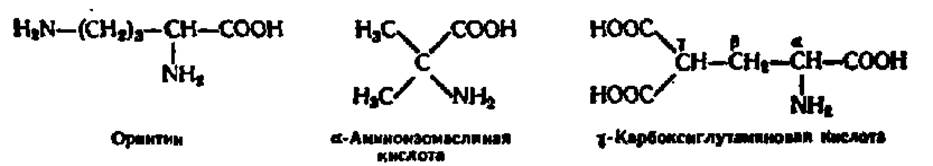
Таблица 4 Аминокислоты, постоянно встречающиеся в составе белков
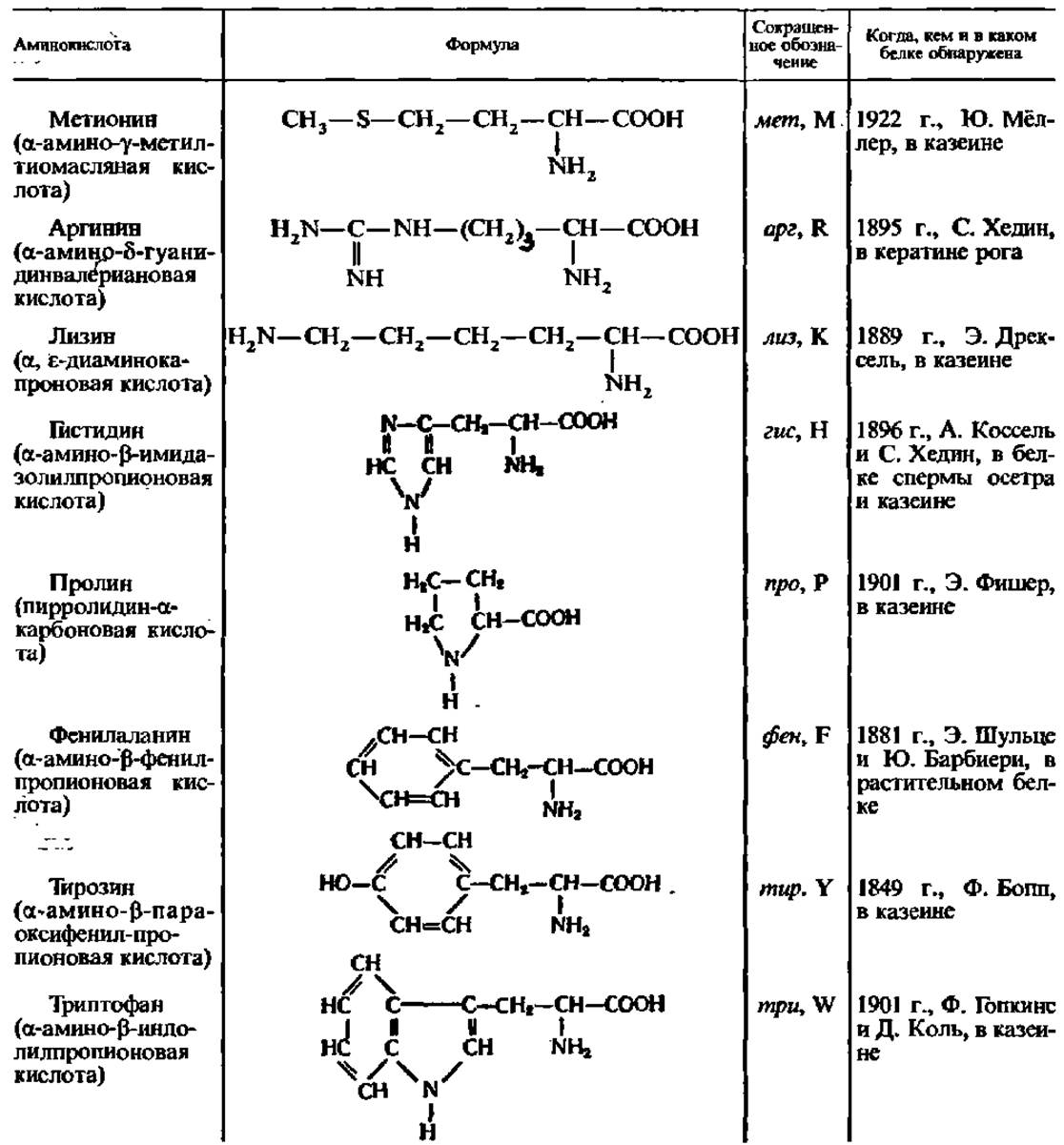
Важной особенностью белковых аминокислот является их оптическая активность. За исключением глицина, все они построены асимметрично и, следовательно, будучи растворены в воде или соляной кислоте, способны вращать плоскость поляризации света. Значение удельного вращения в большинстве случаев составляет от 20 до 30° влево или вправо и лишь иногда выражается большими или меньшими величинами. Из 17 оптически деятельных белковых аминокислот 7 характеризуются в водных растворах правым (+) и 10 левым (—) вращением, но все они относятся к L-ряду.
Лишь в составе гликопротеинов клеточных стенок бактерий и в антибиотиках обнаружены D-a-аминокислоты: фен, глу, ала, лей, вал, про и др.
Тонкая структура аминокислот изучена методом рентгеноструктурного анализа. При его посредстве удалось построить объемные модели аминокислот; некоторые из них показаны на рис. 18.
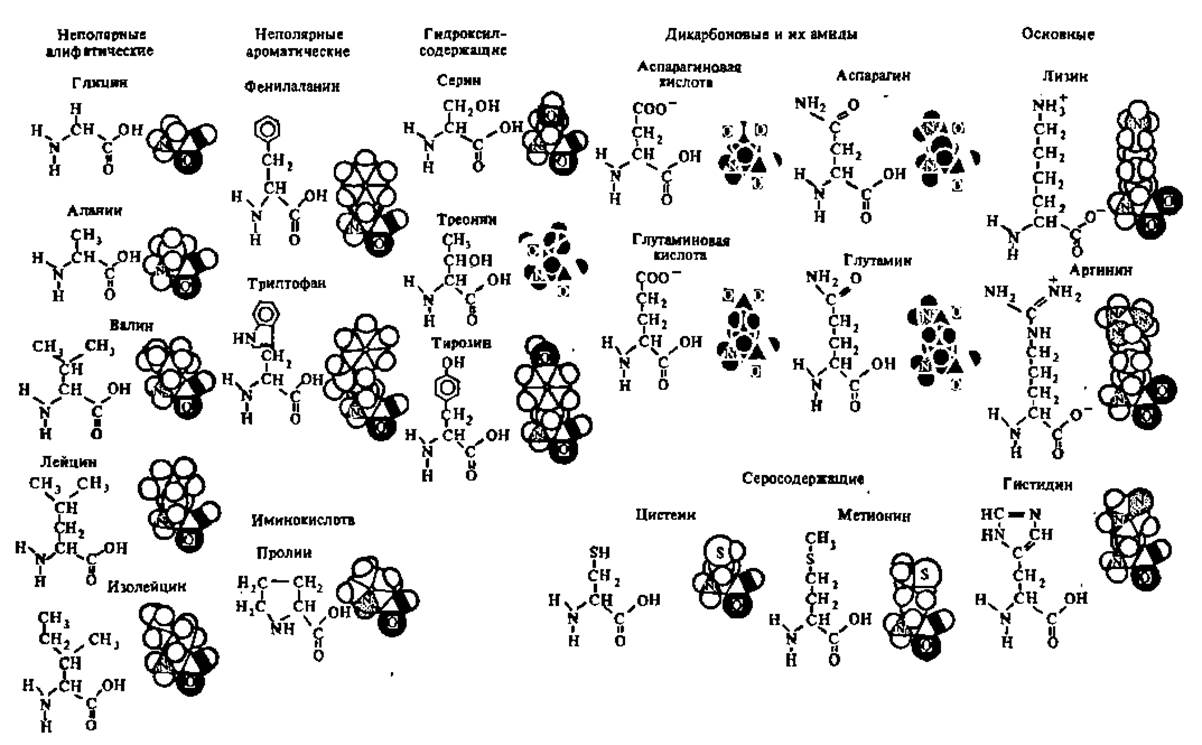
Рис. 18. Объемные модели аминокислот. Приведенные формулы аминокислот в какой-то мере — имитируют пространственные модели
Степень детализации представлений о пространственной структуре аминокислот иллюстрирует рис. 19, на котором приведены данные о межатомных расстояниях и валентных углах между атомами в кристаллической модификации глицина, полученные методом рентгеноструктурного анализа. Аналогичные данные этим же методом получены для всех постоянно встречающихся в составе белков аминокислот. На них основаны современные представления о тонком строении полипептидной цепи в высших структурах белковых молекул.
Рентгеноструктурный анализ кристаллов аминокислот показал, что ведущая роль в возникновении структуры кристаллов аминокислот и ее поддержании принадлежит разветвленной системе водородных связей, возникающих между молекулами аминокислоты, закономерно расположенными в структуре кристалла (рис. 20). Свойство аминокислот образовывать водородные связи сохраняется и тогда, когда аминокислота является составной частью полипептидной цепи. Вследствие этого возникновение а-спиральной конформации (см. ниже) полипептидной цепи можно рассматривать как процесс внутренней кристаллизации полипептида.
Если расценить 18 постоянно встречающихся в составе белков а-аминокислот с точки зрения их совокупных химических свойств, то поражает крайнее разнообразие взаимодействий, возможных между их радикалами.
Радикалом аминокислоты принято называть группировку атомов в ее молекуле, связанную с а-углеродным атомом и не принимающую участия в формировании полипептидной цепи. Химическая природа радикалов (табл. 4) позволяет осуществлять реакций солеобразования (по NH2- и СООН- группам), окисления и восстановления (по HS- и SS-группировкам), алкилиро вания, ацилирования и этерификации группам), амидирования (по COOH-группам), нитрования и галогенирования (по ароматическим ядрам), дезаминирования посредством азотистой кислоты (по NH2-гpyппaм), фосфорилирования и сульфатирования (по ОН-группам), сочетания с диазосоединениями (по ароматическим и гетероциклическим ядрам) и т. п. Все эти химические процессы являются основой для химической изменчивости белковых препаратов, при обработке их соответствующими реагентами. Некоторые из указанных реакций протекают в живых организмах (солеобразование, окисление, восстановление, ацилирование, этерификация, амидирование, фосфорилирование).
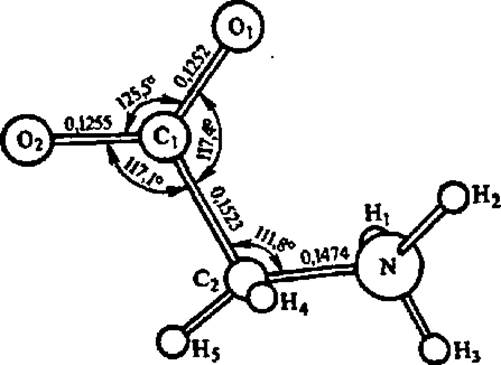
Рис. 19. Строение молекулы глицина в структуре а-глицина
Эта модификация глицина возникает в процессе его кристаллизации из воды при медленном испарении последней; расстояния между атомами даны в нанометрах
![]()
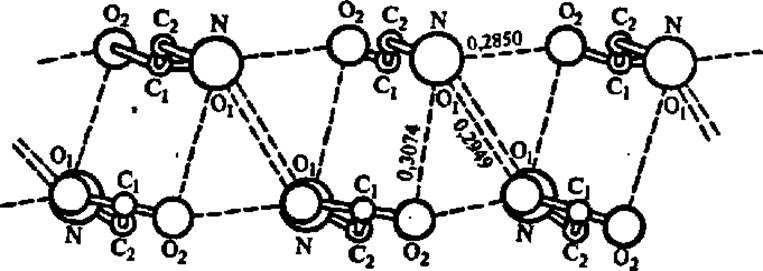
Рис. 20. Водородные связи в структуре а-глицина
Каждая водородная связь показана пунктирной линией, атом кислорода О, в верхней группе молекул глицина экранирован атомом азота. Расстояния между атомами даны в нанометрах
Физические свойства радикалов аминокислот также весьма разнообразны. Это касается прежде всего длины радикалов и их объема (табл. 5).
Таблица 5 Характеристика радикалов аминокислот
Аминокислота |
Длина, ям |
Объем, нм1 |
Аминокислота |
Длина, нм |
Объем, нм3 |
Глицин |
0,15 |
0,0051 |
Треонин |
0,40 |
0,0631 |
Аланин |
0,28 |
0,0322 |
Цистеин |
0,43 |
0,0579 |
Валин |
0,40 |
0,0863 |
Метионин |
0,69 |
0,1121 |
Лейцин |
0,53 |
0,1134 |
Аргинин |
0,88 |
0,1257 |
Изолейцин |
0,53 |
0,1134 |
Лизин |
0,77 |
0,1210 |
Аспаргиновая кислота |
0,50 |
0,0584 |
Гистидин |
0,65 |
0,0890 |
Глутаминовая кислота |
0,63 |
0,0855 |
Тирозин |
0,77 |
0,1388 |
Серин |
0,38 |
0,0360 |
Фенилаланин |
0,69 |
0,1366 |
Триптофан |
0,81 |
0,1755 |
От длины, объема и взаиморасположения радикалов аминокислот, составляющих белковую молекулу, зависят объем, форма и рельеф поверхности белковой частицы. Радикалы гли, ала, вал, лей, иле, фен и тpи неполярны, а остальных аминокислот — полярны в той или иной мере. Это определяет степень растворимости белков в различных растворителях. Таким образом, разнообразие радикалов аминокислот по химической природе и физическим свойствам тесно связано с полифункциональностью и специфическими особенностями белковых тел. Именно эти свойства выделяют белки из ряда других природных биополимеров и наряду с другими особыми их качествами (биокаталитическая активность, образование сложных комплексов с другими биополимерами, способность образовывать надмолекулярные структуры, денатурация и ренатурация, динамические переходы между глобулярным и фибриллярным состоянием, неисчерпаемое разнообразие и вместе с тем высокая специфичность структуры молекул и т. п.) обеспечивают им роль материальной основы жизненных процессов.
Если по качественному составу все разнообразие структурных элементов белковой молекулы укладывается в основном в 18 перечисленных выше а-аминокислот, то общее количество аминокислотных остатков в белковой молекуле изменяется в широких пределах. Принимая среднюю молекулярную массу аминокислотного остатка равной 115, легко подсчитать коэффициент поликонденсации аминокислот при образовании белковой молекулы. Так, для белка с М = 17000 он будет равен (17000:115) примерно 148, для белка с М = 44000 — примерно 380 и т. п.
Таким образом, одни и те же 18 аминокислот и два амида — аспарагин и глутамин — многократно повторяются в белковой молекуле, причем каждая в разной пропорции (табл. 6).
Длительное время считали, что максимальная длина полипептидной цепи ограничена примерно тысячью аминокислотных остатков, как, например, у ДНК-полимераз и аминоацил-тРНК-синтетаз, обладающих молекулярной массой около 100 тыс. Да. Однако в течение последнего десятилетия ситуация резко изменилась: была расшифрована первичная структура ß- и ß'-субъединиц ДНК-зависимой и РНК-полимеразы из 1342 и 1407 (Ю. А. Овчинников и др., 1981), фактора VIII свертывания крови из 2332 (Г. Вехар и др., 1984) и субъединицы тиреоглобулина из 2750 (М. Люк, 1985) аминокислотных остатков в единой полипептидной цепи. Но и это не предел: недавно выяснена (М. Koenig et al., 1988) последовательность 3685 аминокислотных остатков в дистрофине — палочковидном мембранном белке цитоскелета мышечных клеток человека. Таким образом, некоторые белки оказались поистине гигантскими полипептидами. Вместе с тем длина непрерывной полипептидной цепи у подавляющего большинства белков колеблется от нескольких десятков до нескольких сотен аминокислотных звеньев, даже если их М намного превышает 100 тыс. Да: они составлены из полипептидных цепей (субъединиц) сравнительно небольших размеров.
В настоящее время детально изучены качественный состав и количественное содержание аминокислот у многих сотен белков. Сопоставление этих данных позволило установить некоторые закономерности. Как правило, такие аминокислоты, как лей, лиз, асп и глу, содержатся в белках в значительных (10—15%) количествах. Наоборот, доля три, цис и гис редко превышает 1,5—2%. Содержание остальных аминокислот колеблется обычно между приведенными выше крайними величинами. Иле в белках почти всегда меньше, чем лей; в таких же соотношениях находится содержание в белках гис и арг, тре и сер, а также асп и глу.
Таблица 6 Аминокислотный состав некоторых белков (А — процентное содержание аминокислоты, Б — число аминокислотных остатков в молекуле)
|
Аминокислота |
Миоглобин человека |
Пепсин |
Альбумин яичный |
Гемоглобин человека |
||||
А |
Б |
А |
Б |
А |
Б |
А |
Б |
|
Аланин |
5,7 |
12 |
4,5 |
18 |
6,7 |
35 |
9,0 |
72 |
Глицин |
6,3 |
15 |
8,1 |
38 |
3,1 |
19 |
4,2 |
40 |
Валин |
5,3 |
7 |
7,1 |
21 |
7,1 |
28 |
10,3 |
62 |
Лейцин |
12,2 |
17 |
10,4 |
27 |
9,2 |
32 |
14,0 |
72 |
Изолейцин |
5,0 |
8 |
10,0 |
28 |
7,0 |
25 |
0 |
0 |
Пролин |
4,0 |
5 |
4,9 |
15 |
3,6 |
14 |
4,8 |
28 |
Фенилаланин |
6,2 |
7 |
6,7 |
14 |
7,7 |
21 |
7,3 |
30 |
Тирозин |
2,4 |
2 |
9,4 |
18 |
3,7 |
9 |
2,9 |
12 |
Триптофан |
3,6 |
2 |
3,5 |
6 |
1,2 |
3 |
1,9 |
6 |
Серин |
4,6 |
7 |
13,2 |
44 |
8,2 |
36 |
4,4 |
32 |
Треонин |
2,9 |
4 |
9,5 |
28 |
4,0 |
16 |
5,2 |
32 |
Цистин |
0 |
0 |
— |
— |
0,5 |
2 |
0 |
0 |
Цистеин |
0 |
0 |
1,5 |
4. |
1,4 |
5 |
1,0 |
6 |
Метионин |
2,5 |
3 |
2,1 |
5 |
5,2 |
16 |
1,2 |
6 |
Аргинин |
2,7 |
2 |
1,0 |
2 |
5,7 |
15 |
3,3 |
12 |
Гистидин |
8,2 |
9 |
0,5 |
1 |
2,4 |
7 |
8,8 |
38 |
Лизин |
16,1 |
20 |
0,4 |
1 |
6,3 |
20 |
9,6 |
44 |
Аспарагиновая кислота |
9,2 |
8 |
16,6 |
44 |
9,3 |
32 |
9,6 |
30 |
Глутаминовая кислота |
17,3 |
14 |
11,3 |
27 |
16,5 |
52 |
6,6 |
24 |
Аспарагин |
— |
3 |
— |
— |
— |
— |
— |
20 |
Глутамин |
— |
7 |
— |
— |
— |
— |
— |
8 |
Итого: |
115,3 |
153 |
120,7 |
341 |
108,8 |
387 |
105,0 |
574 |
Примечание. Цистив, отмеченный в таблице, возникает в белке при взаимодействии двух остатков цистеина с образованием дисульфидного мостика (см. ниже) и не рассматривается как самостоятельная белковая аминокислота.
Приведенные выше закономерности касаются белков с полным набором аминокислот. Необходимо иметь в виду, что некоторые белки характеризуются совершенно специфическим аминокислотным составом. Так, например, сальмин — протамин из молок семги, на 85,2% состоит из арг, на 9,1% — из сер и в небольших количествах содержит ала, гли, вал, иле и про. Фиброин шелка тутового шелкопряда содержит (в %) 29,7 ала, 43,6 гли, 12,8 тир, 16,2 сер, тогда как процентное содержание 11 других аминокислот незначительно.
Свойства того или иного белка в значительной мере определяются набором и соотношением в нем аминокислот. Некоторые из таких зависимостей известны. Так, изоэлектрическая точка белка (см. табл. 3), т. е. pH среды, при котором отсутствует перенос белка в электрическом поле, зависит от соотношения катионных и анионных групп. Сравнительная оценка изоэлектрических точек 300 белков показала, что их распределение подчиняется почти симметричной одновершинной кривой с пиком при pH 4,5. Это свидетельствует о том, что у большинства природных белков дикарбоновые аминокислоты преобладают над диаминокислотами, сообщая белкам суммарный отрицательный заряд. Высокое содержание про, гли и осп в белке способствует его хорошей растворимости в спирте; большое число полярных групп в молекуле белка приводит к появлению эластичности и т. п.