Основы биохимии - Филиппович Ю. Б. 1999
Белки
Пептиды
Одним из важных химических свойств а-аминокислот, зависящим от одновременного присутствия в молекуле аминной и карбоксильной групп, является их способность в определенных условиях образовывать пептиды. Схема этого процесса, протекающего по типу реакции поликонденсации, такова:
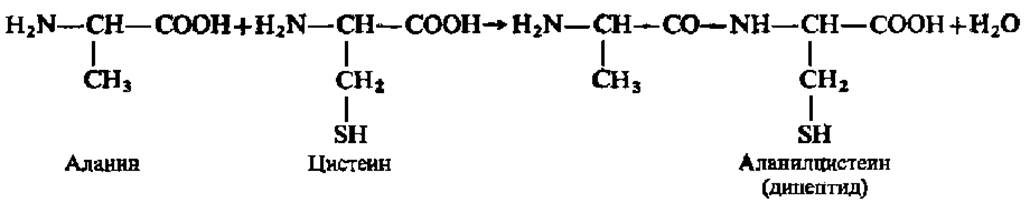
В действительности в организме процесс идет много сложнее. При изучении обмена белков эта реакция будет рассмотрена детально. Указанная реакция образования пептидов из аминокислот имеет большое значение для понимания химического строения белковых тел.
В результате реакции поликонденсации аминокислот можно получить соединения, составленные из многих аминокислотных остатков с очень высокими молекулярными массами. Такие соединения называют полипептидами, а —СО—NH-группировки в них — пептидными группами или пептидными связями. Пептиды могут быть получены также при неполном гидролизе белков.
Так как аминокислоты в составе пептидов находятся в форме ацилов, то в названии пептида им придается характерное для ацилов окончание -ил. Название концевой аминокислоты со свободной карбоксильной группой оставляют без изменений. Наименование пептида начинают с аминокислоты, сохранившей свободную а-аминогруппу.
Термин пептиды сейчас утратил свое первоначальное значение, так как когда-то под пептидами понимали конечные продукты переваривания белков, т. е. по существу —аминокислоты. Поэтому логично было продукты переваривания, составленные из двух аминокислотных остатков (пептидов), называть дипептидами, а из многих — полипептидами. Гораздо точнее пептиды именовать гетерополиаминокислотами, т. е. соединениями, составленными из того или иного числа различных аминокислот. Однако термин пептиды прочно вошел в химию белков, но в новом значении.
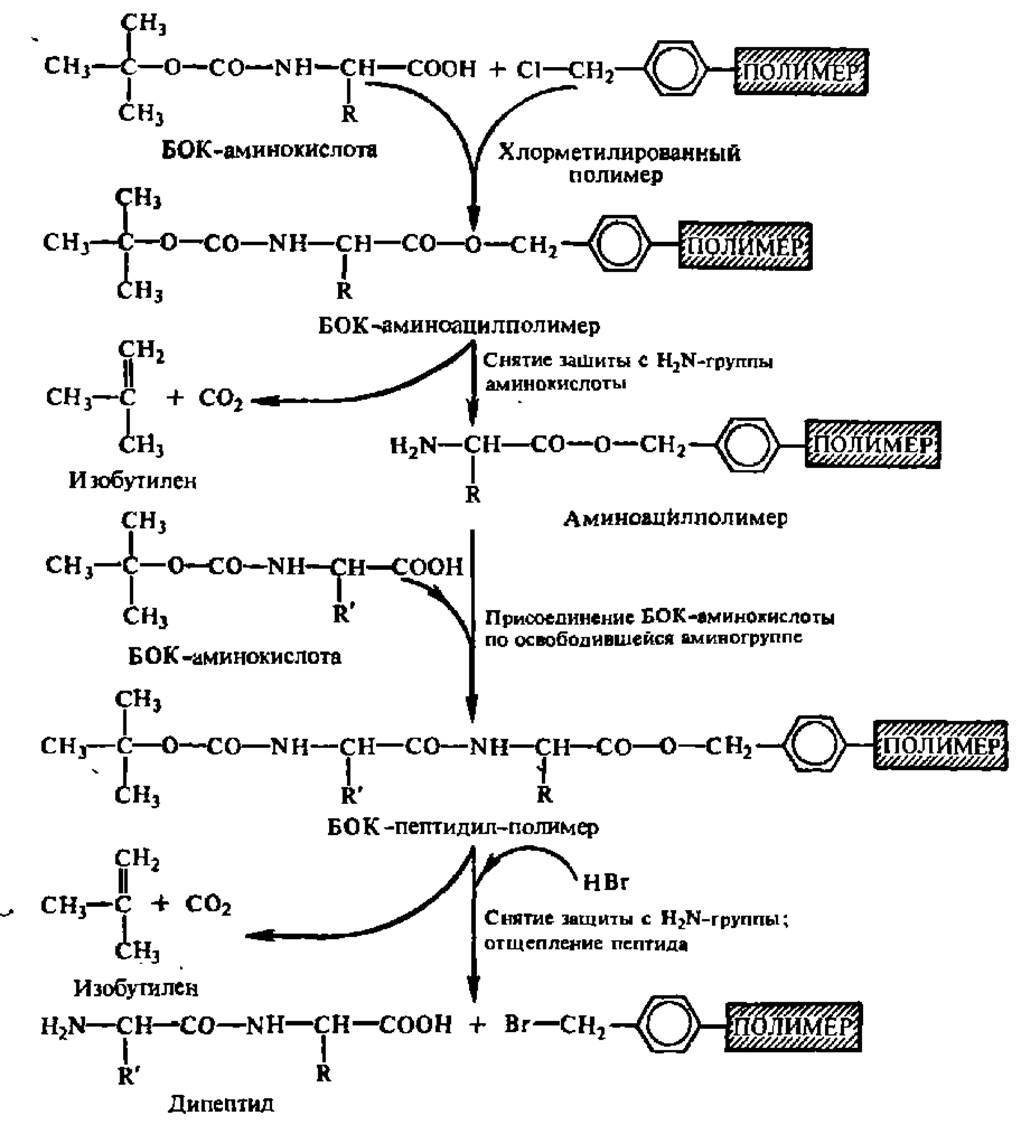
Рис. 21. Схема твердофазного синтеза пептидов и белков
В лабораторных условиях пептиды могут быть получены разнообразными методами, общей чертой которых является обязательная защита в одной из реагирующих аминокислот аминной, а в другой — карбоксильной группы, с тем чтобы они могли вступить в реакцию конденсации только лишь по оставшейся свободной (или активированной в результате присоединения химического реагента) карбоксильной (СООН-) или аминной (NH2-) группе. Наибольшую известность приобрел метод твердофазного синтеза пептидов, предложенный Р. Меррифилдом (рис. 21). СООН-группу исходной аминокислоты здесь защищают присоединением к полимеру, a NH2-гpyппy присоединяемой аминокислоты —трет-изобутилоксикарбонильным (БОК) радикалом. Метод поддается автоматизации, и на его основе создан автоматический синтезатор, при посредстве которого синтезируют не только пептиды, но и белки.
Из природных источников выделено несколько сотен индивидуальных пептидов и во многих случаях детально изучены их строение, свойства и биологическая активность. Приведем несколько примеров.
Глутатион (у-глутамилцистеинилглицин, у-глу-цис-гли)—один из наиболее широко распространенных внутриклеточных пептидов, принимающий участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны:
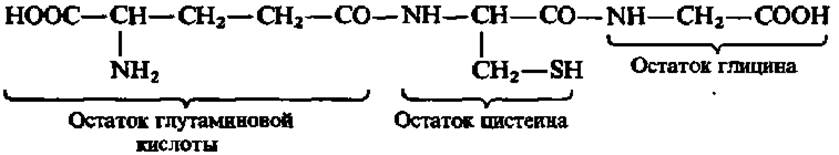
Глутатион открыт Ф. Іопкинсом в 1921 г. Он представляет собой кристаллический порошок с tпл= 190—192° С. Из раствора в 0,5 н. H2SО4выпадает
в виде нерастворимого меркаптида меди при добавлении Сu2О.
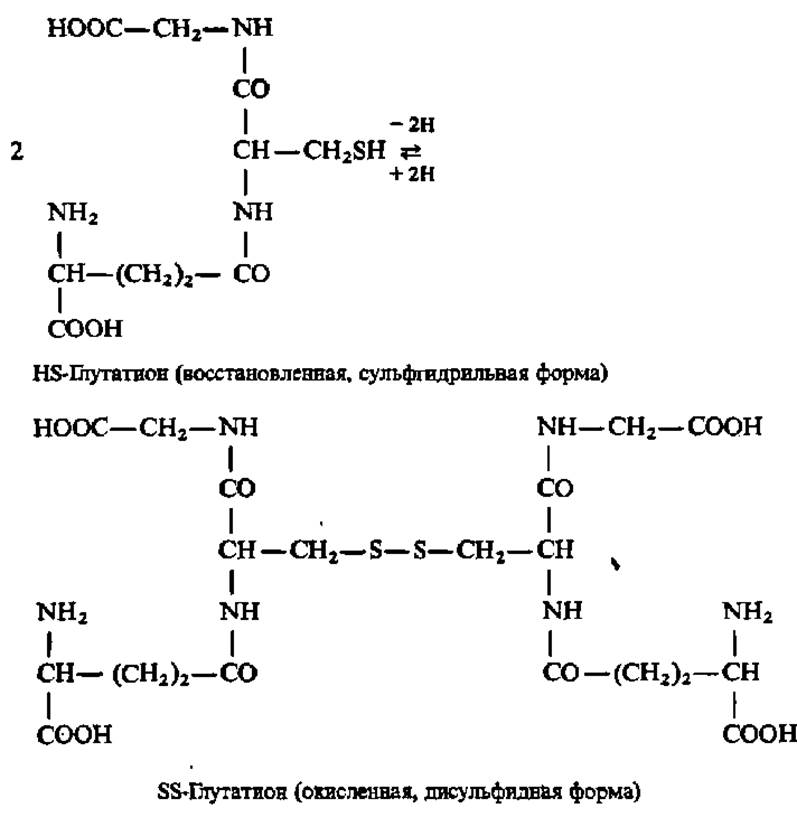
Приведенная выше формула соответствует так называемому восстановленному глутатиону (HS-глутатиону). В клетке наряду с восстановленной формой глутатиона всегда присутствует окисленная форма (SS-глутатион), переходящая в восстановленную при посредстве фермента-глутатионредуктазы:
Офтальмовая кислота (у-глутамил-а-аминобутирилглицин) — антагонист глутатиона, столь же широко распространена в природе, как и сам глутатион:
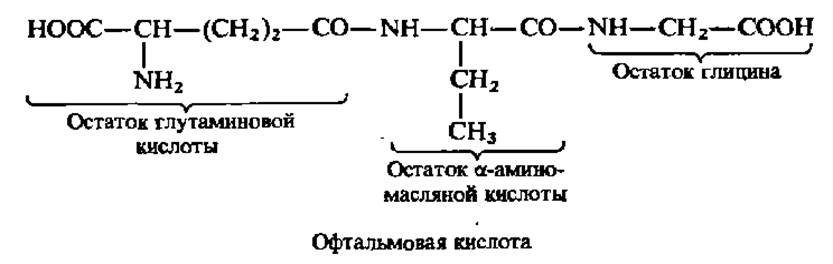
Присутствуя в клетках в ничтожных количествах, составляющих от 0,1 до 0,001 концентрации глутатиона, офтальмовая кислота действует как ингибитор в процессах, идущих с участием глутатиона.
Карнозин (ß-аланилгистидин; β-ала-гис) — пептид, содержащийся в мышцах животных:
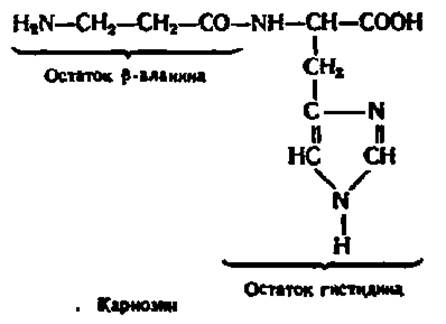
Он препятствует накоплению и устраняет продукты перекисного окисления липидов, участвует в поддержании буферной емкости мышечного сока, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышце. Впервые выделил карнозин из мышечной ткани и выяснил его строение В. С. Гулевич.
Роль пептидов в процессах жизнедеятельности крайне многообразна. Многие из них служат гормонами (см. гл. XII), некоторые представлены сильнейшими ядами (яды змей, жаб, улиток, пауков, насекомых, высших грибов, микробов), мощными антибиотиками, рилизинг-факторами (способствуют синтезу и высвобождению гормонов), регуляторами клеточного деления, переносчиками молекул и ионов через биологические мембраны, регуляторами психической деятельности. Значительное число природных пептидов синтезировано; кроме того, искусственным путем получены сотни их аналогов, некоторые из которых обладают более сильным биологическим действием, нежели их натуральные предшественники. И те и другие находят широкое практическое применение. На рис. 22 приведено строение некоторых из них.