Основы биохимии - Филиппович Ю. Б. 1999
Белки
Структура белковой молекулы
Среди большого числа разнообразных гипотез лишь одна выдержала испытание временем — это полипептидная теория строения белковой молекулы, впервые предложенная Э. Фишером (1902) на базе выдвинутых А. Я. Данилевским идей о роли —СО—NН-связей в строении белка. Согласно этой теории белковые молекулы представляют собой гигантские полипептиды, построенные из нескольких десятков, а иногда и сотен остатков постоянно встречающихся в составе белков аминокислот (см. табл. 6).
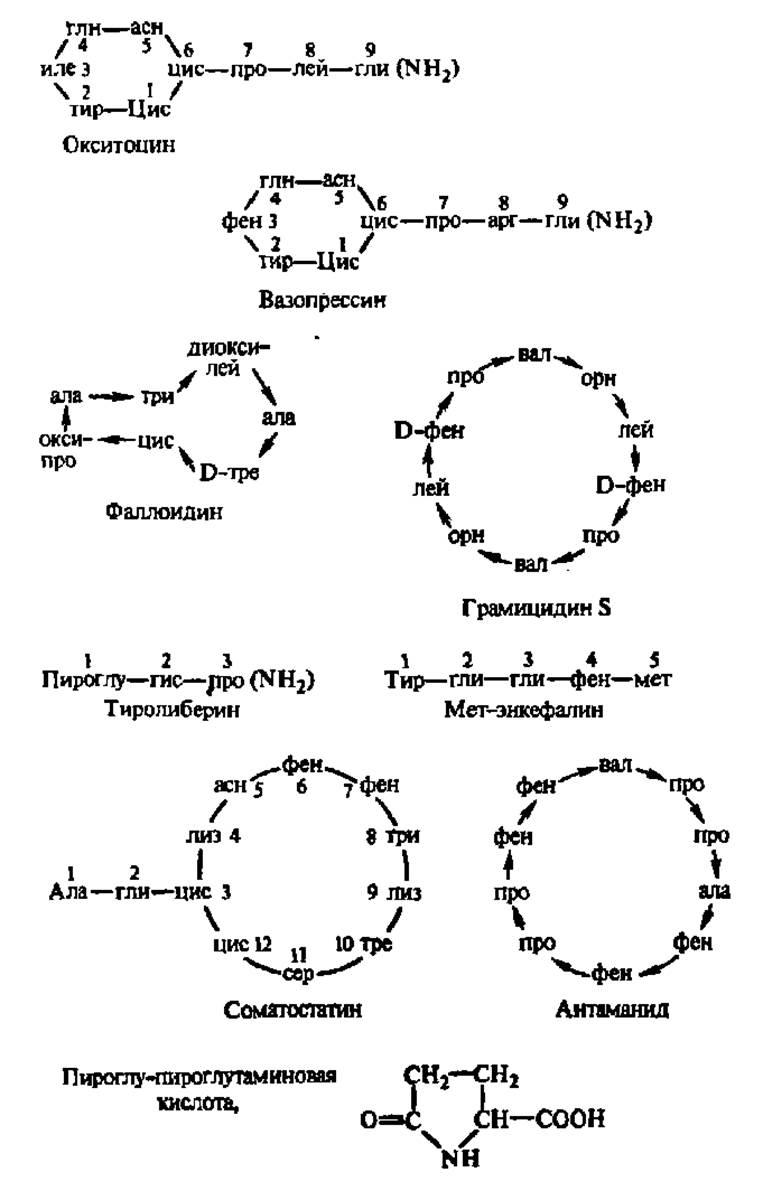
Рис. 22. Биологически активные пептиды
Расшифровку сокращений см. в табл. 4. Цифры около названий аминокислотных остатков обозначают их местоположение в молекуле, считая от N-конца к С-концу пептида. Стрелки начинаются от аминокислот, участвующих в образовании пептидной связи СООН-группами. Соседние остатки цистеина в циклах связаны дисульфидными мостиками. Группа NH2, заключенная в скобки, обозначает амидную группу. Подразумевается, что аминокислотные остатки соединены пептидными связями. Окситоцин и вазопрессин —гормоны задней доли гипофиза. Поступая в кровь, первый из них стимулирует сокращение мышечных волокон, расположенных вокруг альвеол молочных желез и мышц матки, второй — действует главным образом на гладкие мышцы кровеносных сосудов и участвует в регуляции водного баланса организма на уровне почек. Фаллоидин — ядовитое начало мухомора, вызывающее в ничтожных концентрациях гибель организма вследствие выхода ферментов в К+ из клеток; связь между остатками цистеина н триптофана в молекуле фаллоидина образована за счет взаимодействия сульфгидрильной группы и пиррольного кольца их радикалов. Грамицидин — антибиотик, действующий на многие грамположительные бактерии (пневмококки, стрептококки, стафилококки и др.), изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток. Тиролиберин — гормон, синтезирующийся в гипоталамусе и обеспечивающий высвобождение (отсюда его другое название — рилизинг-фактор), в возможно, и усиление биосинтеза в гипофизе другого гормона — тиротропина, который, в свою очередь, контролирует деятельность щитовидной железы и образование в ней гормона —тироксина; указанная иерархия В регуляции биосинтеза гормонов является ярким примером участия пептидов в регуляции обмена веществ. Meт-энкефалин — пентапетид, возникающий в нервной ткани и изменяющий (ослабляющий) болевые ощущения. Он связывается с рецепторами, на которые воздействуют наркотики, например морфин, и представляет собой эндогенное вещество психотропного действия. Соматостатин — пептид, тормозящий освобождение из передней доли гипофиза синтезируемого там гормона роста — соматотропного гормона. Антаманид — циклический декапептид, образующий с Na+, Са2+ и некоторыми другими катионами комплексы, которые являются прообразами структур, ответственных за перепое ионов через биологические мембраны
О том, что белковые молекулы построены именно таким образом, свидетельствуют следующие факты:
1. В нативных белках удается обнаружить очень небольшое число свободных NH2. и СООН-групп, так как концевые аминокислоты составляют ничтожную долю огромной полипептидной цепи белка.
2. При гидролизе белков идет постепенное высвобождение NH2 и СООН-групп в строгом соотношении 1:1, т. е. происходит распад пептидных—СО—NH-связей.
3. При взаимодействии биурета H2N—СО—NH—СО—NH2 с растворами щелочи и медного купороса развивается сине-фиолетовое окрашивание (реакция на наличие —СО—NH-связей); все белки дают яркую биуретовую реакцию, т. е. в их молекулах действительно есть большое число пептидных связей.
4. Полипептидная природа ряда белков доказана химическим синтезом.
5. При рентгеноструктурном анализе строения белков удается наблюдать непрерывную полипептидную цепь с характерным для исследуемого белка расположением в ней аминокислотных остатков.
6. Методы, используемые для определения чередования аминокислотных остатков в белках (см. ниже), однозначно свидетельствуют о последовательном (в ряде случаев — выборочном, селективном) расщеплении пептидных связей в составе именно полипептидных цепей.
Характерной особенностью строения полипептидной цепи является то, что атомы С и N в ее хребте, составленном из монотонно повторяющихся —СО—СН—NH-фрагментов, располагаются приблизительно в одной плоскости, в то время как атомы и радикалы > CHR-группировок направлены к этой плоскости под углом 109°28'. При этом в соседних аминокислотных остатках расположение атомов Н и радикалов противоположно. Сказанное ясно из рассмотрения рис. 23, А и структуры фрагмента полипептидной цепи молекулы инсулина (см. с. 54).
Другая особенность строения полипептидной цепи заключается в особом характере —СО—NH-связи. Расстояние между атомами С и N в пептидной связи 0,1325 нм, т. е. меньше нормального расстояния между а-углеродным атомом и атомом N той же цепи, равного 0,146 нм. Вместе с тем оно превышает расстояние между атомами С и N, соединенными двойной связью (0,127 нм). Таким образом, связь С и N в —СО—NH-группировке может рассматриваться как промежуточная между простой и двойной вследствие сопряжения π-электронов карбонильной группы со свободными электронами атома азота. Это определенным образом сказывается на свойствах полипептидов и белков: по месту пептидных связей легко осуществляется таутомерная перегруппировка, приводящая к образованию енольной формы пептидной связи, отличающейся повышенной реакционной способностью:
![]()
Третья своеобразная черта строения пептидной связи состоит в том, что все входящие в ее состав атомы располагаются в одной плоскости (рис. 23, В): такая конфигурация называется планарной (плоской) и поддерживается делокализацией электронной плотности двойной связи карбонильной группы на Связь между углеродом и азотом (рис. 23, Б).
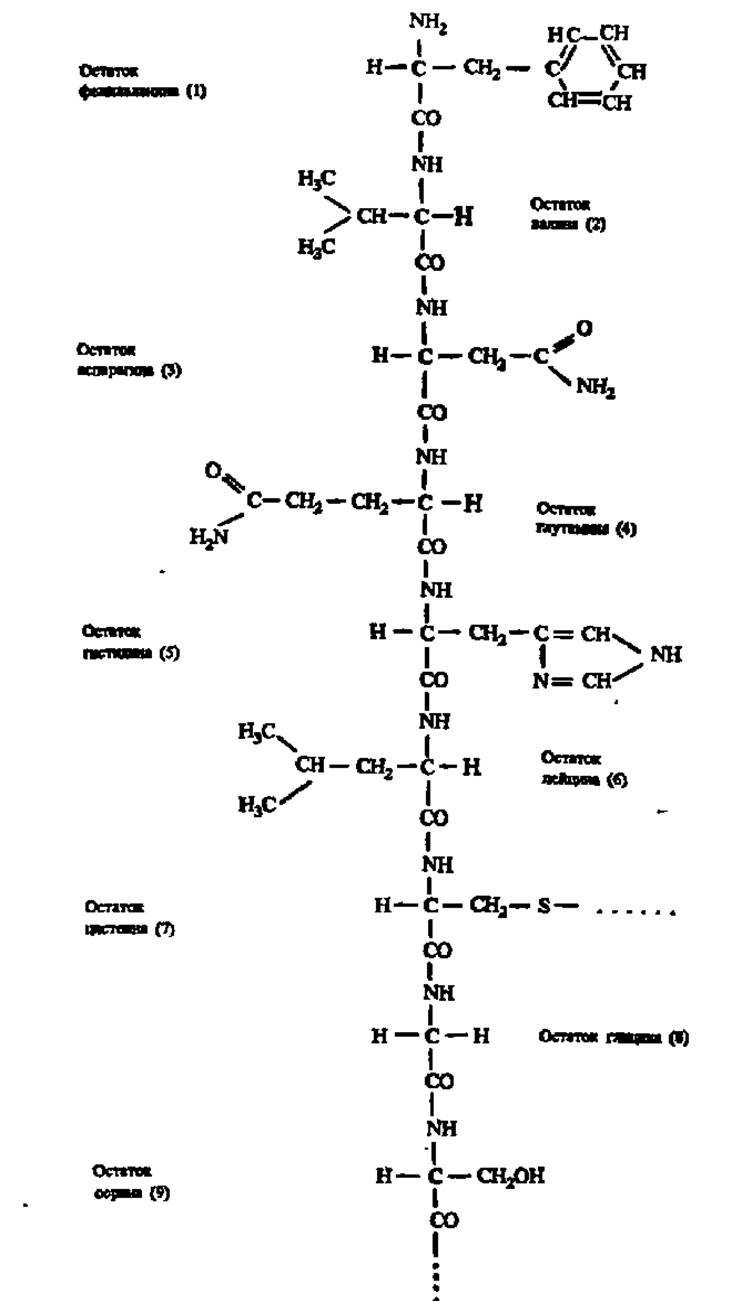
Наконец, четвертое свойство полипептидной цепи заключается в том, что ее остов, построенный из —NH—СН—СО-фрагментов, окружен разнообразными по своей химической природе боковыми цепями, что можно видеть при рассмотрении структуры фрагмента молекулы инсулина (см. с. 550.
Боковые цепи функционально многолики. Они представлены (см. табл. 4 и рис. 18) жирными (ала, вал, лей, иле), ароматическими (фен) и гетероциклическими (про, три, гис) радикалами. Многие из них несут свободные аминные (лиз, арг), карбоксильные (асп и глу), гидроксильные и фенольные (сер, тре, тир), тиольные (цис), амидные (асн, глн) и другие функциональные группы. Взаимодействуя с окружающими молекулами растворителя (вода), свободные NH2. и СООН-группы ионизируются, образуя катионные и анионные центры молекулы белка. В зависимости от их соотношения белковая молекула получает суммарный положительный или отрицательный заряд, а также характеризуется тем или иным значением pH среды при достижении изоэлектрической точки белка. Число и соотношение катионных, анионных и иных групп в некоторых белках приведены в табл. 7.
Таблица 7 Распределение групп в белках (число груш в одной молекуле)
Белок |
Общее число аминокислотных остатков |
Углеводородные радикалы |
Гетероциклические радикалы |
Фенольные радикалы |
Гидроксильные группы |
Аминогруппы |
Карбоксильные группы |
Тиольные группы |
Прочие радикалы |
Миоглобин лошади, М = 17000 |
143 |
48 |
16 |
2 |
13 |
20 |
29 |
0 |
15 |
Пепсин, М = 35 000 |
341 |
136 |
21 |
18 |
72 |
3 |
71 |
4 |
26 |
Альбумин яичный, М = 46000 |
387 |
141 |
24 |
9 |
52 |
35 |
84 |
5 |
37 |
Гемоглобин лошади, М = 68000 |
541 |
209 |
63 |
11 |
59 |
52 |
89 |
3 |
55 |
Резкое преобладание в молекуле пепсина карбоксильных групп над аминными требует высокой концентрации водородных ионов для перевода его в изоэлектрическое состояние, в то время как почти равное число тех или других в молекуле миоглобина сопровождается изоэлектрической точкой, близкой к pH нейтральной среды (см. табл. 3).
Строение радикалов оказывает большое влияние на многие другие свойства белков и особенно на пространственную конфигурацию полипептидной цепи: образующиеся солевые, эфирные, дисульфидные и другие мостики закрепляют относительное расположение участков цепи при формировании третичной структуры белка (см. ниже). Радикалы также в основном определяют круг химических реакций, свойственных белковым телам, и оказывают наряду с другими факторами существенное влияние на функциональную активность белков.
Долгое время представления о структуре белковой молекулы ограничивались признанием полипептидной цепи как ее основы без какой-либо детализации закономерностей чередования аминокислотных остатков или конфигурации цепи. Лишь разработка новых методов определения последовательности расположения остатков аминокислот в полипептидной цепи и усовершенствование рентгеноструктурного анализа белковых кристаллов позволили продвинуться вперед в понимании как первой (закономерности чередования аминокислот), так и второй (закономерности в конфигурации полипептидной цепи) проблем.
В настоящее время в достаточной мере разработан вопрос о первичной, вторичной, третичной и четвертичной структурах белковой молекулы. Представление о четырех уровнях структуры белковой молекулы впервые выдвинуто Линдерстром-Лангом, исходя из методических соображений. Естественно, что все перечисленные уровни структуры сосуществуют в белковой молекуле и их уникальное сочетание в каждом конкретном случае определяет общее строение белковой частицы.
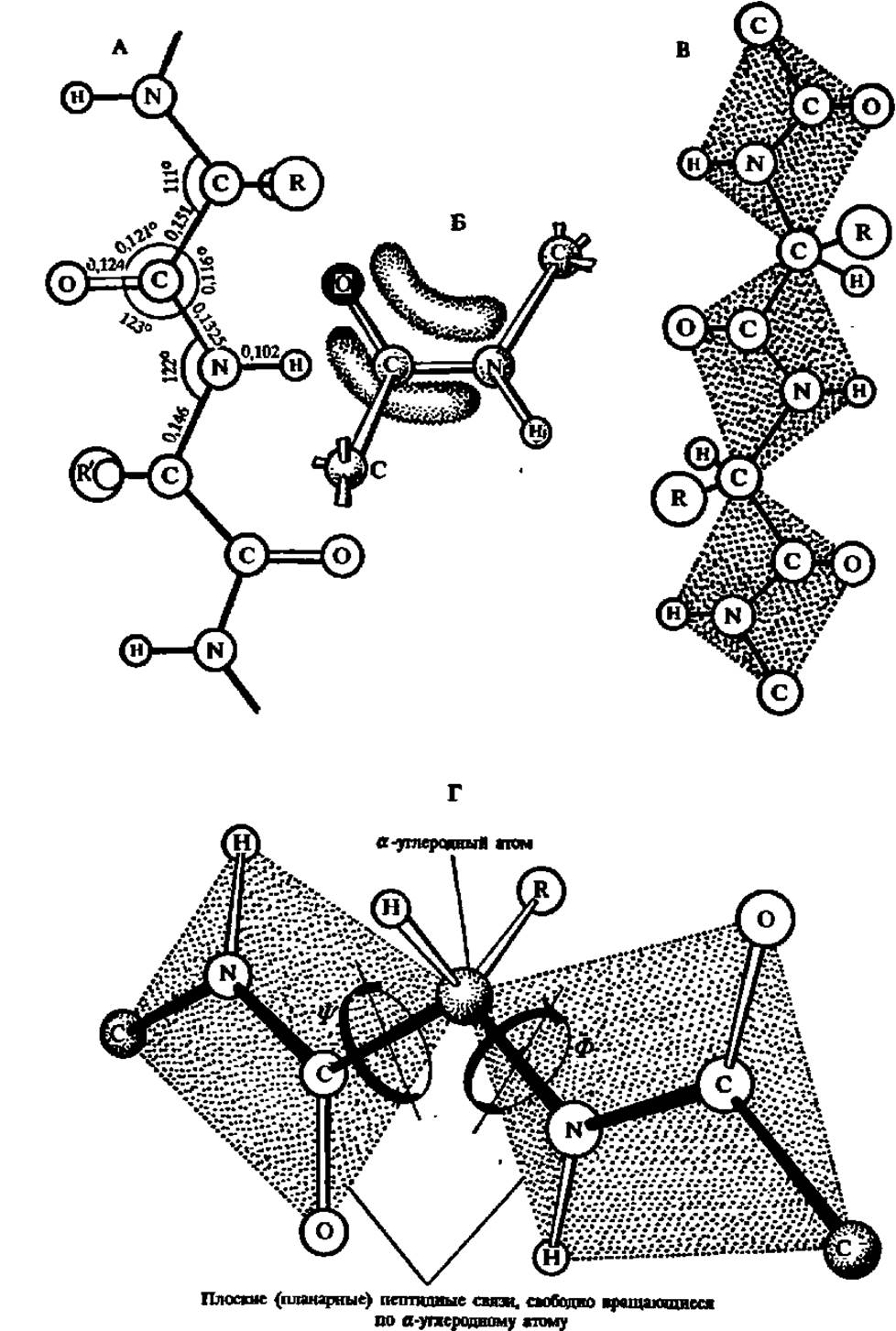
Рис. 23. Стандартные значения межатомных расстояний (в нанометрах) и валентных углов в полипептидной цепи (А) и делокализация электронной плотности по пептидному звену (Б), приводящая к стабилизации его плоской конфигурации (В и Г)
Фрагмент полипептидной цепи молекулы инсулина (1-9-й аминокислотные остатки цепи Б)
Первичная структура белка. Под первичной структурой белка понимают последовательность в расположении аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка. Зная первичную структуру белка, можно написать его полную химическую формулу.
Схема 1. Последовательность операций при установлении первичной структуры белка
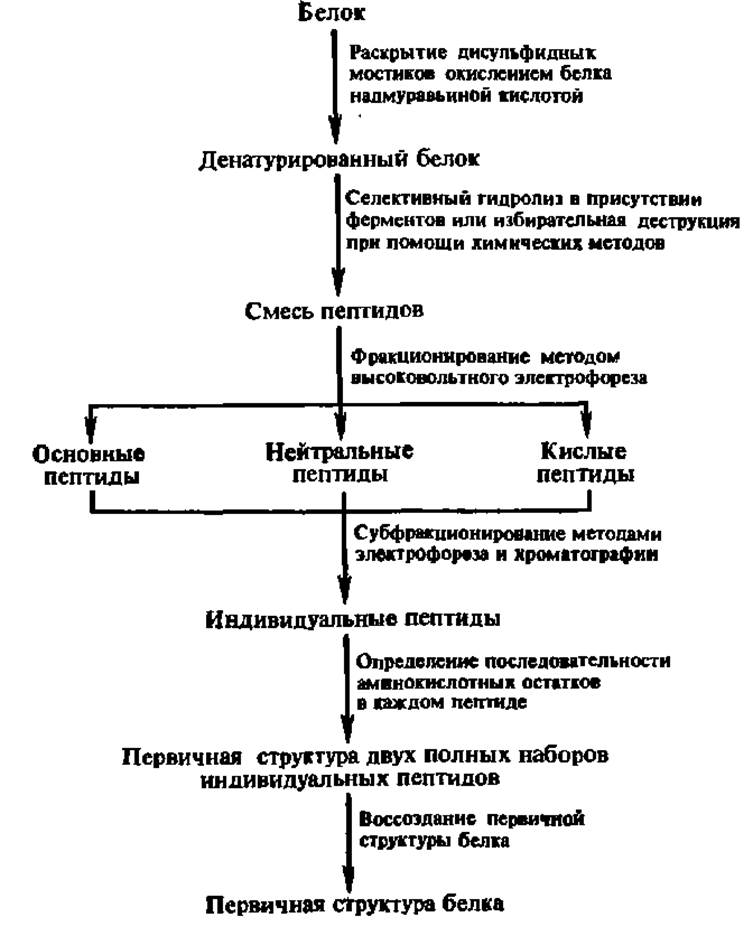
Учитывая, что в составе белковой молекулы содержится как минимум несколько десятков аминокислотных остатков, определение местоположения каждого из них составляет весьма сложную задачу. Ее решение может быть достигнуто в результате осуществления ряда операций, приведенных на схеме 1.
Раскрытие дисульфидных связей в молекуле белка (схема 1) необходимо, с одной стороны, для обеспечения последующего этапа фрагментирования полипептидной цепи белка и, с другой — для превращения всех остатков цис в белке в остатки цистеиновой кислоты, не разрушающейся при дальнейшем анализе:
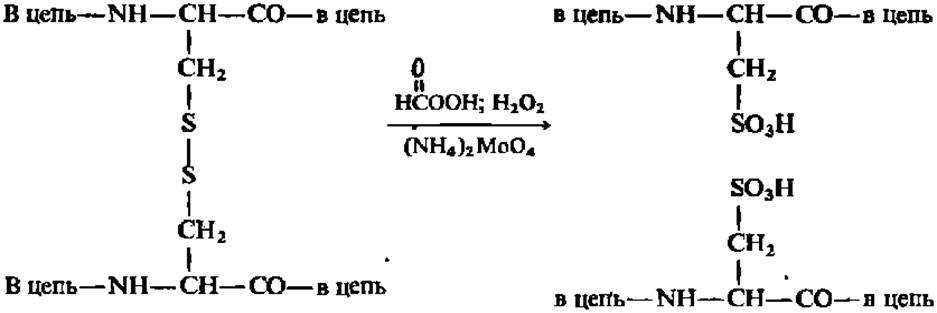
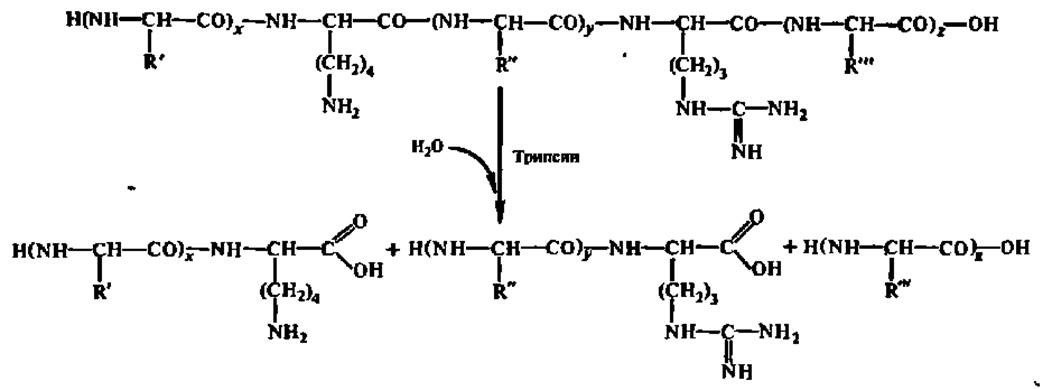
Селективный гидролиз денатурированного белка ведут протеолитическими ферментами, чаще всего либо трипсином (по остаткам арг и лиз), либо химотрипсином (по остаткам три, фен и тир):
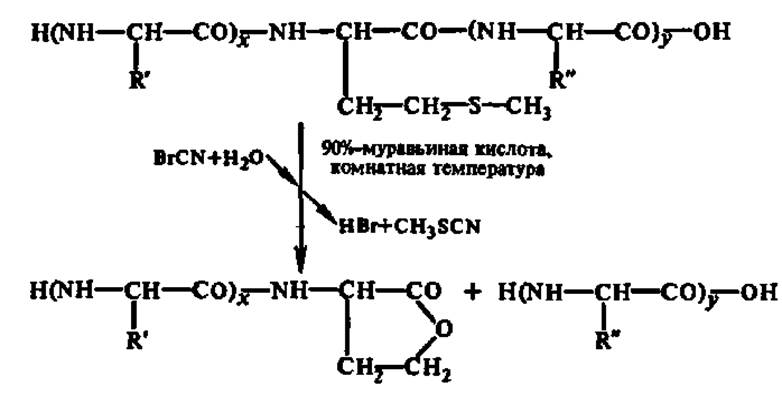
Можно деструктировать белок и химическими агентами, например, бромцианом — по остаткам мет, 2,4-динитрофторбензолом — по остаткам цис, N-бромсукцинимидом — по остаткам тир или три и т. п.:
В результате получают два-три различных набора пептидов изучаемого белка, что обеспечивает воссоздание его первичной структуры на завершающем этапе работы.
Фракционирование пептидов является многоступенчатым, длительным, трудоемким, но необходимым элементом схемы определения первичной структуры белка. Для этой цели используют преимущественно высоковольтный (до 10000 В) электрофорез на бумаге, особенно на заключительном этапе фракционирования, и хроматографию различных видов, в том числе ионообменную и распределительную.
Определение последовательности аминокислотных остатков в индивидуальных пептидах — наиболее ответственная процедура при установлении первичной структуры белков. В настоящее время эту работу ведут преимущественно либо фенилизотиоцианатным методом Эдмана, либо масс-спектрометрическим.
Фенилизотиоцианатный метод Эдмана (1950) реализуется в специально созданном для этой цели приборе, получившем название секвенатор (от англ. sequence — последовательность). Принципиальная схема устройства твердофазного секвенатора й принцип его работы показаны на рис. 24. В современных моделях секвенатора удается определить чередование аминокислотных остатков не только в коротких пептидах, но и непосредственно в полипептидных цепях белка, проходя до 70 аминокислотных звеньев в его молекуле.
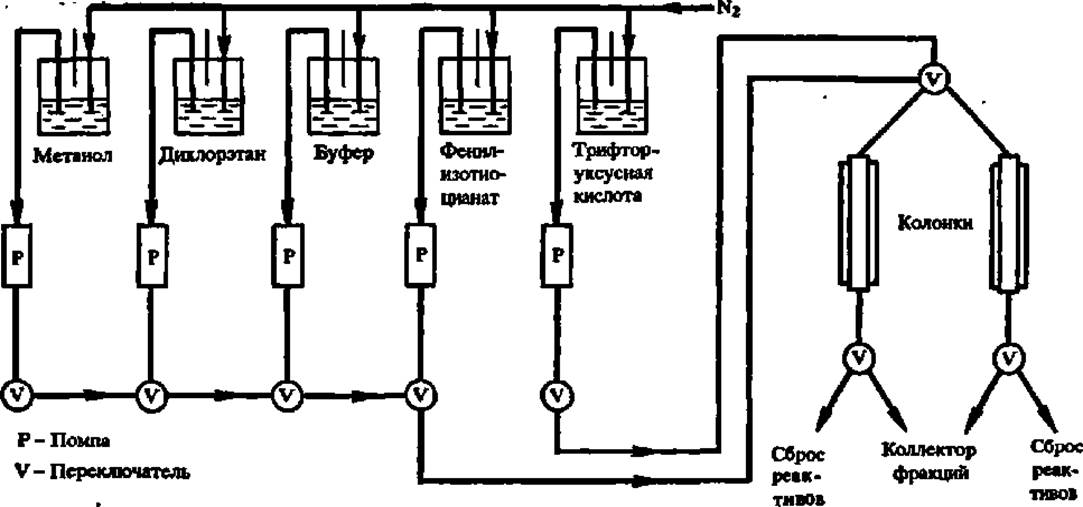
Рис. 24. Схема устройства секвенатора (пояснения в тексте)
Метод Эдмана сводится к обработке фенилизотиоцианатом белка или пептида (рис. 25), присоединенного через С-концевую аминокислоту к инертному носителю (полистиролу или пористому стеклу) в колонке секвенатоpa (реакция сочетания). После промывки колонки растворителями (метанол, дихлорэтан) образовавшийся фенилтиокарбамилпептид подвергают воздействию безводной трифторуксусной кислоты, в результате чего высвобождается анилинотиазолинон и в его составе N-концевая аминокислота (реакция отщепления), а укороченный на один аминокислотный остаток пептид или белок остается связанным с носителем. Анилинотиазолинон поступает в коллектор фракций и, далее, после превращения в водной среде в фенилтиогидантоин (реакция конверсии) — на хроматографическое определение отщепившейся N-концевой аминокислоты. Будучи промыт растворителями, секвенатор готов к следующему циклу работы в автоматическом режиме.
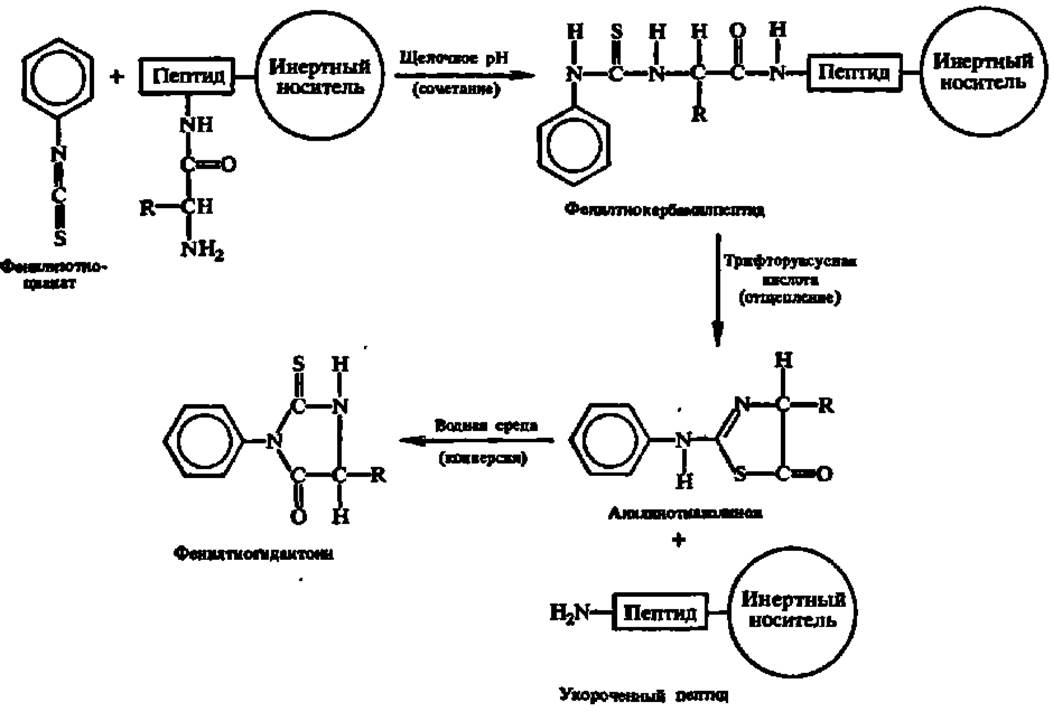
Рис. 25. Химические реакции, протекающие при секвенировании пептидов и белков (пояснения в тексте)
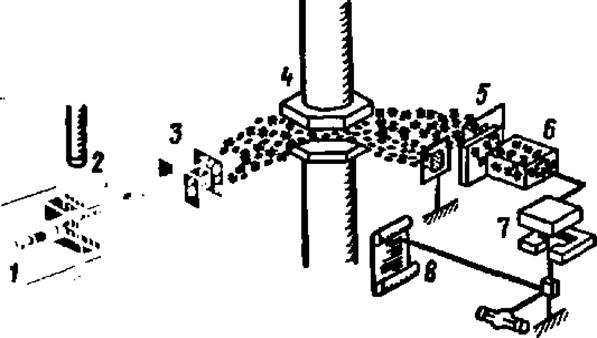
Рис. 26. Принципиальная схема устройства масс-спектрометра:
1 — инжекторное устройство для ввода образца; 2 — ионизационная камера; 3 в 5 — система фильтров; 4 — электромагнит; 6 — детектор; 7 — привод самописца; 8 — лента самописца
Масс-спектрометрический метод определения первичной структуры пептидов, приложимый пока лишь к сравнительно коротким, примерно, 10-членным пептидам, состоит в фрагментации аминокислотного типа эфиров ацилпептидов с последующим разделением полученных при этом положительно заряженных фрагментов. Фрагментацию осуществляют воздействием электронного удара, а разделение фрагментов — в масс-спектрометре (рис. 26). В результате получают масс-спектр фрагментов пептида (рис. 27), расшифровывая который, делают заключение о первичной структуре пептида. Хотя расшифровка масс-спектра фрагментов пептида весьма сложна, однако, исходя из знания аминокислотного состава пептида и используя электронно-вычислительные машины для просчета различных вариантов сочетания аминокислотных остатков в пептиде, находят тот вариант структуры, расчетные данные которого совпадают с экспериментальными.
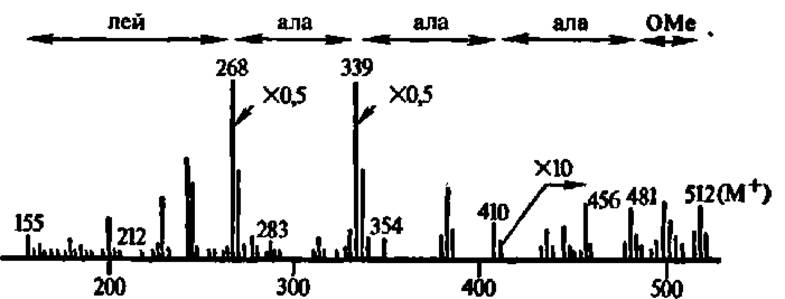
Рис. 27. Масс-спектр метилового эфира N-деканоиллейцилаланилаланилаланина
На рисунке приведены массовые числа, соответствующие аминокислотному типу фрагментации пептида; как ясно из названия исследованного соединение, аминогруппа N-концевой
аминокислоты — лейцина ацилирована и несет деканоильную
группировку, а карбоксильная группа С-концевой аминокислоты — аланина, этерифицирована и несет метильную грушу; именно такое производное пептида фрагментируется по аминокислотному типу, т. е. преимущественно по пептидным связям с образованием фрагментов, характеризующихся соответствующими массовыми числами
Заключительный этап работы при выяснении порядка следования аминокислотных остатков в белковой молекуле—воссоздание первичной структуры белка на основании данных о последовательности их расположения в пептидах, полученных при селективном гидролизе. Так как избирательное расщепление пептидных связей при исследовании первичной структуры белков ведут не менее чем двумя агентами, обеспечивающими разрыв пептидных связей в разных точках полипептидной цепи, то первичные структуры того и другого набора полученных пептидов неизбежно перекрываются. Это открывает возможность воссоздания первичной структуры белка (рис. 28). Если при посредстве секвенатора удалось выяснить чередование аминокислотных звеньев в фрагментах белковой молекулы значительного размера, то это существенно упрощает процесс воссоздания ее первичной структуры.
Другие методы определения последовательности расположения аминокислотных остатков в белковой молекуле основаны главным образом на использовании ферментов, способных ускорять реакции последовательного отщепления аминокислот либо с N-, либо с С-конца полипептидной цепи. Однако они не получили еще столь широкого распространения и аппаратурного оформления, как рассмотренные выше. В последние годы ведущее место в выяснении первичной структуры белков занял метод, который условно можно назвать генетическим: он основан на выведении последовательности аминокислот в белковой молекуле исходя из структуры гена, кодирующего биосинтез этого белка. Именно так была расшифрована структура самых длинных полипептидных цепей — фактора VIII свертывания крови (2332 аминокислотных остатка) и субъединицы тиреоглобулина (2750 аминокислотных остатков). Нельзя не упомянуть также только что появившиеся сообщения об определении первичной структуры белков методом лазерной фотодиссоциации; учитывая его высочайшую чувствительность (для анализа достаточно 5 нмоль белка при молекулярной массе 50 кДа), он, по-видимому, имеет большое будущее.
Первым белком, первичную структуру которого удалось расшифровать благодаря работам Ф. Сангера и сотр. (1951 —1953), был инсулин быка (за это в 1958 г. Ф. Сангеру была присуждена Нобелевская премия). Инсулин — белок-гормон, регулирующий углеводный обмен. Он синтезируется в поджелудочной железе в виде предшественника, структура которого показана на рис. 29. При нарушении биосинтеза инсулина у человека развивается сахарное мочеизнурение, или диабет.
Субъединица инсулина (М = 6000) состоит из 51 аминокислотного остатка, собранных в две полипептидные цепи (А и В), которые соединены двумя дисульфидными мостиками.
Согласно справочнику Л. Крофта на август 1975 г. была выяснена первичная структура 932 соединений пептидной природы, из числа которых не менее 800 — белки. Учитывая, что в последующее время расшифровывали от нескольких десятков до нескольких сотен первичных структур ежегодно (в 1976 г.—76; в 1977 г.—380), список белков с полностью известным чередованием аминокислот в их молекулах к январю 1985 г. достиг 2657. В ряде случаев определена первичная структура одного и того же белка, но выделенного из разных организмов. Так, первичная структура инсулина, миоглобина и гемоглобина изучена у 20 видов, цитохрома с — у 60, лизоцима — у 10 и т. д. Ниже приведены первичные структуры перечисленных белков, характерные для человека:
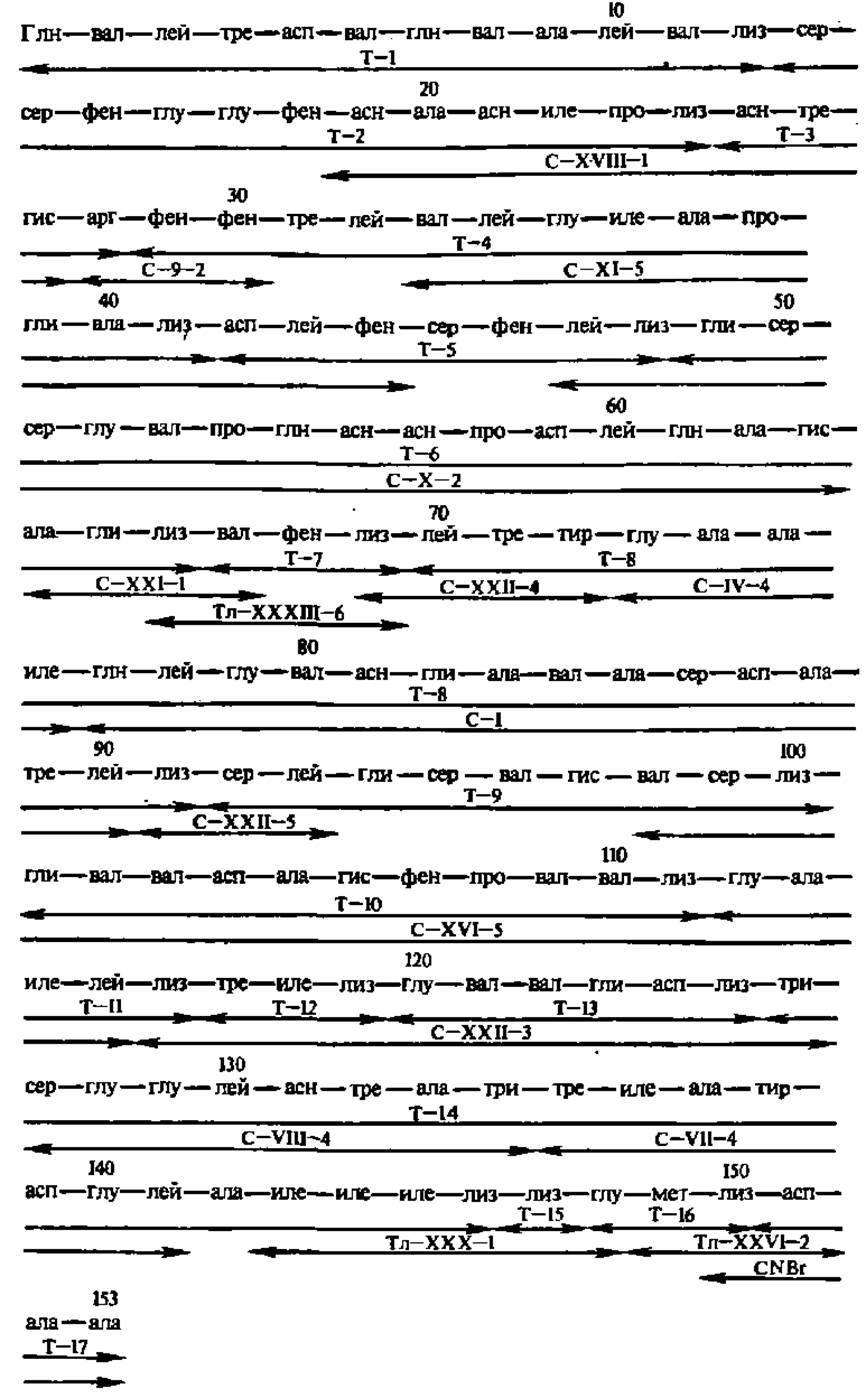
Рис. 28. Воссоздание первичной группы леггемоглобина по данным о первичной структуре пептидов, полученных при его селективном гидролизе трипсином (Т), химотрипсином (С) и термолизином (Тл) — микробной протеиназой, специфичной к остаткам гидрофобных аминокислот, а также при его расщеплении бромцианом CNBr
Леггемоглобин — кислородсвязывающий гемо протеин бобовых растений, играющий важную роль в фиксации молекулярного азота клубеньковыми бактериями. Т—I, Т—2 и т. д.—триптические пептиды; С—1, С—IV и т. д. — химотриптические; Тл—XXX, Тл—XXXI и т. д.— термолизиновые; CNBr — цианобромидные пептиды. Перекрывающиеся зоны стрелок отмечают перекрытия пептидов из разных гидролизатов, а па стыках стрелок расположены точки селективного распада полипептидной цепи. Первичная структура фрагментов, содержащих аминокислотные остатки с 1-го по 24-й и с 29-го по 58-й, определена с помощью секвенатора
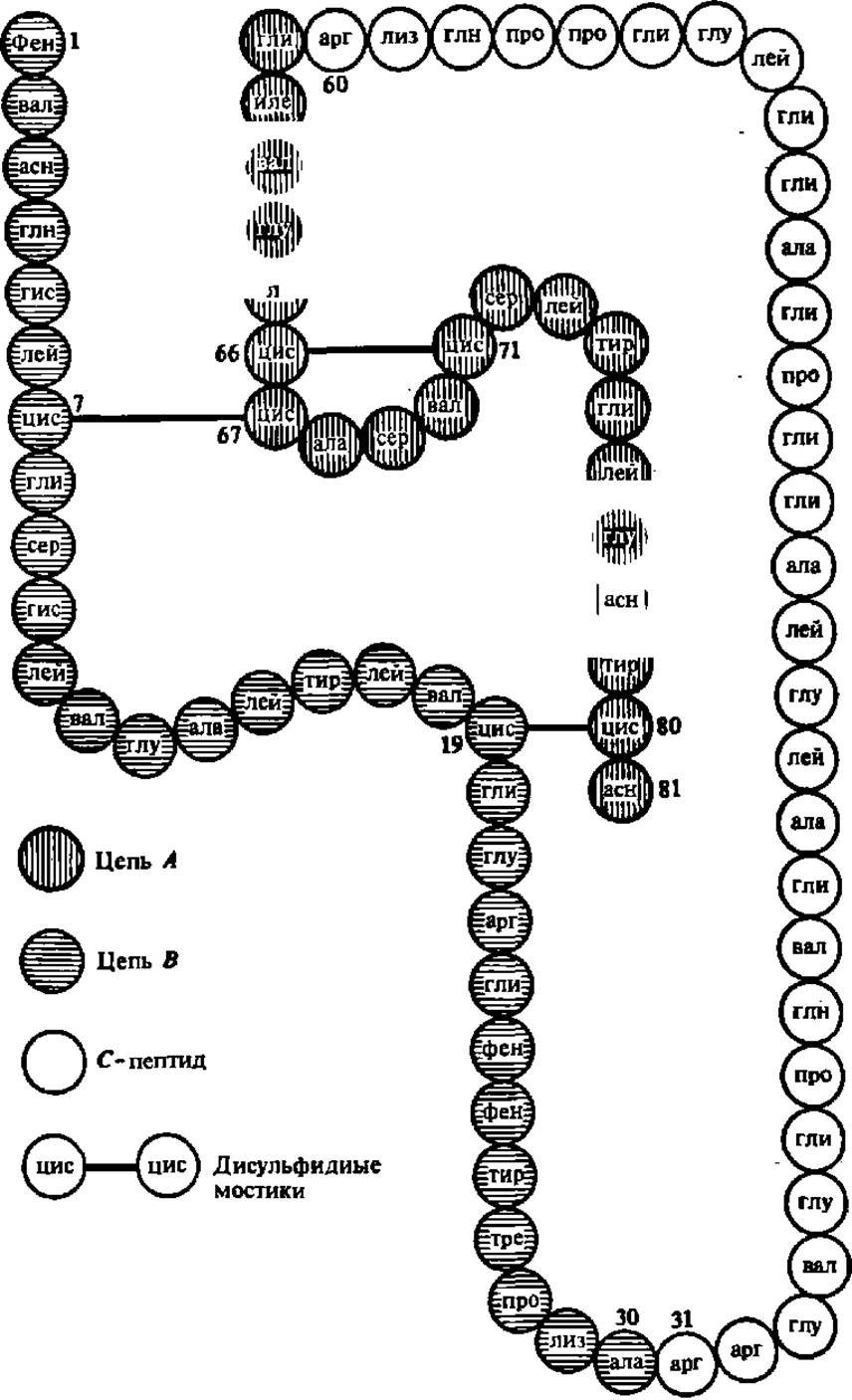
Рис. 29. Первичная структура проинсулина быка
С-лептид отщепляется от проинсулина в процессе превращения его в инсулин под воздействием специфического фермента, ускоряющего гидролиз пептидных связей по остаткам аргинина в позициях 31 и 60

В Институте биоорганической химии им. М. М. Шемякина выполнен анализ первичной структуры ß- и ß'-субъединиц ДНК-зависимой РНК-полимеразы — белков, имеющих очень длинные полипептидные цепи, 1342 и 1407 аминокислотных остатков соответственно; аспартатамино-трансферазы из сердца свиньи — 412; леггемоглобина из клубеньков желтого люпина — 153; LIV (лей, иле, вал) — связывающего белка из кишечной палочки — 344; нейротоксинов из яда среднеазиатской кобры — 72; белков L10 и L25 из рибосом кишечной палочки — 164 и 94 соответственно; а-субъединицы ДНК-зависимой РНК-полимеразы—329; инсектотоксина из яда среднеазиатского скорпиона— 62; зрительного родопсина — 348; фактора элонгации G—701; у-субъединицы ГТФ-связывающего белка и у-субъединицы цикло-ГМФ-фосфодиэстеразы из сетчатки крупного рогатого скота — 69 и 87 соответственно; С39-белка из мозжечка быка — 341; а- и ß-субъединиц Na+, К+-АТФазы из почек свиньи — 1016 и 302 аминокислотных остатков соответственно.
В нашей же стране расшифрованы первичные структуры пепсина свиньи — 313 остатков (В. М. Степанов и др.); стурина — 27 (А. Б. Силаев); актиноксантина — 107 (П. Решетов); лактогенного гормона —198 (Н. А. Юдаев); полиэдренного белка вируса ядерного полиэдроза — 244 (С. Б. Серебряный и др.); нейротоксина из яда среднеазиатского скорпиона—65 (Е. Гришин и др.); холестерин — гидроксилирующего цитохрома Р-450 из митохондрий коры надпочечников быка — 481 (В. А. Чащин и др.); а- и ß-субъединиц лютеинизирующего гормона из гипофиза кита — 96 и 118 соответственно (В. С. Карасев и др.); кальмодулина из мозга человека — 148 (Ю. Б. Алахов и др.); гуанилспецифичной РНКазы из нескольких видов аспергилла — 102 (С. В. Шляпников и др.); рестриктазы Eco RV из кишечной палочки — 241 (А. А. Баев и сотр.); нейротоксина III из актинии — 48 (Т. А. Зыкова и др.); нейраминидазы, структурного белка нуклеопротеина и гемагглютинина вируса гриппа—470, 498 и 566 соответственно (А. Б. Беклемишев и др.); В4 полипептида глицинина из сои—251 (Е. С. Захарова и др.); гепаторедоксина из митохондрий печени быка—117 (В. Л. Чащин и др.); аспергиллопепсина А-320 (В. И. Остромысловская и др.); фосфорибозиламиноимидазол-сукцино-карбоксамидсинтетазы пекарских дрожжей — 306 (Н. А. Мясников и др.); белка VP1 вируса ящура — 254 (А. М. Онищенко и др.); онкобелка р53 мыши — 390 (П. М. Чумаков и др.); пролактина из гипофиза человека — 204 (Н. П. Мертвецов и др.); инсектотоксина из яда погребного паука — 35 (Н. Ж. Сагдиев и др.); белка PV2 вируса гриппа — 759 (Н. А. Петров и др.); А- и В-субъединиц токсина шигеллы — 315 и 89 соответственно (А. А. Баев и сотр.); а-субъединицы Na+, К+-АТФазы из мозга человека (III форма)—1013 (О. И. Макаревич и др.) и ß-субъединицы фосфодиэстеразы цГМФ — 852 (В. М. Липкин и др.) аминокислотных остатка.
Каждый из белков, первичные структуры которых приведены выше (за исключением гемоглобина), представлен одной полипептидной цепью большей или меньшей длины. Чередование аминокислотных остатков в полипептидной цепи индивидуального белка неповторимо и специфично. В некоторых случаях молекулы белков построены из двух или более полипептидных цепей, соединенных друг с другом ковалентными связями. Примером такого рода может служить молекула инсулина (см. рис. 29). В большинстве же своем молекулы белков состоят из нескольких полипептидных цепей, удерживаемых силами слабых взаимодействий.
При рассмотрении первичной структуры белковых тел возникает принципиально важный вопрос: осуществляются ли в белках все потенциально возможные комбинации из аминокислотных остатков, их составляющих, или существуют некоторые сочетания аминокислотных остатков, характерные для многих, а может быть, и для всех белковых тел? Ведь белки и пептиды за счет перестановки аминокислотных остатков в полипептидной цепи могут давать огромное число изомеров:
Число аминокислотных остатков в молекуле |
Возможное число изомеров |
Число аминокислотных остатков в молекуле |
Возможное число изомеров |
2 |
2 |
7 |
5040 |
3 |
6 |
8 |
40320 |
4 |
24 |
9 |
362780 |
5 |
120 |
10 |
3362780 |
6 |
720 |
20 |
∽2 ∙ 1018 |
Понятно, что при увеличении числа аминокислотных остатков в белковой молекуле до нескольких сотен количество возможных изомеров может достигнуть астрономических величин. Однако анализ чередования аминокислот в белках, проведенный в последние годы, привел к открытию ряда закономерностей, позволяющих утверждать, что в белках реализуются далеко не все возможные первичные структуры. Прежде всего, в различных белках, а часто и в одном и том же, встречаются идентичные (тождественные) пептидные группировки. Особая роль в структурном подобии белков принадлежит тождественным трипептидным группировкам, но в некоторых случаях и более обширные фрагменты совпадают по порядку чередования аминокислотных остатков. Так, в 52 рибосомных белках тождественные трипептидные блоки повторяются 657 раз, тетрапептидные — 86, пентапептидные — 11, гексапептидные — 3, гептапептидные — ни одного раза. Вместе с тем в полипептидных цепях есть аналогичные пептидные группировки, отличающиеся друг от друга взаимозаменяемыми аминокислотными остатками, т. е. такими остатками аминокислот, которые близки по строению или биогенетически, например: гли—сер, гли—ала, лей—иле, лей—вал, глу—асп и др. Установлено, что в ряде случаев первичные структуры различных белков включают 50% и более тождественных пептидных фрагментов.
Кроме того, значительные совпадения первичной структуры характерны для белков, выполняющих сходные биологические функции. Это показано, например, для семейства ферментов, ускоряющих реакции дегидрирования разнообразных субстрактов, а также для многих гидролаз, у которых последовательность аминокислотных остатков вблизи активного центра крайне близка и стандартна. Особенно высоким структурным подобием отличаются белки, выполняющие у разных видов одну и ту же функцию, что наглядно выявляется при сопоставлении первичных структур инсулина (табл. 8), а также цитохромов, гистонов, гипофизарных гормонов и других белков. У цитохромов, выделенных из синезеленых, красных и бурых водорослей, первичные структуры совпадают на 48—67%. Таким образом, видовая специфичность первичной структуры гомологичных белков сводится к ограниченному числу аминокислотных замен в полипептидной цепи в строго определенных положениях.
Богатейший материал этого рода дали анализы первичной структуры аномальных гемоглобинов человека, где замена всего лишь одной аминокислоты в a-, ß-, у- или б-цепи сопровождается возникновением каждый раз нового типа аномального гемоглобина. Таких гемоглобинов известно сейчас более двухсот. Они являются источником заболеваний человека, относящихся к категории молекулярных болезней. Так, например, при замене в ß-цепи гемоглобина человека шестого остатка глу на остаток вал возникает аномальный гемоглобин S. Это приводит к образованию эритроцитов серповидной формы с меньшим временем жизни, результатом чего является тяжелое наследственное заболевание —серповидная анемия.
Таблица 8 Различия в первичных структурах А- и В-цeпей инсулинов разного происхождения
|
Источник инсулина |
Номера аминокислотных остатков |
|||||||||
|
Цепь А |
Цепь В |
|||||||||
4 |
8 |
9 |
10 |
1 |
2 |
3 |
27 |
29 |
30 |
|
Кашалот, кит финвал, |
глу |
тре |
сер |
иле |
фен |
вал |
асн |
тре |
лиз |
ала |
свинья (принят за эталон |
||||||||||
сравнения) |
||||||||||
Человек |
тре |
|||||||||
Бык, собака |
ала |
вал |
||||||||
Коза, овца |
ала |
гли |
вал |
|||||||
Слон |
ала |
гли |
вал |
тре |
||||||
Кит сейвал |
ала |
тре |
||||||||
Лошадь |
гли |
|||||||||
Кролик |
ала |
вал |
сер |
|||||||
Крыса |
асп |
ала |
вал |
лиз |
лиз |
сер |
||||
мет |
||||||||||
Мышь |
асп |
лиз |
лиз |
сер |
||||||
мет |
||||||||||
Утка |
глу |
асн |
про |
ала |
ала |
сер |
тре |
|||
Цыпленок |
гис |
асн |
тре |
ала |
ала |
сер |
||||
Примечание. В остальных позициях цепей А и В инсулина разного происхождения чередование аминокислотных остатков идентично; инсулин трески резко отличается по первичной структуре от инсулинов, перечисленных в таблице видов.
Вторичная структура белка. Строго линейная полипептидная цепь присуща крайне ограниченному числу белков. Одним из таких белков является фиброин шелка — белок, выделяемый гусеницами шелкопряда. В силу особых условий формирования шелкового волокна в мощном мускульном прессе гусеницы нитевидные молекулы фиброина, почти лишенные обрамляющих главную полипептидную цепь радикалов, ориентируются вдоль шелкоотделительного протока и плотно упаковываются по ходу шелкового волокна, приобретающего на некоторых участках псевдокристаллическое строение. Рентгеноструктурный анализ дал возможность выявить в первую очередь именно линейный характер полипептидных цепей в фиброине шелка и, таким образом, в 30-е годы нашего столетия возникло представление о белковой молекуле как полностью вытянутой полипептидной цепи с периодом идентичности в 0,71 нм (подобной той, что изображена на рис. 23).
Однако позднее также рентгенографически было найдено, что даже в фибриллярных белках, не говоря уже о глобулярных, очень редко удается обнаружить полностью растянутые полипептидные цепи. Рентгеновские снимки постоянно указывали на наличие в белках цепей, каким-то образом сложенных или скрученных, для которых повторяемость расположения структурных элементов составляла 0,54 нм. На основании анализа рентгенограмм растянутых и нормальных волокнистых белков, таких, как кератин волоса, В. Астбери и Ф. Белл (1941) впервые предложили модель свертывания полипептидной цепи. Она вполне объясняла наблюдаемый в опытах период идентичности в 0,54 нм и его изменение при растяжении белкового волокна. Эта модель была уже построена с учетом того, что валентные углы и межатомные расстояния, характерные для пептидной связи и ее ближайшего окружения, не должны нарушаться.
Линия на моделирование как средство решения проблемы структуры белковой молекулы была продолжена Л. Полингом и Р. Кори (1949—1951). Они выдвинули критерии условий построения модели, отражающей возможное конформационное состояние полипептидной цепи в белковой молекуле.
Исходя из выдвинутых критериев, Л. Полингом и Р. Кори были построены спирали а- и ß-типа, а Б. Лоу и Р. Бейбуттом — п-спираль.
Так как только характеристика а-спиральной конформации цепи совпадала с величинами, наблюдаемыми при рентгеноструктурном анализе белковых кристаллов, то именно она и была признана Л. Полингом и Р. Кори в качестве одного из структурных элементов, реально существующих в белковых молекулах (рис. 30). Сейчас представление о существовании а-конформации полипептидной цепи в белках является общепринятым.
Как видно из рисунка, а-спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, так что все пространство внутри мыслимого цилиндра, в пределах которого идет закручивание, заполнено. На каждый виток правозакрученной а-спирали приходится 3,6 аминокислотных остатков, радикалы которых направлены всегда наружу и немного назад (вверх на модели), т. е. отклонены в сторону начала полипептидной цепи. Правый ход спирали легко установить, если смотреть в торец спирали со стороны N-концевой аминокислоты полипептидной цепи (начало молекулы): на модели ясно видно, что закручивание полипептидной цепи идет по часовой стрелке. Шаг спирали (расстояние между витками) составляет 0,54 нм, а угол подъема витка равен 26°. Период идентичности, т. е. длина отрезка спирали, полностью повторяющегося по ходу ее, составляет 2,7 нм (18 аминокислотных остатков).
Важнейшую роль в формировании и поддержании а-спиральной конфигурации полипептидной цепи играют водородные связи, возникающие между —СО- и —NH-группами хребта полипептидной цепи, расположенными на соседних витках спирали (рис. 30). И хотя энергия этих связей невелика, большое количество их приводит к значительному энергетическому эффекту, в результате чего а-спиральная конфигурация достаточно устойчива и жестка. Предполагают, что я-электроны СО- и NH-группировок полипептидной цепи могут вступать во взаимодействие через водородные связи, осуществляющие контакт соседних витков а-спирали. В результате на спирализованных участках белковой молекулы возникают зоны сопряжения электронов. Они могут служить для передачи энергии возбуждения электронов, что имеет огромное значение для осуществления химических реакций и трансформации одного вида энергии в другой. Таким образом, под вторичной структурой белковой молекулы подразумевают ту или иную конфигурацию, характерную для одной или нескольких полипептидных цепей, входящих в состав Молекулы.
Не следует представлять дело так, что в любом белке полипептидная цепь полностью спирализована. Такие случаи очень редки. Видимо, для каждого белка характерна та или иная степень спирализации полипептидной цепи:
Белок |
Доля спиральной конфигурации, % |
Парамиозин |
100 |
Миоглобин |
75 |
Гемоглобин |
75 |
Альбумин сывороточный свиньи |
50 |
Альбумин куриного яйца |
45 |
Лизоцим куриного яйца |
35 |
Вирус табачной мозаики (субъединица) |
30 |
Пепсин |
28 |
Рибонуклеаза |
17 |
Химотрипсиноген |
11 |
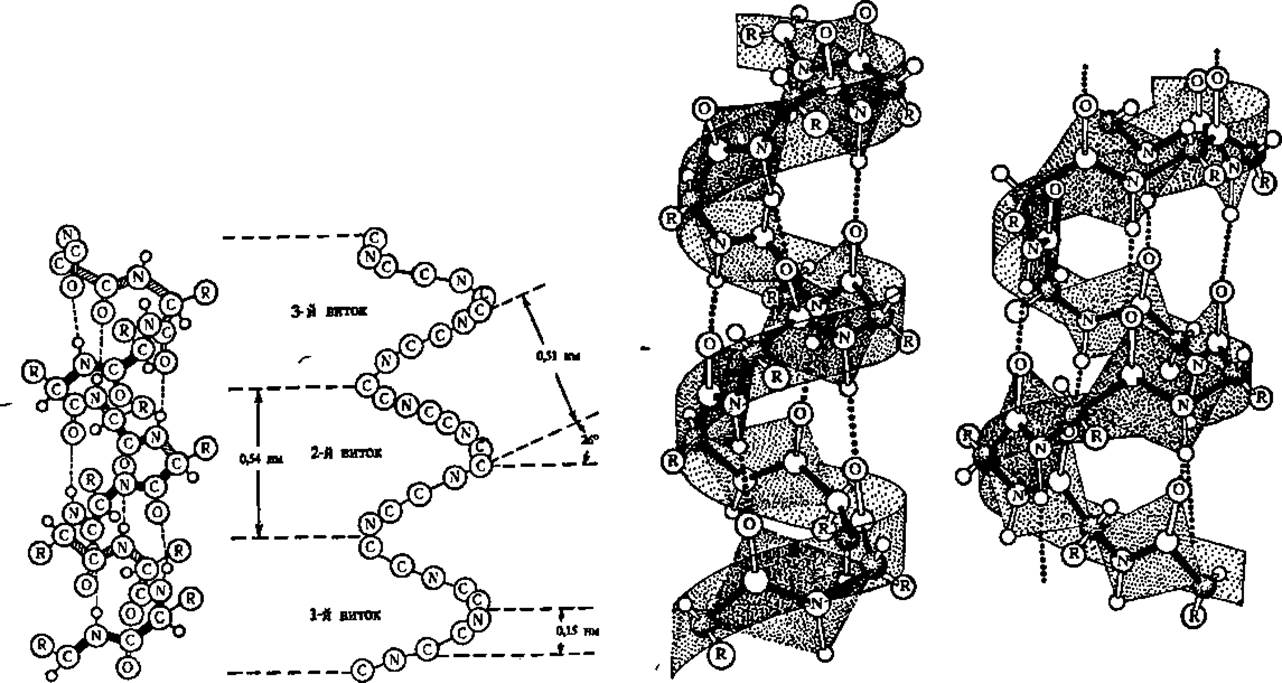
Рис. 30. Модели и схема а-спирали
На модели а-спирали (слева) зачернены участии спирали, обращенные к наблюдателю; пунктиром обозначены водородные связи между СО- и NH-группами, расположенными на соседних О участках спирали; атомы водорода показаны в виде маленьких кружочков. На схеме а-спирали (рядом) опушены все радикалы и показан ход хребта полипептидной цепи соответственно таковому в модели. Правее даны изображения а-спирали и π-спирали (крайняя справа) с учетом планарности пептидных связей
Таким образом, в белковых молекулах спирализованные участки полипептидной цепи закономерно чередуются с линейными.
В природных белках существуют лишь правозакрученные а-спиральные конформации полипептидных цепей, что сопряжено с наличием в белковых телах аминокислот только L-ряда (за исключением особых случаев).
Наряду с а-спиральной структурой в белковых молекулах наблюдается также ß-структура. Под последней подразумевают слоистые структуры, образуемые при сочетании участков полипептидной цепи, находящихся в ß-конформации, т. е. в виде линейно построенных пептидных фрагментов. Линейная конформация этих фрагментов удерживается благодаря возникновению водородных связей между параллельно идущими и сближенными на расстояние 0,272 нм (соответственно длине водородной связи между СО- и NH-группами) участками полипептидной цепи (рис. 31). Подобные структуры в массовом количестве представлены в волокнистых белках, например в фиброине шелка. Однако и в глобулярных белках ß-структуры присутствуют систематически и часто превалируют над а- структурами.
Возникновение а- и ß-структур в белковой молекуле является следствием того, что аминокислоты и в составе полипептидных цепей сохраняют присущую им способность к образованию водородных связей. Таким образом, крайне важное свойство аминокислот — соединяться друг с другом водородными связями в процессе образования кристаллических препаратов — реализуется в виде а-спиральной конформации или ß-структуры в белковой молекуле. Следовательно, возникновение указанных структур допустимо рассматривать как процесс кристаллизации участков полипептидной цепи в пределах одной и той же белковой молекулы (рис. 32).
Способность к образованию водородных связей, являющихся движущей силой при возникновении а- и ß-структур в белковой молекуле, присуща разным аминокислотам в неодинаковой степени. Среди них вычленяют группу спиралеобразующих аминокислот, куда входят ала, глу, глн, лей, лиз, мет и гис. Если остатки перечисленных аминокислот сконцентрированы в какой-то части полипептидной цепи или превалируют в ее составе, то а-спирализация осуществляется очень гладко. Наоборот, такие аминокислоты, как вал, иле, тре, тир и фен, способствуют образованию ß-слоев полипептидной цепи. Гли, сер, асп, асн и про имеют отношение к преимущественному возникновению неупорядоченных фрагментов в ее составе. Рис. 33 иллюстрирует один из вариантов сосуществования а- и ß-структур в одном и том же белке.
Третичная структура белка. Сведения о чередовании аминокислотных остатков в полипептидной цепи (первичная структура) и наличие в белковой молекуле специализированных, слоистых и неупорядоченных ее фрагментов (вторичная структура) еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу. Эти особенности строения белка выявляют при изучении его третичной структуры, под которой понимают общее расположение в пространстве составляющих молекулу одной или нескольких полипептидных цепей, соединенных ковалентными связями. Эту структуру ранее обозначали как архитектонику белковых молекул.
Решение этой сложнейшей в химии белка проблемы связано с усовершенствованием рентгеноструктурного анализа, выразившимся в увеличении разрешающей способности метода до 0,14 нм. Поскольку межатомные расстояния в молекулах органических соединений составляют 0,1—0,2 нм, столь высокая разрешающая способность дает возможность точно установить расположение каждого атома полипептидной цепи в пространстве, т. е. построить исчерпывающую модель белковой молекулы. По разрешающей способности рентгеноструктурный анализ превосходит только метод ядерного магнитного резонанса (0,03—0,09 нм), все более часто применяемый для изучения третичной структуры белков. Кроме того, для этой же цели используют электронную микроскопию, круговой дихроизм, дисперсию оптического вращения и нейтронную кристаллографию, не говоря уже о массовом предсказании третичной структуры белков по их первичной структуре при помощи ЭВМ.
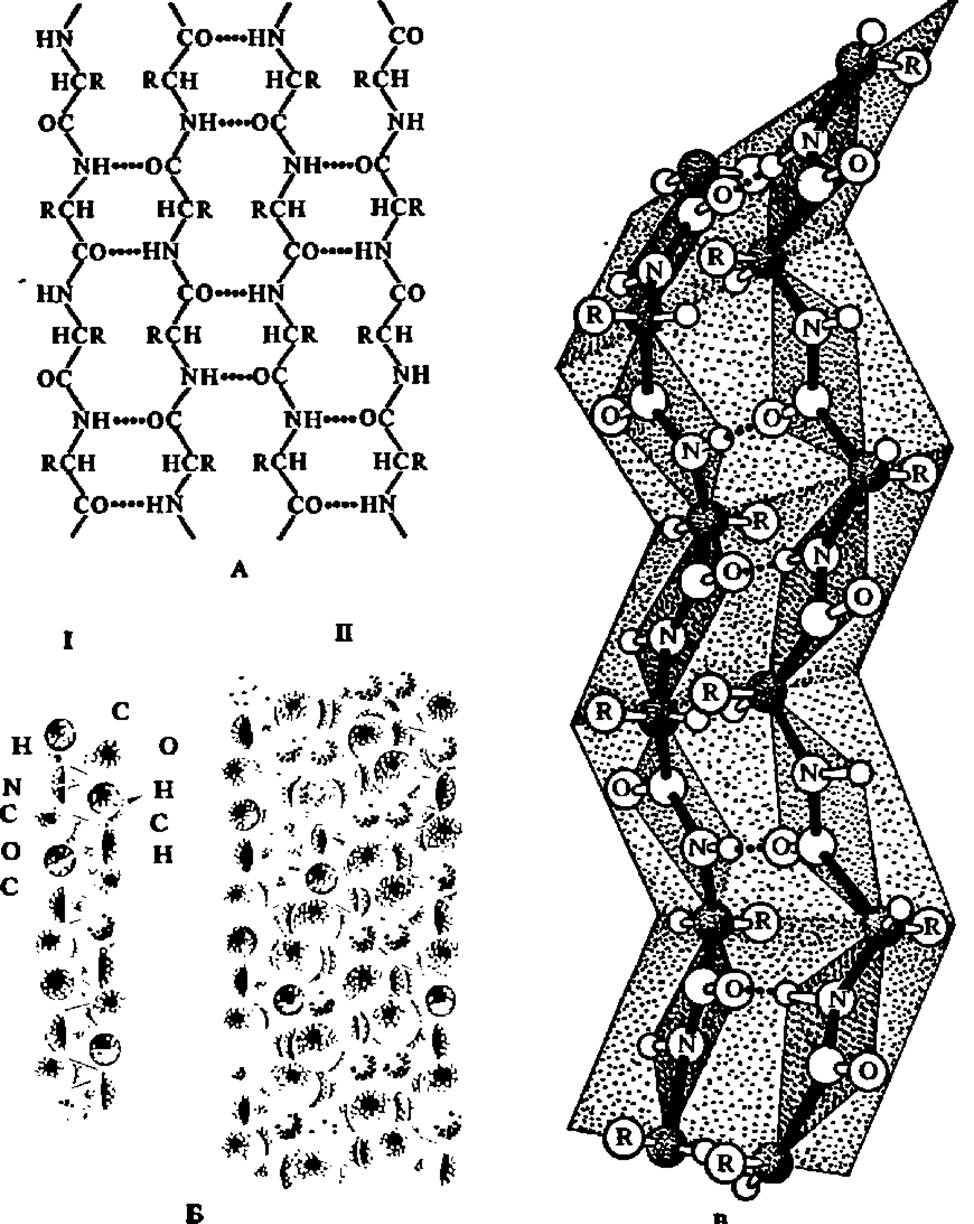
Рис. 31. ß-Структура белков:
А — возникновение ß-структуры; пунктиром обозначены водородные связи между СО- и NH-группами латерально расположенных полипептидных цепей; Б — плоский слой, образованный антипараллельно расположенными молекулами полиглицина; I — фрагмент объемной модели отдельной молекулы полиглицина: II — слой из объемных моделей молекул полиглицина; В' — ß-слой, составленный из двух фрагментов полипептидной цепи, построенных с учетом планарности пептидных связей
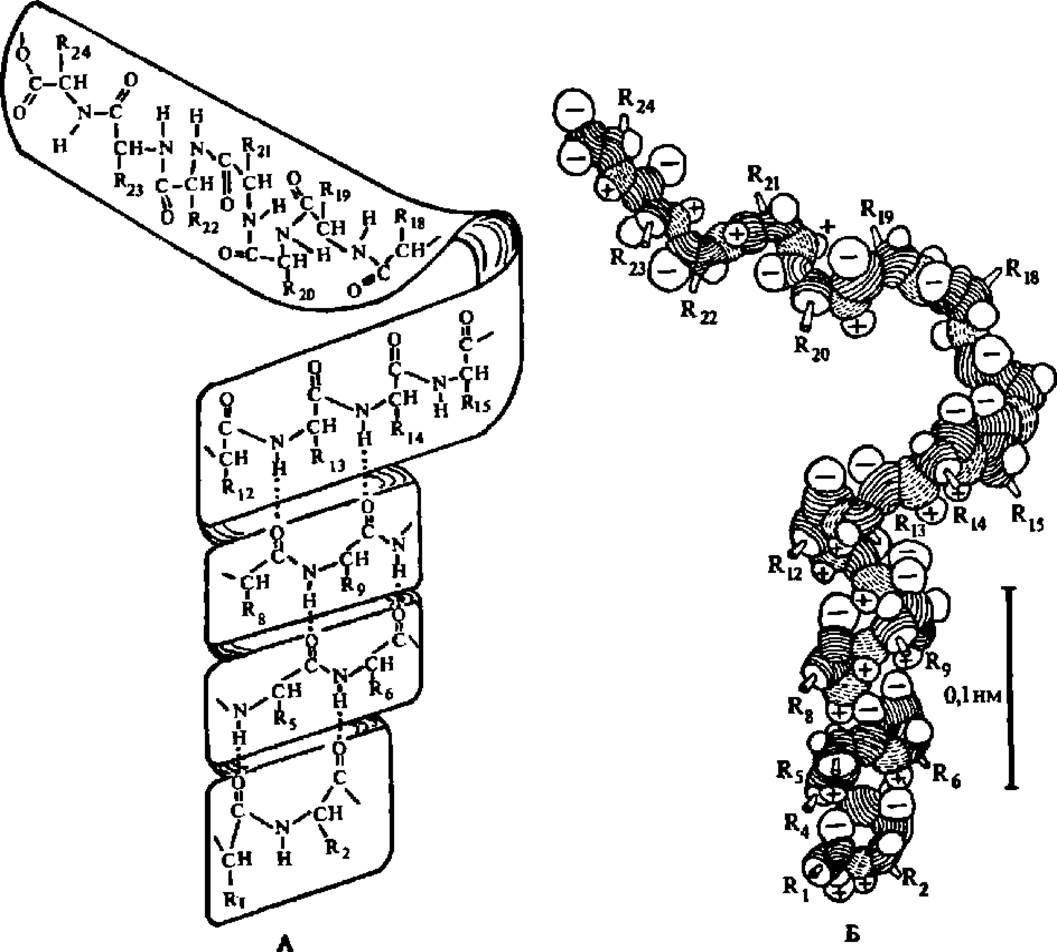
Рис. 32. Модели свертывания полипептидной цепи в а-спираль с образованием системы водородных связей между витками спирали:
А — в виде бумажной ленты с выписанной на ней структурой полипептидной цепи; водородные связи, являющиеся источником взаимодействия, приводящим к спирализации, показаны пунктиром; Б — в виде хребта полипептидной цепи, составленного из объемно изображенных NH, СО- и CHR-групп; атомы водорода и кислорода, участвующие в образовании водородных связей, помечены знаками «+» и «—» соответственно. Модель в виде бумажной ленты может быть использована в курсе химии средней школы и на кружковых занятиях со школьниками по органической химии
Первая модель молекулы белка — миоглобина (рис. 33), отражающая его третичную структуру, была создана Дж. Кендрю с сотр. (1957). На рис. 34 приведены схематические изображения третичной структуры молекул миоглобина, рибонуклеазы, лизоцима и химотрипсиногена. Несмотря на большие трудности, за истекшие три с половиной десятилетия удалось установить третичную структуру почти трехсот белков, причем более трех десятков из них — в СССР. В нашей стране, в частности, выяснена структура пепсина, леггемоглобина, аспартатаминотрансферазы, глицеральдегид-3-фосфатдегидрогеназы, пластоцианина, фитогемагглютинина, у-кристаллина, пирофосфатазы, ряда рибосомальных белков, актиноксантина, лектина, лейцинаминопептидазы, а- и ß-интерферона, лейцинспецифичного белка, родопсина, тубулина, гидрогеназы, метанмонооксигеназы и др. Ниже некоторые из них будут охарактеризованы более подробно.
Полагают, что третичная структура белковой молекулы определяется ее первичной структурой, так как решающая роль в поддержании характерного для третичной структуры расположения полипептидной цепи в пространстве принадлежит взаимодействию радикалов аминокислот друг с другом. Возможные типы связей между радикалами представлены на рис. 35. Особое значение в поддержании третичной структуры белка придают дисульфидным мостикам: именно они в ряде белков (см. рис. 29, 34 и 35) прочно фиксируют расположение участков полипептидной цепи (или цепей) по отношению друг к другу. Таким образом, местоположение в молекуле белка остатков цистеина (и других аминокислот) предопределяет характер межрадикальных связей и, следовательно, третичную структуру. Конечно и здесь, при замыкании дисульфидных мостиков, в частности, реализуются далеко не все возможности их возникновения, резко отличающиеся от расчетных (по Т. Крейтону, при пяти SS-связях в белковой молекуле число их комбинаций достигает 945, при 10 — 654729075, а при 25 — превышает 5,8 ∙ 1030).
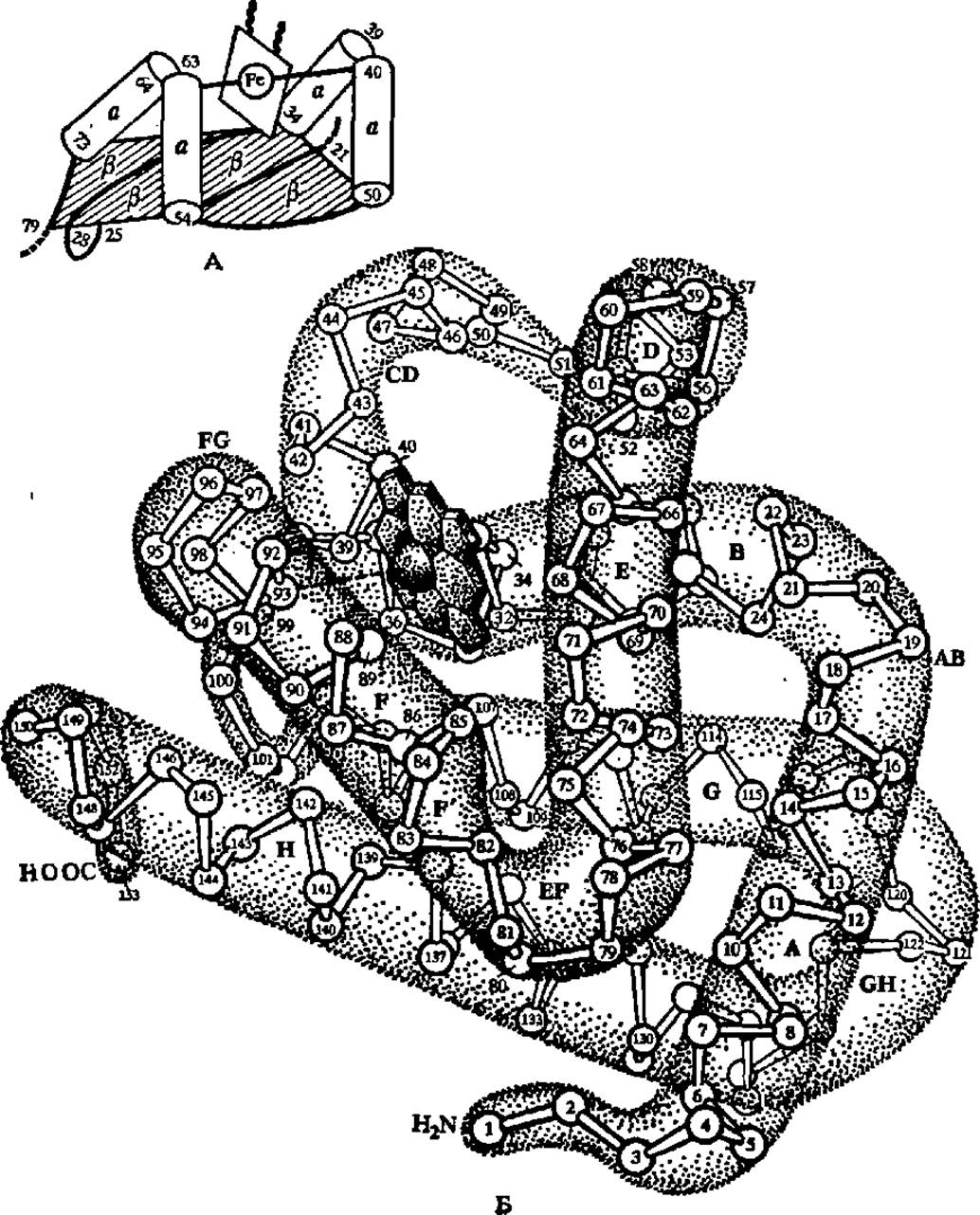
Рис. 33. а- и ß-Структуры во фрагменте молекулы цитохрома b5 и а-спиральные участки в молекуле миоглобина:
А — фрагменты полипептидной цепи цитохрома (остатки 21—25, 28—34, 50—54 и 73—79), образующие ß-слой, показаны толстыми линиями, сам слой отмечен значками ß; четыре а-структуры (остатки 34—39,40—50, 54—63,64—73) изображены в аиде цилиндров; между попарно объединенными a-спиралями располагается простетичсекая группа цитохрома b5, содержащая атом железа; Б — восемь а-спиральных участков в молекуле миоглобина (обозначены буквами латинского алфавита) резко преобладают над изгибами полипептидной цепи (обозначены сочетаниями AB, ВС и т. д.) по протяженности и пересекаются под различными углами; черный диск в верхней левой части молекулы — группа гема с атомом железа в центре
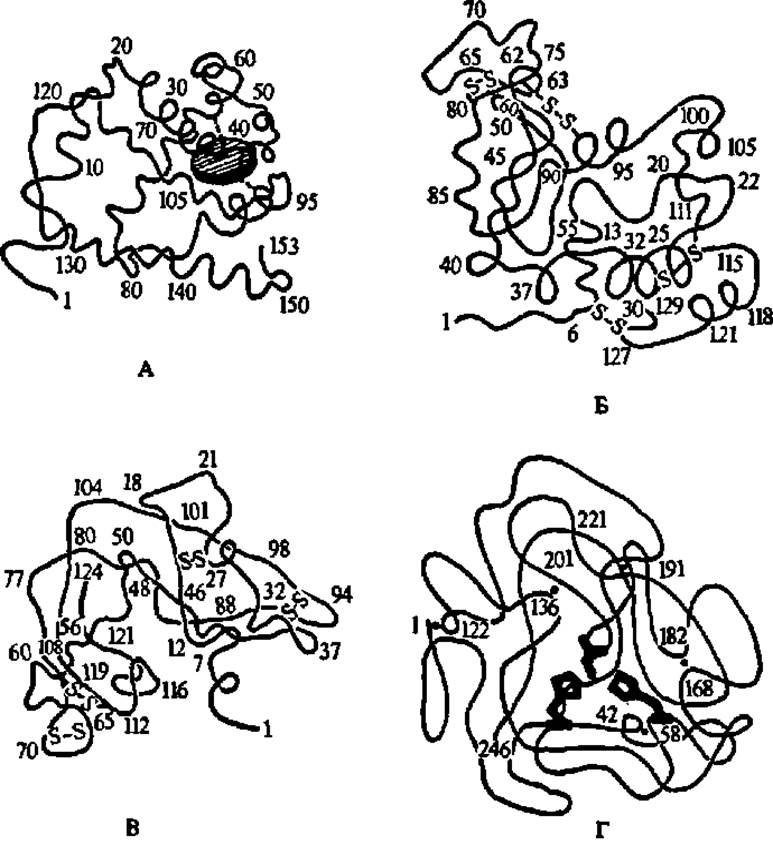
Рис. 34. Третичные структуры миоглобина (А), лизоцима (Б), рибонуклеази (В) и химотрипсиногена (Г)
Во всех случаях показаны конфигурация и расположение в пространстве хребта полипептидной цепи. Радикалы аминокислотных остатков нигде не обозначены, кроме трех радикалов в молекуле химотрипсиногена. А — заштрихованный диск — гем; пунктир — место прикрепления его к хребту полипептидной цепи посредством радикала гистидина; хорошо заметны а-спирали, составляющие 75% полипептидной цепи миоглобина; цифрами указаны номера аминокислотных остатков в полипептидной цепи (см. также рис. 33, б); Б — символами—S—S-обозначены дисульфидные мостики, образуемые при окислении радикалов цистеина; заметно, что a-cпиральная конфигурация присуща не более чем 1/3 полипептидной цепи; в верхней части молекулы видно углубление (щель), предназначенное для размещения субстрата, расщепляемого лизоцимом; В — а-спиральных конфигураций почтя не видно; остальные условные обозначения, как в А и Б; Г — ясно выраженных а-спиралей не наблюдается;—S—S-связи обозначены точками, здесь же цифрами указаны порядковые номера соответствующих остатков цистеина; в центре молекулы выделены штриховкой радикалы гистидина (пятиугольники) и радикал серина (короткий двурогий отрезок), образующие активный центр химотрипсина (после активирования химотрилсиногена), ответственный за гидролиз пептидных связей
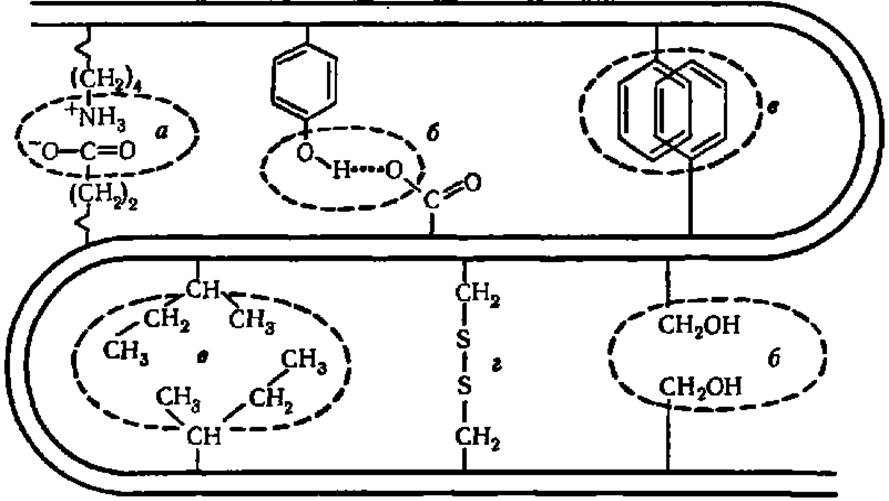
Рис. 35. Типы связей между радикалами аминокислотных остатков в белковой молекуле:
а — электростатическое взаимодействие; б — водородные связи; в — взаимодействие неполярных боковых цепей, вызванное вталкиванием лиофобных радикалов в «сухую зону» молекулами растворителя (так называемая «жирная капля»); г — дисульфидные связи. Двойная изогнутая линия обозначает хребет полипептидной цепи
Кроме ковалентных связей третичная структура белковой молекулы поддерживается силами слабых взаимодействий (рис. 35). Рассмотрение полных химических структур некоторых белков показало, что в их третичной структуре отчетливо выявляются зоны, где сконцентрированы гидрофобные радикалы аминокислот и полипептидная цепь фактически обматывается вокруг гидрофобного ядра. Более того, в ряде случаев в белковой молекуле обособляются два и даже три гидрофобных ядра, в связи с чем возникает двух- или трехъядерная структура. Такой тип строения молекулы характерен для многих белков, обладающих каталитической функцией (рибонуклеаза, лизоцим и др.).
Данные о полной химической структуре молекул ряда белков явились отправным пунктом для создания учения о доменном принципе строения белковой молекулы. Под доменом понимают обособленную область молекулы белка, обладающую в определенной степени структурной и функциональной автономией. У ряда ферментов, например, обособлены коферментсвязывающие домены. С учением о доменном принципе строения белков связано постепенно внедряющееся в белковую химию развитие представлений об элементах однотипности, блочности, стандартности третичной структуры белков, об ограниченности набора пространственных упаковок полипептидных цепей, реально существующих в природных белках.
Сейчас домены считают фундаментальными элементами структуры белковых молекул, и соотношение и характер компоновки а-спиралей и ß-слоев, как полагают, дает для понимания эволюции белковых молекул и филогенетических связей больше, чем сопоставление первичных структур. Причина этого лежит в том, что в процессе эволюции происходило слияние доменов, их удвоение, возникновение псевдосимметричных доменов из повторяющихся субдоменов; некоторые из этих событий связаны с дупликацией генов и другими изменениями генетического аппарата.
Есть много оснований полагать, что третичная структура белковой молекулы возникает совершенно автоматически. Движущей силой, свертывающей полипептидную цепь белка в строго определенное трехмерное образование, является взаимодействие аминокислотных радикалов с молекулами окружающего растворителя. При этом лиофобные радикалы вталкиваются внутрь белковой молекулы, образуя там сухие зоны («жирная капля»), а лиофильные — ориентируются в сторону растворителя. В некоторый момент достигается энергетически выгодная конформация молекулы в целом, и белковая молекула стабилизируется.
Самоорганизация полипептидной цепи определенного белка в только ему присущую уникальную пространственную структуру, т. е. процесс возникновения третичной структуры, проходит в несколько этапов (рис. 36).
На конформацию возникшей глобулы оказывают сильное влияние такие факторы, как pH среды, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами, что лежит в основе регуляции обмена веществ, в частности аллостерической регуляции активности ферментов.
Разработка представлений о самоорганизации белковых глобул сопровождалась не только введением понятия о доменах, о чем уже было сказано выше, но и новым подходом к характеристике уровней структуры белковых тел: к ним добавился упомянутый уже доменный уровень и надвторичная структура. Под последней подразумевают закономерности возникновения в процессе свертывания полипептидной цепи элементарных структур, представленных ß-слоями (ß, ß'-структура), сочетанием а-спиральных участков (а, а'-структура) или тех и других одновременно (рис. 37). Преобладающей среди надвторичных структур оказалась топология греческого ключа и греческого орнамента.
Существенно, что фрагменты полипептидной цепи, соответствующие доменам и даже субдоменам, способны независимо поддерживать близкую к нативной структуру. Так, цианбромидный фрагмент (121—316-й аминокислотные остатки) и его субдомен (205—316-й остатки) термолизина (протеолитического фермента из термофильной бактерии) самопроизвольно образуют стойко удерживаемую нативную структуру. Весь же процесс формирования третичной структуры таких, например, белков, как угольная ангидраза, а- и ß-лактоглобулин, фосфоглицераткиназа и лактамаза, занимает всего лишь 0,2 с. Вместе с тем выявлены факторы, лимитирующие скорость складывания полипептидов в процессе возникновения третичной структуры; к их числу относится цис-транс-изомеризация связи X — про (где X — любая аминокислота), ускоряемая пептидилпролил-цис-транс-изомеразой. Рассмотренный механизм самоорганизации белковых глобул получил изящное подтверждение в работах (начиная с 1988 года) по синтезу искусственных белков. Их создано к настоящему времени более двух десятков. Исходя из представлений о приуроченности а-спиралей, ß-слоев и участков неорганизованной полипептидной цепи к определенным аминокислотным последовательностям в синтетически полученных полипептидах, удалось сконструировать белковые молекулы, где автоматически и самопроизвольно возникали элементы вторичной и надвторичной структуры, неизбежно занимающие заранее рассчитанные позиции при формировании пространственной структуры молекулы такого искусственного белка. Так созданы методом белковой инженерии синтетические белки, получившие условные названия «Феликс» (от англ. four helices, т. е. из 4-х а-спиралей), «альбебетин» (построен из а-спиралей и ß-слоев в соотношении 1:2, т. е. аль: бебе) и т. п. Более того, они обладали заранее запрограммированными свойствами и биологической активностью.
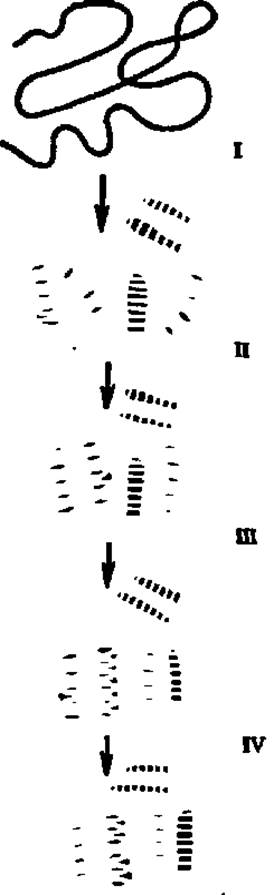
Рис. 36. Структурные превращения полипептидной цепи при формировании белковой глобулы
На І этапе происходят локальные взаимодействия на различных участках всей полипептидной цепи, в результате которых возникают флуктуирующие а-спирали и β-слои. Образование а-спиралей инициируется с той точки полипептида, где сосредоточены остатки дикарбоиовых аминокислот, и терминируется в зоне остатков диаминокислот, тогда как центральная часть возникающих а-спиралей занята аминокислотными остатками с гидрофобными радикалами. На этом этапе самоорганизации белковой молекулы возникает максимально возможное количество а-спиральных конформаций полипептида, охватывающее больную часть полипептидной цепи. Поэтому иллюстрируемая гипотеза самоорганизации белковых молекул получила название гипотезы избыточных спиралей. На II этапе осуществляется направленное сближение зародышевых структур, «схлопывание» а-спиралей и возникновение одного или нескольких гидрофобных ядер за счет контактов гидрофобных радикалов аминокислот а-спиралей. В этот момент возникает глобулярная структура. III этап сводится к компактизации зародышевых структур и преобразованию промежуточной, высокоспиральной глобулы в нативную глобулу. На IV этапе возникает окончательная, характерная для данного белка третичная структура молекулы
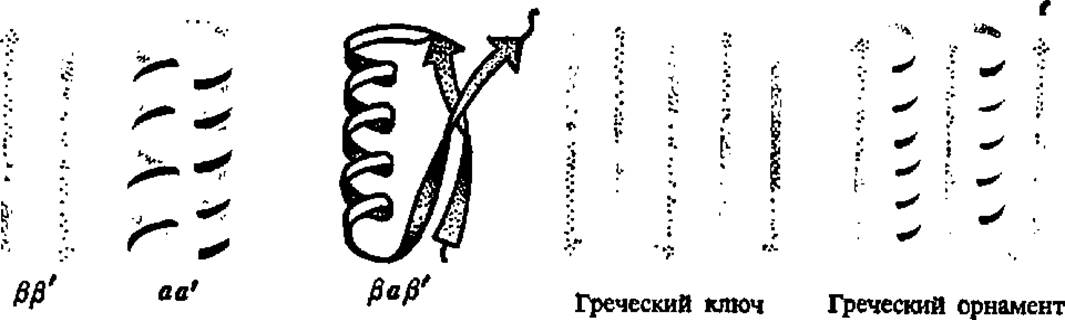
Рис. 37. Надвторичные структуры белка
Вместе с тем в течение последнего десятилетия взгляды на саморегуляцию процесса свертывания полипептидных цепей белков при формировании их третичной структуры in vivo существенно изменились. Оказалось, что приведенные выше преобразования (см. предыдущую стр. и рис. 36) осуществляются не сами по себе, а под влиянием особых, предназначенных именно для этой цели специфических белков, названных шаперонами (так в Англии называли пожилую даму, удерживающую от непродуманных контактов молодую девушку, впервые выходящую в свет под ее руководством). Будучи в большинстве своем трубчатыми олигомерами, составленными из 10—90 кДа субъединиц, объединенных в наложенные друг на друга семичленные кольца, они вовлекают внутрь олигомера пока еще неорганизованную полипептидную цепь и контролируют ход образования ею вторичных и надвторичных структур и их взаимную пространственную укладку (см. рис. 36), обеспечивающую возникновение третичной, присущей нативной (функционально значимой) глобуле данного белка.
Однако и эта концепция, по-видимому, — не последнее слово в далеко неоднозначно решаемой проблеме складывания (фолдинга) полипептидных цепей. Исходя из экспериментальных и теоретических подходов, разработанных в процессе исследований кода белкового синтеза (см. ниже, гл. VII) высказано предположение (Л. Б. Меклер и Р. Г. Идлис; Г. И. Чипенс) о существовании общего стереохимического генетического кода, позволяющего понять, как трехмерные молекулы белков сформировались из линейных полипептидных цепей. Суть вопроса сводится к наличию кода взаимодействия аминокислотных остатков друг с другом, что обеспечивает реализацию информации, уже заложенной в первичной структуре белка (и, естественно, в мРНК и ДНК) в виде элементов вторичной и надвторичной структур и, в конечном счете, в виде уникальной третичной структуры данного белка.
Четвертичная структура белка. Ранее уже было отмечено, что крупные молекулы белков состоят, как правило, из субъединиц со сравнительно небольшой молекулярной массой. Такие молекулы называют эпимолекулами (сверхмолекулы) или мультимерами, а составляющие их элементы — субъединицами или протомерами.
Структура, характеризующаяся наличием в белковой эпимолекуле определенного числа полипептидных цепей (субъединиц), занимающих строго фиксированное пространственное положение, вследствие чего белок обладает той или иной биологической активностью, называется четвертичной.
От четвертичной структуры следует отличать олигомерное и агрегированное состояние белка. Структура, характеризующаяся существованием в составе белковой частицы нескольких полипептидных цепей, число которых изменяется в определенной пропорции, называется олигомерной. Крайне важно, что, несмотря на относительное постоянство числа полипептидных связей в олигомере белка и их упорядоченное расположение, у олигомера не возникает биологической активности. Так, например, сывороточный альбумин быка существует в виде мономера (М = 68000), димера (М = 136000), тримера (М = 204 000) и тетрамера, причем мономеры, объединяясь в олигомерные структуры, располагаются в составе ди-, три- и тетрамера упорядоченно. Однако это не сопровождается возникновением каких-либо новых качеств по сравнению с теми, которыми обладает мономер данного белка.
Под агрегированным состоянием белка подразумевают такую структуру белковых частиц, которая представлена неопределенным и изменяющимся в широких пределах числом полипептидных цепей. При этом агрегация мономеров тоже не приводит к формированию каких-либо особых свойств у белка, находящегося в таком структурном состоянии. Так, цитохром с (и другие цитохромы) обладают резко выраженной способностью к агрегации молекул друг с другом, но этому явлению не сопутствует изменение свойств фермента.
Сейчас выяснена четвертичная структура нескольких сотен белков. В 1965 г. информация о четвертичной структуре ограничивалась примерно 20 белками; в 1970 г. появилась первая солидная сводка, включавшая 108 белков, а в 1976 г. Д. Дарнелл и И. Клотц опубликовали таблицу, содержавшую перечень свыше 500 белков и данные о молекулярной массе мультимеров, протомеров и количестве последних в эпимолекуле.
Оказалось, что число субъединиц в эпимолекулах колеблется в очень широких пределах: от 2 до 162. Наиболее часто в составе молекул-мультимеров насчитывается 2 или 4 протомера, гораздо реже — 6, 8, 10, 12 или 24 и в редчайших случаях — их нечетное количество. Четвертичной структурой обладают в основном белки с молекулярной массой выше 50000—60000, а белки с меньшими молекулярными массами существуют, как правило, в виде мономеров. Критическим пределом молекулярной массы белковой молекулы, сверх которого белок в большинстве случаев обладает четвертичной структурой, считают 100 000. Что касается молекулярных масс субъединиц, то они принимают самые разнообразные значения, от нескольких тысяч (например, 6000 у инсулина) до 330000 (у каждой из двух субъединиц тиреоглобулина — белка щитовидной железы, ответственного за биосинтез гормона тироксина — см. гл. XII).
Классическим примером белка, имеющего четвертичную структуру, является гемоглобин (рис. 38). Молекула гемоглобина (М = 68000) построена из четырех субъединиц с М = 17000 каждая. Первичная, вторичная и третичная структуры субъединиц молекулы гемоглобина полностью выяснены. Они оказались попарно идентичными и были названы субъединицами типа оси ß. Субъединица типа а представлена полипептидной цепью из 141 аминокислотного остатка, ß — из 146. Третичная структура их сходна. Четыре субъединицы (две типа ос и две типа ß) соединяются в единую молекулу гемоглобина, располагаясь в углах почти правильного тетраэдра (рис. 38, Б). Таким образом, возникает почти шаровидная молекула с параметрами 0,50 х 0,55 х 0,64 нм.
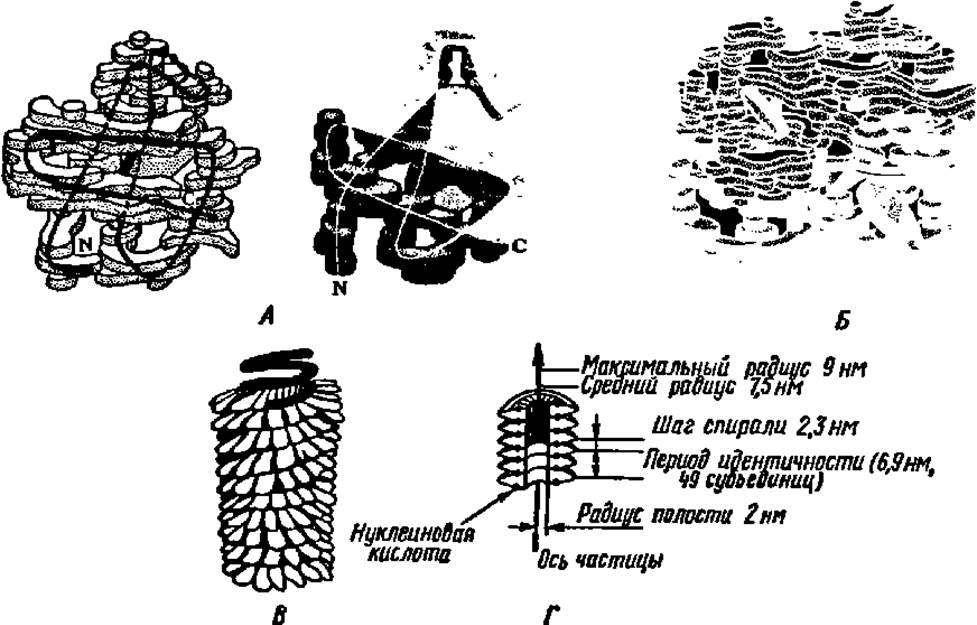
Рис. 38. Четвертичная структура белковых молекул:
А — модели субъединиц гемоглобина типа а (слева) и ß (справа). Блоки, из которых составлены модели, характеризуют распределение электронных плотностей в разных частях молекулы; черная (слева) и белая (справа) линии указывают расположение хребта полипептидной цепи; Б — трехмерная модель молекулы гемоглобина; субъединицы типа а (светлые) и ß (темные) расположены по углам почти правильного тетраэдра, темные диски — группы гема; В — модель молекулы вируса табачной мозаики: снаружи видны белковые субъединицы, темная спираль — нуклеиновая кислота; Г — расположение субъединиц в молекуле вируса табачной мозаики (разрез)
Принципиальный интерес для будущего учителя химии и биологии представляет вопрос о том, как взаимосвязаны структура гемоглобина с его функцией—способностью связывать, переносить и легко отдавать кислород. Это явление детально изучается в средней школе. Непосредственно молекула кислорода присоединяется к Fe2+, закрепленному в центре молекулы гема (рис. 39), который, в свою очередь, удерживается в гидрофобном кармане каждой из субъединиц, будучи присоединен координационными связями к имидазольным радикалам гистидина, расположенным в дистальной и проксимальной частях полипептидной цепи, образующей а- или ß-протомер гемоглобина. Присоединение кислорода к Fe2+ идет без изменения валентности последнего на одну из его свободных координационных связей; при этом радиус атома Fe2+ уменьшается и он вместе с О2 перемещается в плоскость порфиринового кольца. Здесь он удерживается до тех пор, пока молекула гемоглобина не будет перенесена в ткань с более низким содержанием О2, где и происходит обратный процесс отдачи кислорода. И связывание О2, и его высвобождение сопровождается конформационными изменениями структуры а- и ß-субъединиц гемоглобина и их взаимного расположения в мультимере.
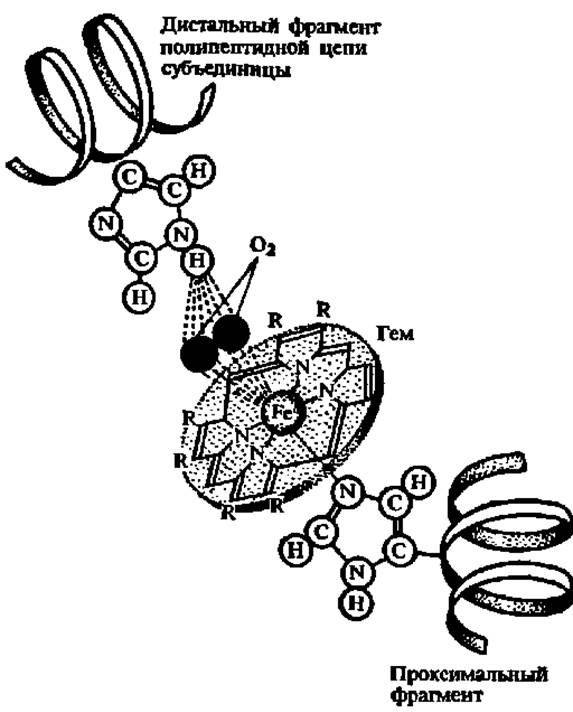
Рис. 39. Структура активного центра и механизм связывания кислорода субъединицей гемоглобина (пояснения в тексте)
На рис. 38 приведена также схема строения сложного белка (нуклепротеина)—вируса табачной мозаики. Его гигантская молекула (М = 40 000 000) содержит небольшое количество (около 6%) РНК, остальное приходится на белок. Белковая часть складывается из большого числа (2130) субъединиц с М = 17 500 каждая. Молекула вируса табачной мозаики представляет собой полую палочку длиной около 300 нм и толщиной примерно 17 нм, с отверстием в центре диаметром в 4 нм. Каждая субъединица имеет размеры 2 x 7 нм. Субъединицы расположены по спирали, каждый виток которой образован примерно 16 субъединицами. Молекула нуклеиновой кислоты, следуя спиральному расположению субъединиц, проходит между их рядами. Вдоль молекулы располагается свыше ста витков из белковых субъединиц.
Самое поразительное явление, наблюдающееся при изучении четвертичной структуры белковых молекул, состоит в том, что объединение протомеров в молекулу мультимера осуществляется самопроизвольно. Предполагают, что в молекуле каждого протомера есть специфические участки, взаимодействующие с таковыми в других протомерах. При соединении протомеров в мультимер возникают ионные связи. В их формировании принимают участие ионы металлов и иногда низкомолекулярные органические соединения. Однако наибольший вклад в поддержание целостности структуры мультимеров вносят силы слабых взаимодействий, а именно—гидрофобные взаимодействия и водородные связи; суммарный эффект тех и других достаточно велик» чтобы обеспечить стабилизацию четвертичной структуры белков. Как вне организма, так, видимо, и в клетках мультимеры способны обратимо диссоциировать на протомеры.
Принципиально важно, что малейшее изменение третичной структуры протомеров делает невозможным соединение их в молекулы мультимера, что резко сказывается на биологической активности белка. Поскольку третичная структура белка задается его первичной структурой, а также зависит от ряда других факторов (pH среды, концентрация солей и т. п.), то даже незначительное изменение первичной структуры белка или стандартных условий в клетке приводит к изменению функциональной активности белков. Указанные явления лежат в основе регулярных процессов в организме.