Основы биохимии - Филиппович Ю. Б. 1999
Белки
Очистка белков
Белки, выделенные описанными способами, всегда содержат некоторое количество низкомолекулярных примесей, особенно ионов солей. Для полного освобождения от этих примесей белки подвергают дальнейшей очистке путем диализа, электродиализа, ультрафильтрации и перекристаллизации, гельфильтрации и другими способами.
Очистка белков методом диализа состоит в длительном, в течение нескольких суток, пропускании воды через сосуд, в который погружен диализационный мешочек. Его готовят из материалов, хорошо проницаемых для низкомолекулярных соединений и ионов, но не пропускающих крупных молекул белка. Материалом для полупроницаемых мембран служит целлофан, размер пор которого можно изменять в широких пределах обработкой раствором ZnCl2. Внутрь диализационного мешочка (камеры) помещают раствор белка. Камеру, как правило, снабжают капиллярной трубкой. В нее в первые часы диализа устремляется часть белкового раствора, объем которого возрастает вследствие поступления воды внутрь камеры (рис. 12.1).
Даже после длительной очистки белка путем диализа в нем остается некоторое количество ионов, сорбированных. белковыми частицами. Для полного удаления загрязняющих белок ионов используют метод электродиализа: возле полупроницаемых мембран диализационной камеры помещают электроды, на которые подают напряжение, в результате чего остатки ионов поступают в омывающую мембраны воду и выносятся из аппарата (рис. 12.ІІ).
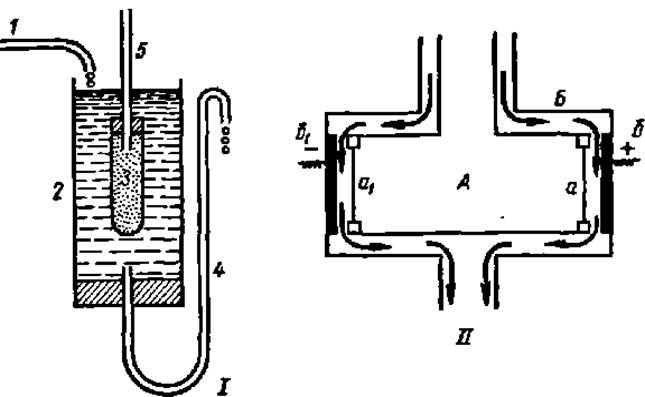
Рис. 12. Установки для очистки белка путем диализа (І) и электродиализа (ІІ):
1 — трубка для подведения воды; 2 — корпус диализатора; 3 — диализационный мешочек; 4 — трубка для отвода воды и регулирования ее уровня; 5 — капиллярная трубка; А — диализационная камера; Б — корпус электродиализатора; а и а1 — полупроницаемые мембраны; б и б1 — электроды; стрелками указано направление движения воды
Полупроницаемые мембраны высокой прочности из нецеллюлозных материалов с калиброванными порами, через которые проходят низкомолекулярные вещества, но не проникают высокомолекулярные белки, используют для очистки белков методом ультрафильтрации. Белковый раствор продавливают через такую мембрану сжатым газом или центробежной силой. Белок, остающийся в процессе ультрафильтрации на мембране, не только очищается от низкомолекулярных соединений и ионов, но и концентрируется. Если подобрать такой размер пор в мембране, что через них будут проходить не очень крупные белки, а большие белковые молекулы будут задерживаться, то ультрафильтрация может служить для фракционирования белков.
Долгое время считали, что белковые вещества существуют только в аморфном состоянии. Однако в 1906 г. наш соотечественник А. Д. Розенфельд впервые закристаллизовал оксидазу, выделенную из редьки, а в 1926 г. американский ученый Д. Самнер получил другой кристаллический белок — фермент уреазу (от лат. urea — мочевина). Затем в течение последующих лет были получены в кристаллическом состоянии десятки белков.
В настоящее время доказано, что любой белок может существовать в кристаллической форме. В основе различных приемов кристаллизации белка лежит принцип очень медленного приближения к той критической точке, в которой белок из растворенного состояния переходит в осадок. В этом случае белковые молекулы успевают закономерным путем объединиться в надмолекулярные агрегаты и дают кристаллические структуры. Практически такое медленное осаждение белков достигается путем введения соли через полупроницаемую мембрану или при медленном испарении воды из содержащего соль белкового раствора вплоть до точки высаливания. В последнее время получила распространение кристаллизация белков с использованием органических соединений: 2-метил-2,4-пентадиола и полиэтиленгликоля; с их помощью удалось закристаллизовать ряд белков, не поддававшихся этому традиционными методами.
Несколько видов белковых кристаллов приведено на рис. 13. Кристаллические белки, особенно полученные в результате перекристаллизации, отличаются высокой степенью чистоты.
Хорошие результаты дает очистка белков от низкомолекулярных примесей при помощи гельфильтрации. Зерна сефадекса достаточно долго удерживают низкомолекулярные вещества, и белковая фракция успевает за это время выйти из колонки в чистом виде. Фильтрацию через гель сефадекса широко используют для обессоливания белковых растворов.

Рис. 13. Виды белковых кристаллов: химотрипсина (А), пепсина (Б), белка дрожжей (В), рибонуклеази (І)