Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
ATP-Цикл и биоэнергетика клетки
Краткое содержание главы
Химические реакции протекают в таком направлении, чтобы при равновесии суммарная энтропия S системы и окружающей среды была максимальной, а свободная энергия G реагирующих молекул - минимальной. Каждая химическая реакция характеризуется определенным изменением стандартной свободной энергии ∆G0'; в качестве стандартных условий приняты: температура 25°С, давление 1 атм, концентрации всех исходных веществ и продуктов 1 М и pH 7,0. ∆G0' можно рассчитать по уравнению ∆G0' = -2,30 RTlgK'eq, если известна константа равновесия данной реакции K'eq. Величина ∆G0' гидролиза АТР до ADP и фосфата равна — 7,3 ккал/моль. У некоторых фосфорилированных соединений, например у 3-фосфоглицероил- фосфата и фосфоенолпирувата (двух промежуточных продуктов на пути расщепления глюкозы до лактата), ∆G0' гидролиза выражается гораздо более отрицательной величиной, чем у АТР; их можно рассматривать поэтому как сверхвысокоэнергетические соединения. Для некоторых других фосфорилированных соединений, например для глюкозо-6-фосфата, характерны меньшие по абсолютной величине значения ∆G0' гидролиза по сравнению с АТР; их называют низкоэнергетическими соединениями. Под действием специфичных киназ фосфатные группы от сверхвысокоэнергетических фосфатов, образующихся в процессе катаболизма, могут переноситься на ADP, в результате чего синтезируется АТР. Другие специфичные киназы катализируют перенос концевой фосфатной группы АТР на молекулы-акцепторы, которые превращаются при этом в фосфорилированные (низкоэнергетические) соединения и оказываются благодаря этому активированными; в таком виде они могут вступать в реакции биосинтеза. Следовательно. АТР в процессе метаболизма играет роль универсального промежуточного продукта - переносчика фосфатных групп. АТР также поставляет энергию для функционирования сократительных актиновых и миозиновых нитей скелетных мышц. За счет этой энергии осуществляется скольжение нитей друг относительно друга и как результат этого - сокращение мышцы; при этом АТР гидролизуется до ADP и фосфата. Креатинфосфат служит резервуаром высокоэнергетических фосфатных групп в мышечных и нервных клетках. Под действием креатинкиназы он может передавать свои фосфатные группы молекулам ADP. Химическую энергию для мембранных АТРаз тоже поставляет АТР; это дает им возможность переносить ионы Н+ и некоторые другие катионы через мембраны против градиента концентрации.
Используемый в биосинтетических реакциях АТР может отдавать либо ортофосфатную, либо пирофосфатную группу; в первом случае образуется ADP, во втором-АМР. Продукт, образующийся при пирофосфатном расщеплении, АМР, вновь фосфорилируется до ADP в реакции, катализируемой аденилаткиназой: АТР + AMP ⇄ 2ADP. Переносчиками высокоэнергетических фосфатных групп, направляемых в различные биосинтетические реакции, служат также и другие нуклеозид-5'-трифосфаты: GTP, UTP, СТР, dATP, dTTP и т.д.; эти же трифосфаты играют роль предшественников в биосинтезе нуклеиновых кислот. В интактных дышащих клетках концевая фосфатная группа АТР непрерывно и очень быстро замещается за счет пула неорганического фосфата; в них поддерживается стационарно-динамическое состояние, при котором расход АТР, связанный с отщеплением его концевой фосфатной группы, в точности уравновешивается ресинтезом АТР из ADP и фосфата.
ЛИТЕРАТУРА
Книги
Atkinson D. Е. Cellular Energy Metabolism and Its Regulation, Academic Press, New York, 1977. Ценная книга, в которой подчеркивается важность энергетического заряда клетки для регуляции клеточного метаболизма.
Becker W. М. Energy and the Living Cell, Harper and Row, New York, 1977. В книге поставлено много проблем и предложены способы их решения.
Blum Н. F. Time’s Arrow and Evolution, 3d ed, Princeton University Press, Princeton, N.J., 1968. Очерки и размышления по вопросу об энтропии в биологии.
Broda Е. The Evolution of Bioenergetic Processes, Pergamon, Oxford, 1975. (Имеется перевод: Брода Э. Эволюция биоэнергетических процессов.- М.: Мир, 1978.) Сравнительные и эволюционные аспекты биоэнергетики.
Krebs Н. А., Kornberg H.L. Energy Transformations in Living Matter, Springer, New York, 1967. Классический анализ энергетики гликолиза и дыхания.
Lehninger A. L. Bioenergetics, 2d ed., Benjamin, Menlo Park, Calif., 1971. Вводный курс, освещающий различные аспекты биоэнергетики.
Lipmann F. Wanderings of a Biochemist, Wiley, New York, 1971. Новое издание классических статей одного из первых исследователей в области биоэнергетики, а также его воспоминания.
Miller G. Т, Jr. Energetics, Kinetics and Life, Academic, New York, 1970. Биоэнергетика и экология.
Wood W. В., Wilson J. H., Benbow R. M., Hood L.E. Biochemistry: A Problems Approach., 2d ed., Benjamin, Inc., Menlo Park, Calif., 1981.
Отдельные статьи
Erecinska M., Wilson D. F. Homeostatic Regulation of Cellular Energy Metabolism, Trends Biochem. Sci., 3, 221-223 (1978).
Gates D. M. The Flow of Energy in the Biosphere, Sci. Am., 224, 88-100, September 1971.
Ingraham L. L., Pardee A. B. Free Energy and Entropy in Metabolism, pp. 1-46. In: D. M. Greenberg (ed.). Metabolic Pathways, 3d ed., vol. 1, Academic, New York, 1967.
Satir P. How Cilia Move, Sci. Am., 231, 44-52, October 1974.
Tribus M., McIrvine К. C. Energy and Information, Sci. Am, 225,179-188, September 1971.
Вопросы и задачи
1. Вычисление величины ∆G0' по константе равновесия. Вычислите изменение стандартной свободной энергии следующих метаболически важных ферментативных реакций при 25°С, исходя из приведенных значений констант равновесия (pH 7,0):

2. Вычисление константы равновесия по величине ∆G0'. Вычислите константы равновесия следующих реакций при pH 7,0 и температуре 25 °С используя данные, приведенные в табл. 14-3:
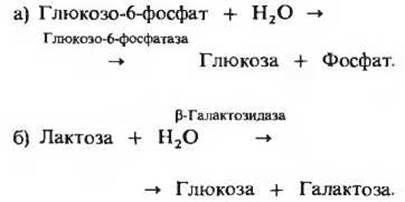
![]()
3. Величина ∆G0, для сопряженных реакций. Глюкозо-1-фосфат превращается во фруктозо-6-фосфат в двух последовательных реакциях:
Глюкозо-1 -фосфат → Глюкозо-6-фосфат,
Глюкозо-6-фосфат → Фруктозо-6-фосфат.
Используя значения ∆G0', приведенные в табл. 14-3, вычислите константу равновесия K'qe для суммарной реакции при 25 °С Глюкозо-1-фосфат → Фруктрзо-6-фосфат.
4. Стратегия преодоления неблагоприятных этапов: АТР-зависимое химическое сопряжение. Первым этапом катаболизма глюкозы является фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Прямое фосфорилирование глюкозы неорганическим фосфатом описывается уравнением
![]()
а) Вычислите константу равновесия приведенной выше реакции. В клетке печени крысы физиологические концентрации глюкозы и фосфата поддерживаются на уровне около 4,8 мМ. Какой будет равновесная концентрация глюкозо-6-фосфата при прямом фосфорилировании глюкозы неорганическим фосфатом? Можно ли считать приемлемым такой метаболический путь для катаболизма глюкозы? Выскажите свои соображения.
б) Теоретически можно увеличить концентрацию глюкозо-6-фосфата, сдвинув равновесие реакции вправо за счет повышения внутриклеточных концентраций глюкозы и фосфата. Примем, что концентрация фосфата неизменна и равна 4,8 мМ. Насколько потребуется при этом повысить внутриклеточную концентрацию глюкозы для того, чтобы равновесная концентрация глюкозо-6-фосфата составила 250 мкМ (именно такова его нормальная физиологическая концентрация)? Можно ли считать этот путь приемлемым с физиологической точки зрения, если учесть, что максимальная растворимость глюкозы меньше 1 М?
в) В этой главе мы говорили о том, что фосфорилирование глюкозы сопряжено в клетке с гидролизом АТР; таким образом, часть свободной энергии гидролиза АТР используется для осуществления неблагоприятного в энергетическом отношении фосфорилирования глюкозы.

Вычислите значения ∆G0' и K'eq для суммарной реакции. При таком АТР-зависимом фосфорилировании глюкозы, какой должна быть концентрация глюкозы для того, чтобы внутриклеточная концентрация глюкозо-6-фосфата составила 250 мкМ, если концентрации АТР и ADP равны соответственно 3,38 и 1,32 мМ? Можно ли считать такой сопряженный процесс хотя бы теоретически приемлемым путем для фосфорилирования глюкозы в клетке? Почему?
г) С термодинамической точки зрения сопряжение гидролиза АТР с фосфорилированием глюкозы не является невозможным, но мы не знаем, как оно происходит в действительности. Поскольку для сопряжения необходим какой-то общий промежуточный продукт, одна из возможностей заключается в том, что за счет гидролиза АТР увеличивается внутриклеточная концентрация неорганического фосфата, и это облегчает протекание неблагоприятной с термодинамической точки зрения реакции фосфорилирования глюкозы неорганическим фосфатом. Представляется ли вам этот путь подходящим? Аргументируйте свой ответ.
д) В клетках печени АТР-сопряженное фосфорилирование глюкозы катализируется ферментом глюкокиназой. Этот фермент связывает АТР и глюкозу, в результате чего образуется комплекс глюкоза-АТР-фермент и фосфат переносится непосредственно от АТР к глюкозе. В чем заключаются преимущества такого пути?
5. Вычисление величин ∆G0' для АТР-сопряженных реакций. Исходя из данных табл. 14-5, вычислите значения ∆G0' для реакций:
а) Креатинфосфат + ADP →
→ Креатин + АТР;
б) АТР + Фруктоза →
→ ADP + Фруктозо-6-фосфат.
6. Вычисление ∆G0' при физиологических условиях. Вычислите изменение свободной энергии ∆G' (не ∆G0') при физиологических условиях для реакции
Креатинфосфат + ADP →
→ Креатин + АТР,
протекающей в цитозоле клеток мозга при 25°С и следующих концентрациях компонентов: креатинфосфат - 4,7 мМ, креатин - 1,0, ADP - 0,20 и АТР - 2,6 мМ.
7. Потребность в свободной энергии при синтезе АТР в физиологических условиях. В цитозоле печени крысы отношение действующих масс равно
![]()
Вычислите количество свободной энергии, необходимое для синтеза АТР в печени крысы.
8. Суточная утилизация АТР в организме взрослого человека.
а) Количество свободной энергии, необходимое для синтеза АТР из ADP и неорганического фосфата (Рi) при концентрациях исходных веществ и продуктов 1 М (стандартное состояние), составляет 7,3 ккал/моль. Поскольку истинные физиологические концентрации ADP, Рi и АТР в клетках отличаются от 1 М. количество свободной энергии, необходимой для синтеза АТР при физиологических условиях, отличается от ∆G0'. Вычислите количество свободной энергии, необходимое для синтеза АТР в клетке печени человека при физиологических концентрациях АТР, ADP и Pi, равных соответственно 3,5, 1,50 и 5,0 мМ.
б) Здоровый взрослый человек, вес которого составляет около 70 кг, должен ежедневно получать с пищей 2000 ккал. Пищевые вещества расщепляются в процессе метаболизма и высвобождающаяся при этом свободная энергия используется для синтеза АТР, который затем расходуется на выполнение ежедневной работы организма, химической и механической. Вычислите (в весовых единицах) количество АТР, утилизируемого за сутки организмом взрослого человека, если принять, что эффективность превращения заключенной в пище энергии в энергию АТР равна 50%. Какой процент от веса тела составляет это количество АТР?
в) Хотя ежедневно в организме взрослого человека образуются значительные количества АТР, вес тела, его строение и состав за этот период существенно не меняются. Как можно объяснить это?
9. Запас АТР в мышечной ткани. Концентрация АТР в мышечной ткани (в которой около 70% приходится на долю воды) равна приблизительно 8,0 мМ. В периоды усиленной мышечной активности АТР расходуется для мышечного сокращения со скоростью 300 мкмоль/мин на 1 г мышечной ткани.
а) На сколько времени хватает этого запаса АТР спринтеру, бегущему 100-метровую дистанцию?
б) Концентрация креатинфосфата в мышечной ткани составляет примерно 40,0 мМ. На какое время позволит креатинфосфат растянуть запас мышечного АТР?
в) Что делает возможным марафонский бег при таком запасе АТР?
10. Расщепление АТР в процессе метаболизма до АМР и PPi. Образование активированной формы ацетата (ацетил-СоА) представляет собой ATP-зависимый процесс
Ацетат + СоА + АТР →
→ Ацетил-СоА + АМР + РРі.
а) Величины ∆G0' гидролиза ацетил-СоА до ацетата и СоА и АТР до АМР и РРi равны соответственно -7,5 и -7,3 ккал. Вычислите величину ∆G0' для ATP-зависимого синтеза ацетил-СоА.
б) Почти во всех клетках присутствует фермент (неорганическая пирофосфатаза), катализирующий гидролиз РРi до неорганического фосфата (Рi). Как влияет присутствие этого фермента на синтез ацетил-СоА? Дайте полный ответ.