Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Аспарагиновая кислота и аспарагин
Обратимое превращение аспарагиновой кислоты в щавелевоуксусную было рассмотрено в гл. III. Процессу окисления углеродного остова аспарагиновой кислоты, наблюдаемому в опытах с тканевыми препаратами крысы [10], вероятно, предшествует переаминирование. Аспарагиновая кислота декарбоксилируется различными специфическими декарбоксилазами с образованием либо а-аланина, либо ß-аланина (стр. 208). Были рассмотрены также роль аспарагиновой кислоты в образовании аргининоянтарной кислоты в процессе синтеза мочевины (стр. 339) и использование а-аминогруппы аспарагиновой кислоты в биосинтезе пуринов (стр. 283 и [11]). L- и D-изомеры аспарагиновой кислоты не дезаминируются со сколько-нибудь заметной скоростью под действием общих аминокислотных оксидаз. Однако L-аспарагин окисляется оксидазой змеиных ядов, а относительно специфичные оксидазы, найденные в почках животных различных видов, катализируют окисление D-аспарагиновой кислоты (стр. 187). Биосинтез аспарагина был рассмотрен в гл. Ill; этот вопрос нуждается в дальнейшем изучении [12]. В организме животных, по-видимому, возможен синтез аспарагина. Имеются данные, показывающие, что в процессе всасывания из кишечника аспарагин гидролизуется (стр. 167). Ткани некоторых животных [13—21] и растений [22], а также микроорганизмы [23—26] обладают аспарагиназной активностью. Дезамидирование аспарагина в присутствии а-кетокислот («аспарагиназа II») происходит в результате переаминирования аспарагина с образованием амида а-кетоянтарной (щавелевоуксусной) кислоты, который гидролизуется специфической амидазой (стр. 223).
Синтез аспарагиновой кислоты у микроорганизмов, возможно, происходит в результате аминирования щавелевоуксусной кислоты (или в некоторых случаях в результате превращения фумаровой кислоты в аспарагиновую путем аспартазной реакции; см. ниже). Функция биотина в синтезе аспарагиновой кислоты связана, по-видимому, с процессом фиксации СО2 при образовании щавелевоуксусной кислоты [27—33].
У некоторых микроорганизмов и высших растений [34—40] аспарагиновая кислота обратимо дезаминируется ферментом аспартазой с образованием фумаровой кислоты:
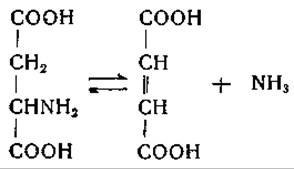
Аспартаза бактерий была очищена и обстоятельно изучена [39, 40]. Фермент содержит магний и одну тиоловую группу [40]. Любопытно, что в ранних исследованиях, посвященных аспартазе, Гейл [38] нашел, что она нуждается в адениловой кислоте в качестве кофермента. Недавно Картер и Коэн [41, 1075] выделили из дрожжей аденилоянтарную кислоту; препараты дрожжей катализируют обратимое образование этого соединения из фумаровой и адениловой кислот:
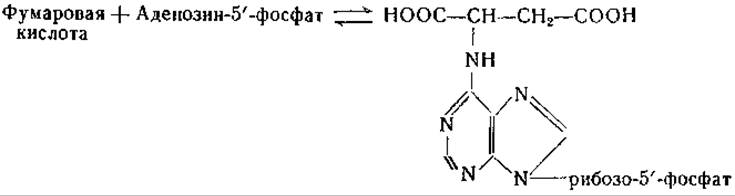
В дальнейшем Либерман [42] нашел у Escherichia coli ферментную систему, катализирующую образование аденилоянтарной кислоты из инозиновой и аспарагиновой кислот; в реакции принимает участие гуанозинтрифосфат (ГТФ):
![]()
Эти исследования показали, что механизм введения азота а-аминогруппы аспарагиновой кислоты в положение 6 инозиновой кислоты связан с использованием гуанозинтрифосфата как источника энергии.
Абрамс и Бентли [43] доказали превращение инозиновой кислоты в тканях животных в ксантозин-5'-фосфат путем окисления при участии дифосфопиридиннуклеотида, а также аминирование ксантозин-5'-фосфата в гуанозин-5'-фосфат в присутствии L-глутаминовой кислоты или глутамина. Эти исследователи нашли также, что для аминирования инозиновой кислоты в адениловую кислоту необходимы аспарагиновая кислота и источник энергии; как теперь полагают, этим источником является гаунозинтрифосфат [42]. Мойэд и Магазаник [1076] описали ферментативное превращение ксантозин-5'-фосфата (КМФ) в гуанозин-5'-фосфат (ГМФ) под действием препаратов из Aerobacter aerogen.es. В реакции участвуют аденозинтрифосфат (АТФ) и аммиак; продуктами ее являются адениловая кислота (АМФ) и неорганический пирофосфат.
КМФ + АТФ + NH3 → ГМФ + АМФ + Пирофосфат
В свежих неочищенных ферментных препаратах активными донаторами аммиака могут служить глутамин и глутаминовая кислота, тогда как препараты, подвергшиеся старению, утилизируют аммиак лучше, чем глутамин или глутаминовую кислоту. Между тем Бентли и Абрамс нашли, что в костном мозге кролика [1077] специфическим предшественником аминогруппы гуанозин-5'-фосфата является амидная группа глутамина. Аналогичная реакция катализируется экстрактами печени голубя [1078]. Судя по имеющимся данным, можно предполагать, что животные ткани утилизируют для образования гуанозин-5'-фосфата глутамин, тогда как у единственного изученного до сего времени бактериального вида A. aerogenes в этой реакции используется аммиак.
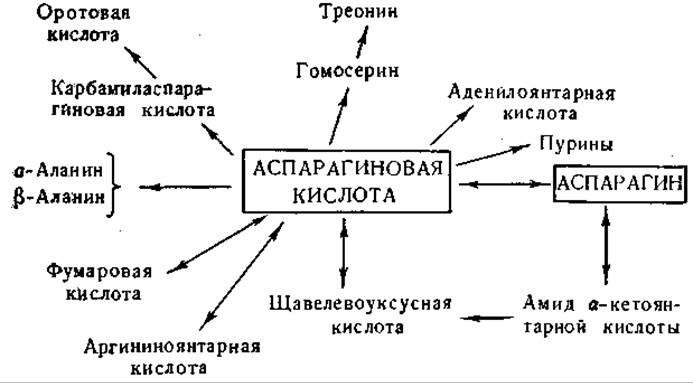
Фиг. 8. Сводная схема превращений аспарагиновой кислоты и аспарагина.
Аспарагиновая кислота является предшественником оротовой кислоты, а последняя — предшественником пиримидинов. При исследовании питания микроорганизмов установлена взаимосвязь между процессами обмена аспарагиновой кислоты и пиримидинов. Так, например, пиримидиновые основания могут проявлять сберегающее действие по отношению к аспарагиновой кислоте [44]. Углерод аспарагиновой кислоты переходит в печени крысы в углерод пиримидинов [45]. Можно считать доказанным, что карбамиласпарагиновая, или уреидоянтарная, кислота служит предшественником оротовой кислоты, образование которой можно представить следующим образом [46—50]:
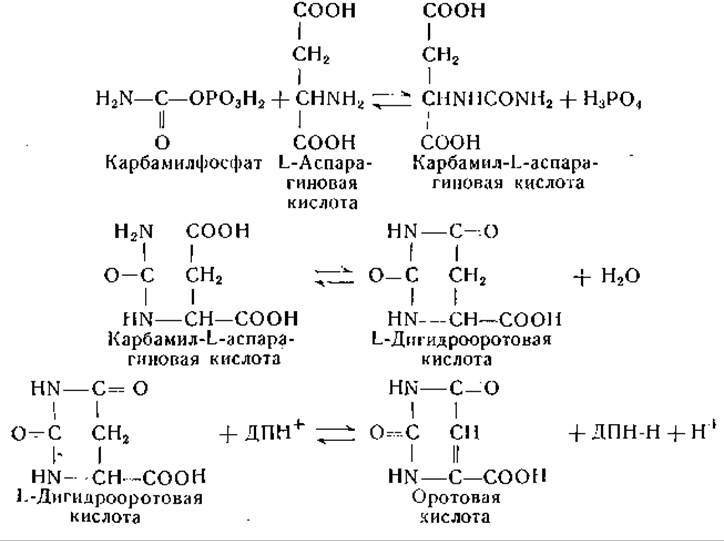
Биосинтез пиримидинов могут обеспечивать также некоторые другие аминокислоты. Так, было найдено, что некоторые мутанты Neurospora, нуждающиеся в пиримидине, растут на средах, содержащих а-аминомасляную кислоту или треонин, в отсутствие аспарагиновой кислоты или других аминокислот [51].