Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Глутаминовая кислота и глутамин
Многие реакции обмена глутаминовой кислоты и глутамина рассматриваются в других разделах этой книги. К ним относятся: реакция с участием глутаматдегидрогеназы (стр. 190), окисление D-глутаминовой кислоты (стр. 187) и L-глутамина (стр. 188), декарбоксилирование L-глутаминовой кислоты (стр. 200), переаминирование D- и L-изомеров глутаминовой кислоты (стр. 215) и L-глутамина (стр. 217), реакции переноса у-глутамильного остатка (стр. 176 и 268), взаимоотношения между глутаминовой кислотой, пролином, орнитином и аргинином (стр. 343), функции глутамина в синтезе пуринового ядра (стр. 283), синтез глутамина (стр. 269), реакция глутамина с фенилуксусной кислотой (стр. 421), роль глутамина в переносе и резервировании аммиака, а также в образовании аммиака мочи (стр. 174), значение глутамина как незаменимой аминокислоты для роста клеток млекопитающих в тканевой культуре (стр. 131). Глутаминовая кислота входит в состав витаминов группы фолевой кислоты, глутатиона и пептидов типа стрепогенина. Глутамин и глутаминовая кислота присутствуют в значительных количествах в различных белках (табл. 1). Количество глутамина в крови млекопитающих по сравнению с другими аминокислотами весьма значительно (табл. 3).
Недавно получены данные о роли глутамина в синтезе гиалуроновой кислоты у стрептококков [1079]. Найдено, что амидный азот глутамина может служить предшественником азота гистидина (стр. 390). Известно, далее, что некоторые растения накапливают наряду с аспарагином очень большие количества глутамина [52—59].
Синтез глутатиона обсуждался ранее (стр. 268). Глутатион может синтезироваться из глицина, цистеина и глутаминовой кислоты с участием аденозинтрифосфата, а также путем реакции переноса [60]. Глутатион является коферментом глиоксалазы [61] и участвует в превращении 3-фосфоглицеринового альдегида в 3-фосфоглицериновую кислоту [62, 67]. Недавно установлено, что глутатион играет роль активного регулятора в реакции захватывания пищи у гидры [63].
У микроорганизмов синтез глутаминовой кислоты происходит путем аминирования а-кетоглутаровой кислоты [64, 65, 68, 69]. Однако у Clostridium kluyverii, как установлено путем изотопных исследований, образование глутаминовой кислоты происходит другим путем, возможно — из пролина [66, 70].
Известно, что дезамидирование глутамина происходит при действии нескольких ферментных систем. В 1904 г. Ланг [71] наблюдал, что препараты некоторых животных тканей катализируют это превращение. Как сообщил позднее Кребс [72], экстракты мозга, сетчатки, печени и почек млекопитающих отщепляют амидную группу глутамина. Гринстайн и сотрудники 118, 73—77] открыли в животных тканях два типа процессов дезамидирования глутамина. Один из этих процессов ускоряется в присутствии фосфата и в меньшей степени арсената или сульфата («глутаминаза I»), второй процесс катализируется а-кетокислотами («глутаминаза II»). Последняя система связана с реакцией переаминирования (стр. 221). Механизм реакции, осуществляемой глутаминазой I, неизвестен, хотя фосфат, бикарбонат и арсенат могут катализировать аналогичные неферментативные реакции с образованием пирролидонкарбоновой кислоты [78]. S-Амид а-аминоадипиновой кислоты, а-метилглутамин и 7-метилглутамин дезамидируются неферментативным путем с такой же скоростью, как и глутамин, или несколько быстрее [79]. Однако очищенные препараты глутаминазы на эти соединения [80] почти не действуют.
Глутаминазной активностью обладают также растительные ткани [22, 81] и некоторые микроорганизмы [82—88]. Некоторые препараты глутаминаз могут также осуществлять реакции переноса с участием гидроксиламина, приводящие к образованию
у-глутамилгидроксамовой кислоты и аммиака. Эти реакции протекают без добавления катионов и нуклеотидов и в этом отношении отличаются от реакций переноса у-глутамила, протекающих при участии ферментов, синтезирующих глутамин (стр. 271). Вэлш и сотрудники [89, 90] нашли, что экстракты Proteus vulgaris катализируют обмен N15-аммиака с амидными группами глутамина и аспарагина, а также образование у-глутамилгидроксамовой и ß-аспартилгидроксамовой кислот из гидроксиламина и ω-амидов а-аминокислот. Очевидно, гидроксиламин может заменять природный субстрат. Предполагают также, что реакции «ω-переноса» с участием глутамина могут играть роль при образовании а-пептидов [90, 91]; необходимо дальнейшее изучение этой проблемы.
О роли глутамина как незаменимого фактора роста для животных клеток в культурах ткани уже говорилось (стр. 131). Мак-Илвен и сотрудники [92, 93] впервые наблюдали, что глутамин необходим для оптимального роста различных микроорганизмов. Эти авторы отмечали, что рост Streptococcus hemolyticus значительно усиливается при добавлении к питательной среде экстракта из сердечной мышцы. Ростовой фактор был выделен и идентифицирован как глутамин [92]. В последующих работах было найдено, что другие микроорганизмы проявляют аналогичную потребность в глутамине для своего роста (см., например, [94, 105]).
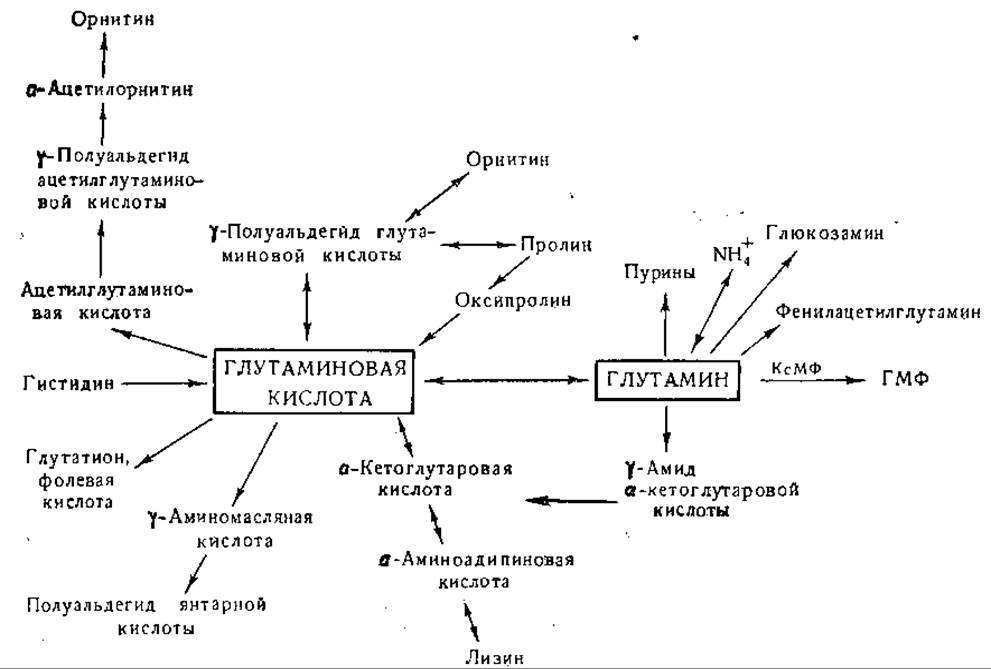
Фиг. 9. Сводная схема превращений глутаминовой кислоты и глутамина.
Имеются данные, указывающие на участие глутамина в синтезе аргинина у Lactobacillus arabinosus [106]. В тканях млекопитающих глутамин, по-видимому, не используется непосредственно в синтезе аргинина (стр. 338), хотя можно считать установленным, что амидный азот глутамина в некоторых тканевых препаратах используется как предшественник азота мочевины [107, 1080]. Известно, что глутамин может, подобно содержащим его пептидам, повышать токсинообразование у Clostridium tetani [100]. Роль глутамина в стимулировании роста не ясна. В дополнение к перечню обменных и физиологических реакций глутамина, приведенному выше, можно добавить, что он стимулирует процесс гликолиза [108—110] и служит донатором азота при образовании глюкозамин-6-фосфата из гексозо-6-фосфата [111]. Учитывая многочисленные функции глутамина и его значение как составной части белка, можно себе представить, что в клетке, в которой отсутствует система, синтезирующая глутамин, последний может служить лимитирующим фактором для синтеза белка, подобно другим незаменимым аминокислотам.
Некоторые растения содержат значительные количества y-метиленпроизводных глутаминовой кислоты и глутамина (стр. 47). Описаны процессы переаминирования рметиленглутаминовой кислоты и рметиленглутамина (стр. 238), а также декарбоксилирования рметиленглутаминовой кислоты с образованием а-метилен-раминомасляной кислоты (стр. 204). Фауден [112] нашел, что экстракты из тканей ростков арахиса дезамидируют рметиленглутамин. Глутамин дезамидируется этими тканевыми препаратами значительно медленнее. Обзор данных, касающихся обмена производных глутаминовой кислоты (включая описанную недавно y-окси-y-метилглутаминовую кислоту) у растений, опубликован Стюардом и Поллардом [113].
Установлено, что у крыс введение глутамина per os снижает добровольное потребление растворов спирта. Другие аминокислоты, исследованные в этом отношении, оказались неактивными. Механизм этого эффекта глутамина не ясен [1081].