Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
Общие свойства аминокислот
Химические реакции
Для синтеза, определения и характеристики аминокислот, выделенных из природных продуктов и находящих применение в биохимических исследованиях, существенное значение имеют свойственные им химические реакции. Кроме того, многие реакции аминокислот, с которыми имеет дело химик-органик, подобны тем, которые имеют место и в живой клетке. Ниже рассматриваются химические свойства аминокислот, представляющие интерес с биохимической точки зрения. Более подробно вопросы химии аминокислот освещены в монографиях Кларка [115], Блока [116], Хау [109] и Денюэля [117]. Аминокислоты, обладающие первичной аминогруппой, реагируют с азотистой кислотой с образованием соответствующей оксикислоты и выделением азота:
![]()
Эта реакция легла в основу нитритного метода Ван-Слайка для определения аминокислот; выделяющийся азот может быть определен газометрическим [118, 119] или манометрическим методом [120].
В реакции с азотистой кислотой пролин и оксипролин не дают азота, а цистеин, цистин и глутаминовая кислота дают его в количестве, превышающем эквимолекулярное.
Реакция аминокислот с нингидрином имеет большое значение для обнаружения аминокислот на хроматограммах и для их количественного определения. Большинство аминокислот реагирует с нингидрином с образованием угольного ангидрида, аммиака и соответствующего альдегида [121—123]:
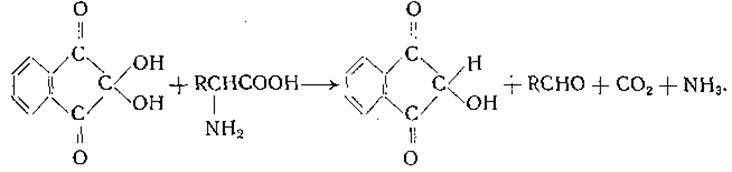
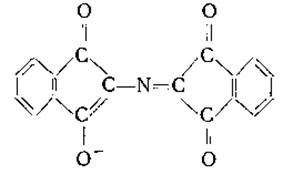
Образовавшиеся аммиак, угольный ангидрид и альдегид доступны количественному определению. Кроме того, можно определить интенсивность сине-фиолетовой окраски «пурпура Руэманна» (енолят индандион-2-N-2'-инданона), образующегося при реакции аммиака с нингидрином и продуктом восстановления нингидрина (инданон-ендиолом) [124—126]; формула «пурпура Руэманна» имеет вид
При реакции аспарагиновой кислоты с нингидрином выделяются две молекулы углекислоты, а пролин и оксипролин дают с нингидрином желтую окраску, но не образуют аммиака. Пептиды глутаминовой и аспарагиновой кислот, в которых а-карбоксильные и а-аминные группы свободны, в отличие от а-глутамил- и а-аспартил-пептидов реагируют с нингидрином с образованием СО2 и аммиака.
Аминогруппы аминокислот можно подвергнуть ацилированию при помощи различных реагентов, например ацетилхлорида, бензоилхлорида, хлорацетилхлорида, фталевого ангидрида, карбобензоксихлорида. Последний реагент, введенный в практику Бергманом и Цервасом [127], оказался особенно ценным для защиты аминогруппы при синтезе пептидов:
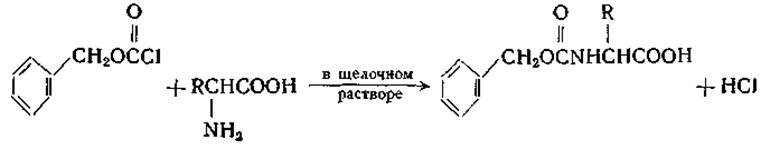
Карбобензоксигруппу можно легко отщепить путем каталитического гидрирования [127], а также при помощи бромистого водорода в ледяной уксусной кислоте [128], йодистого фосфония [129J или металлического натрия в жидком аммиаке [130].
Большое значение имеет реакция образования 2,4-динитрофенильных (ДНФ-) производных аминокислот:
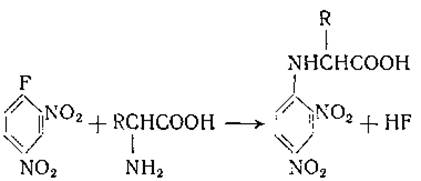
Динитрофенильные производные аминокислот относительно устойчивы при кислотном гидролизе; это свойство и другие особенности этих производных дают возможность использовать их для определения N-концевых групп белков и пептидов.
Абдергальден и Стикс [131] впервые получили динитрофенильные производные аминокислот при кипячении щелочных растворов аминокислот с 1-хлор-2, 4-динитробензолом. Соответствующее фторпроизводное, рекомендованное Сангером [132, 133], реагирует с аминокислотами в растворе бикарбоната при комнатной температуре и потому практически более удобно. Все N-динитрофенильные производные аминокислот окрашены в желтый цвет, что облегчает их идентификацию на хроматограммах. Некоторые аминокислоты реагируют более чем с одним молем реагента; так, в реакцию с 1-фтор-2,4-динитробензолом вступают как а-, так и ω-аминогруппы лизина и орнитина, иминоазот гистидина, фенольная группа тирозина и сульфгидрильная группа цистеина. Поэтому перечисленные аминокислоты образуют бис-динитрофенильные производные.
Сангер нашел, что свободные аминогруппы белков реагируют с 1-фтор-2,4-динитробензолом при слабощелочном pH и комнатной температуре. Ему удалось осуществить гидролиз динитрофенильных производных белков в условиях, при которых связи между динитрофенильной группой и аминокислотами сохраняются. Пользуясь указанным методом, можно во многих случаях определить число открытых пептидных цепей в молекуле белка и установить природу N-концевых остатков. Этот метод позволяет судить о содержании лизина в белках, так как фтординитробензол реагирует со свободными ε-аминогруппами лизина, входящего в состав белка. Метод динитрофенильных производных оказывает большую помощь в расшифровке строения белковой молекулы: одним из выдающихся примеров явилось успешное применение этого метода Сангером при выяснении строения молекулы инсулина (стр. 27).
Для определения природы и числа концевых групп белков применяются и другие методы. Эдман [134] использовал реакцию между аминогруппой и фенилизотиоцианатом, при которой образуются фенилтиокарбамиламинопроизводные. Фенилтиокарбамилпептиды расщепляются под действием кислот с образованием тиогидантоина соответствующей N-концевой аминокислоты. Непосредственным продуктом кислотного расщепления фенилтиокарбамилпептида является соответствующий 2-анилино-5-тиазолинон. Тиазолинон гидролизуется с образованием фенилтиокарбамиламинокислоты, которая циклизуется в тиогидантоин.
В безводной среде тиазолинон может переходить непосредственно в тиогидантоин путем внутримолекулярной перегруппировки:
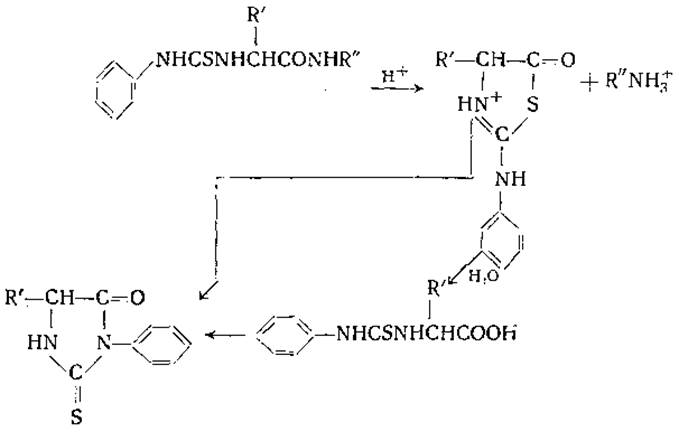
n-йодфенилсульфонилхлорид (пипсилхлорид) также реагирует с аминогруппами белков. Метод, основанный на этой реакции, был использован для определения N-концевых групп [135].
![]()
Свободные карбоксильные группы белков труднее поддаются определению, чем свободные аминогруппы. Один из приемов, предложенных для этой цели, заключается в превращении карбоксильной группы в спиртовую [136]. Путем обработки белка или пептида спиртовым раствором хлористого водорода или диазометаном переводят свободные карбоксильные группы в эфирные, а затем эфирные группы восстанавливают до спиртовых литийборгидридом (LiBH4). При кислотном гидролизе обработанного таким образом материала остатки аспарагиновой кислоты дают лактон гомосерина, а остатки глутаминовой кислоты появляются в виде а-амино-δ-оксивалерьяновой кислоты. Остатки глутамина и аспарагина, присутствующие в молекуле исходного белка, при гидролизе превращаются в соответствующие дикарбоновые кислоты. Один из способов определения С-концевых остатков основан на применении карбоксипептидазы (из сока поджелудочной железы), специфически отщепляющей С-концевую аминокислоту. Этот метод страдает рядом недостатков, один из которых состоит в том, что фермент может отщеплять наряду с С-концевой группой следующий за ней аминокислотный остаток. Описание других методов, применяемых для определения концевых групп в белках, можно найти в статье Фокса [137].
О превращении эфиров аминокислот в спирты упомянуто выше. Эфиры аминокислот широко использовал Фишер для разделения аминокислот и для синтеза пептидов. Наиболее полезным в ряде случаев оказалось применение бензиловых эфиров аминокислот, так как они легко расщепляются при каталитическом восстановлении, а также путем омыления. Эфиры аминокислот служат промежуточными продуктами при получении соответствующих амидов, гидроксамовых кислот, гидразидов и азидов.
Восстановление карбоксильной группы аминокислоты в метальную достигается путем превращения соответствующего спирта в ди-0,N-n-толуолсульфонильное производное; последнее восстанавливают литийалюминийгидридом в N-n-толуолсульфонильное производное желаемого амина [138].
При нагревании аминокислот в сухом состоянии или в высококипящих растворителях они декарбоксилируются [139], в результате чего образуется соответствующий амин. Реакция аналогична ферментативному декарбоксилированию аминокислот (стр. 199):
![]()
При нагревании аминокислот могут образовываться дикетопиперазины. Эфиры аминокислот также могут превращаться в соответствующие дикетопиперазины. Метиловый эфир глицина спонтанно переходит в дикетопиперазин в водном растворе:
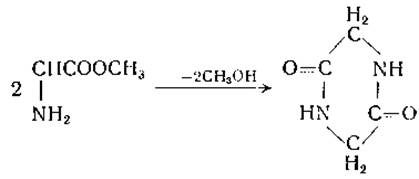
С метиловым эфиром глицина реакция протекает легче, чем с глициновыми эфирами высших спиртов [140]. Незначительные количества дикетопиперазинов найдены в белковых гидролизатах; возможно, что циклизация аминокислот происходит во время гидролиза белков или при выделении аминокислот.
Аминокислоты реагируют в щелочном растворе с углекислотой, превращаясь в карбамидокислоты, которые можно осадить в виде солей:
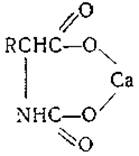
Некоторые из них обладают малой растворимостью и нашли применение для выделения аминокислот. При кипячении водных растворов солей карбамидокислот они разлагаются [141, 142]. Карбамидная связь играет известную роль в переносе углекислоты кровью.
В литературе описано получение фосфоамидных производных аминокислот [143, 144]. На аминокислоты (глицин, глутаминовую кислоту, аланин, тирозин) воздействуют хлорокисью фосфора в щелочной суспензии гидрата окиси магния и выделяют продукт реакции в виде магниевой соли. Хотя полученные продукты не были полностью охарактеризованы, величины отношения N/P соответствовали теоретически рассчитанным. Продукты синтеза гидролизуются разбавленными кислотами и препаратами фосфатазы.
Получены также фосфокарбоновые производные некоторых аминокислот. Первым был приготовлен ß-аспартилфосфат; Блэк и Райт [145] получили это соединение в растворе при помощи следующих реакций. а-Бензиловый эфир ß-хлорангидрида N-карбобензокси-L-аспарагиновой кислоты реагировал со смесью фосфата серебра и фосфорной кислоты с образованием соответствующего ß-фосфата. Затем бензильную и карбобензоксигруппу удаляли путем каталитического гидрирования. Канальский и Пехт [146] получили фосфокарбоновые производные ряда аминокислот путем конденсации серебряной соли карбобенз- оксиаминокислоты с дибензилхлорфосфонатом. После удаления блокирующих групп обработкой сухим бромистым водородом фосфоангидриды аминокислот получали в виде масел, содержащих 70—90% чистого продукта. Канальский и Пехт синтезировали также y-глутамилфосфат, применив метод, аналогичный методу Блэка и Райта [145], с той разницей, что для защиты аминогруппы было применено ацетилирование; ацетильный остаток затем отщепляли ферментативно при pH 7 [147].
Шантренн синтезировал карбобензоксиглицил-фенилфосфат, приводя карбобензоксиглицилхлорид во взаимодействие с дисеребряной солью фенилфосфата. Карбобензоксиглицил-фенилфосфат реагирует с аминокислотами при нейтральном pH с образованием сответствующих пептидов. Кроме того, Шантренн осуществил синтез гиппуровой кислоты из дибензоилфосфата и глицина [148—150].