Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
Общие свойства аминокислот
Определение аминокислот
Для количественного определения аминокислот применяют самые разнообразные методы; наиболее важные из них можно разбить на следующие группы: 1) химические методы; 2) ферментативные методы; 3) методы с применением изотопов; 4) микробиологические методы и 5) хроматографические методы. Из химических методов особое значение имеют метод с использованием азотистой кислоты (стр. 33) и методы, основанные на реакции с нингидрином (стр. 33—34).
Для определения отдельных аминокислот разработан ряд специфических методов. В качестве примера можно привести окисление оксиаминокислот йодной кислотой (стр. 21), применимое для определения серина, треонина и 8-оксилизина (стр. 50). Применяются также весовые методы, основанные на избирательном осаждении некоторых аминокислот специфическими реагентами. К специфическим химическим методам определения аминокислот относятся также модифицированная реакция Паули на гистидин (стр. 15), цветная реакция Сакагути на аргинин (стр. 13) и реакция Салливана на цистеин (стр. 23).
Некоторые аминокислоты (гистидин, лизин, аргинин, глутаминовая и аспарагиновая кислоты, орнитин, фенилаланин) могут быть определены путем их ферментативного декарбоксилирования специфическими бактериальными препаратами (стр. 206). Для определения аминокислот в белковых гидролизатах с успехом применен метод разбавления изотопной метки [151, 152]. Принцип его заключается в том, что к гидролизату белка добавляют меченый препарат какой-либо аминокислоты; последнюю выделяют, и рассчитывают концентрацию ее в гидролизате по степени разбавления изотопной метки в выделенной аминокислоте.
При другом изотопном методе аминокислоты, присутствующие в смеси, количественно переводят в производные радиоактивного реагента [например, n-йодфенилсульфонилхлорида (пипсилхлорида)] и после добавления определенной пипсиламинокислоты в качестве «носителя» выделяют соответствующее производное в чистом виде.
Зная количество добавленного к смеси нерадиоактивного носителя и удельные активности производного, выделенного из смеси (вместе с носителем) и соответствующим образом приготовленного стандарта, можно рассчитать количество данной аминокислоты в исходной смеси [153].
Существуют также многочисленные микробиологические методы определения аминокислот, основанные на подборе таких условий, при которых определяемая аминокислота становится фактором, лимитирующим скорость роста того или иного микроорганизма. Вопрос о потребности микроорганизмов в аминокислотах для обеспечения роста рассматривается в гл. II (стр. 133).
Развитие хроматографических методов разделения и идентификации аминокислот значительно облегчило проведение исследований с аминокислотами; многие успехи, достигнутые в изучении аминокислот за последнее время, непосредственно связаны с применением хроматографии. Занимаясь разделением аминокислот, Нейбергер [154] в 1938 г. обнаружил, что у ацетилпроизводных разных нейтральных аминокислот коэффициенты распределения между водой и несмешивающимися с водой растворителями различны. В 1941 г. Мартин и Синг [155] осуществили разделение ацетилированных аминокислот на силикагеле; последний служил инертной опорой для водной фазы, через которую протекал неводный растворитель. В дальнейшем эта техника была усовершенствована. Большим достижением явилось использование фильтровальной бумаги в качестве неподвижной фазы [156], что привело к широкому развитию разнообразных методов хроматографии на бумаге (см. Блок и др. [157]). В настоящее время считают, что в процессе разделения веществ на бумаге наряду с распределением между растворяющими фазами играют роль также механизмы адсорбции и ионного обмена.
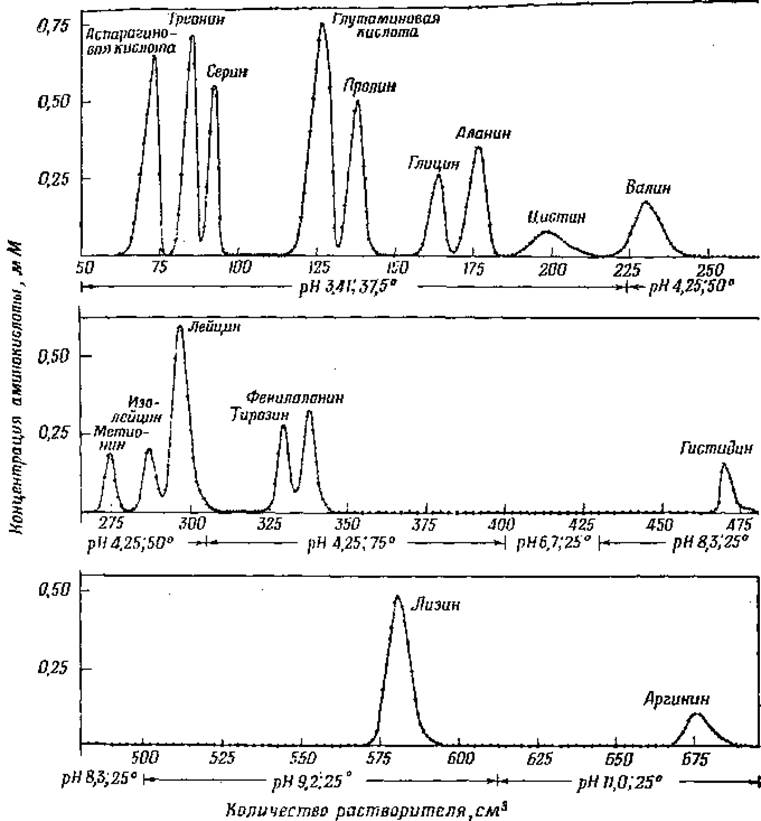
Фиг. 4. Разделение смеси аминокислот на колонке с катионитом дауэкс-50 [158].
В последние годы получил широкое распространение метод разделения аминокислот на колонках с крахмалом или полистироловыми смолами (например, дауэкс-50), разработанный Муром и Стайном [158]. Принцип метода заключается в том, что исследуемый раствор смеси аминокислот вносят в верхнюю часть колонки, заполненной адсорбентом или ионообменной смолой. При соответствующих условиях удается элюировать аминокислоты раздельно и определить их количественно посредством колориметрической реакции с нингидрином. Пример разделения смеси аминокислот известного состава при помощи этого метода представлен на фиг. 4. При хроматографическом определении аминокислот на бумаге небольшое количество исследуемого материала наносят на полосу бумаги и высушивают, после чего опускают край бумаги в растворитель, который под действием капиллярных сил протекает по полосе бумаги, омывая точки нанесения веществ. Отношение расстояния, на которое переместилась на бумаге данная аминокислота, к расстоянию, пройденному фронтом растворителя (величина Rf) характерно для каждой аминокислоты при определенных условиях (тип бумаги, состав растворителя, температура и т. д.). Несколько аминокислот могут в данной системе иметь одно и то же значение Rf; поэтому при исследовании смеси аминокислот желательно использовать несколько различных систем растворителей. При помощи двухмерного хроматографирования удается разделить почти все природные аминокислоты. При этом способе через бумагу пропускают два растворителя в двух взаимно-перпендикулярных направлениях. На фиг. 5 изображена схема двухмерной хроматограммы, проявленной сперва смесью фенол—вода—аммиак, а затем коллидином, с последующим опрыскиванием хроматограммы раствором нингидрина для выявления расположения аминокислот. При обработке нингидрином большинство аминокислот обнаруживается на хроматограммах в виде пурпурных пятен. Предложен ряд способов количественного определения аминокислот путем извлечения прокрашенных пятен из хроматограмм и определения интенсивности окраски полученных растворов.
Очень важно помнить, что, несмотря на большую ценность хроматографического метода как способа разделения аминокислот, для окончательной идентификации аминокислот этот метод следует использовать в сочетании с другими. Даже если величины Rfнеизвестной аминокислоты и аминокислоты, используемой в качестве эталона, не различаются при хроматографировании в целом ряде растворителей, для окончательного доказательства тождества между неизвестной аминокислотой и аминокислотой-эталоном необходимы дополнительные критерии; тем не менее совершенно очевидно, что данные хроматографического анализа часто оказываются решающими при идентификации вещества.
Для обнаружения и идентификации аминокислот на хроматограммах помимо нингидринового теста могут быть использованы и другие цветные реакции. Так, гистидин и другие имидазольные производные можно обнаружить в виде красных пятен, применяя диазореакцию по Паули или варианты этой реакции. Пролин и оксипролин обнаруживаются в виде синих пятен после обработки хроматограмм изатином, а оксипролин дает, кроме того, фиолетовое окрашивание с реактивом Эрлиха (n-диметиламинобензальдегид) после предварительной обработки хроматограммы перекисью водорода или изатином (стр. 19). Серин и треонин можно обнаружить на хроматограммах при помощи раствора перйодата, содержащего реактив Несслера; аммиак, образующийся при реакции оксиаминокислот с перйодатом (стр. 21), дает с реактивом Несслера желтую окраску. Аргинин выявляется на хроматограмме в виде красных пятен, если обработать ее щелочным раствором 1-нафтола и затем опрыскать раствором гипохлорита (реакция Сакагути). Нитропруссидную реакцию можно с успехом использовать для обнаружения цистеина и цистина; эти аминокислоты (после обработки цианидом) при опрыскивании хроматограммы раствором нитропруссида образуют красные пятна. Цистеин, метионин и некоторые другие восстанавливающие вещества могут быть идентифицированы в виде белых пятен на розовом фоне при обработке хроматограммы реактивом с йодистой платиной. Триптофан дает с реактивом Эрлиха пурпурную окраску, если хроматограмму прогреть при 100° в течение нескольких минут. Эти и другие методы обнаружения аминокислот на хроматограммах подробно описаны в книге Блока и др. [157].
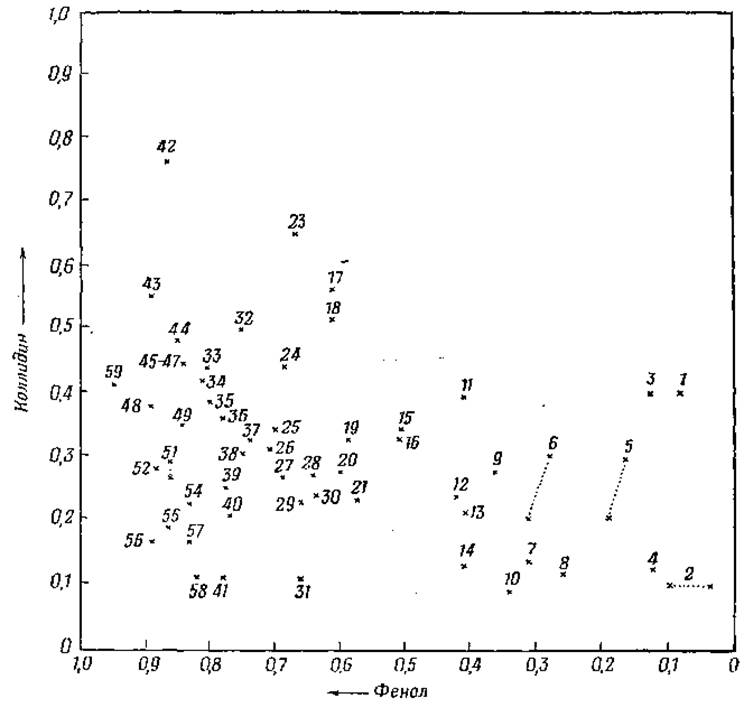
Фиг. 5. Схема двухмерной хроматограммы аминокислот на бумаге [159].
1 — цистеиновая кислота; 2 — фосфосерин; 3 — гомоцистеиновая кислота; 4 — глутатион; 5 — аспарагиновая кислота; 6 — глутаминовая кислота; 7 — цистатионин; 8 — лантионин; 5 — серин; 10 — фосфоэтаноламин; 11 — таурин; 12 — глицин; 13 — аспарагин; 14 — дженколовая кислота; 15 — аллотреонин; 16 — треонин; 17 — дийодтирозин; 18 — тирозин; 19 — пеницилламин (окисленная форма); 20 — аланин; 21 — глутамин; 23 — монойодтирозин: 24 — глюкозамин; 25 — метионинсульфон; 26 — а-аминомасляная кислота; 27 — гистидин; 28 — оксипролин; 29 — ß-аланин; 30 — цитруллин; 31 — оксилизин; 32 — триптофан; 33 — а-аминофенил- уксусная кислота; 34 — метионин; 35 — норвалин; 36 — валин; 37 — а-аминоизомасляная кислота; 38 — а-амино-ε-оксикапроновая кислота; 39 — метионин-сульфоксид; 40 — y-аминомасляная кислота; 41 - орнитин; 42 — тироксин; 43 — а-аминооктановая кислота; 44 — фенилаланин; 45— лейцин; 46 — изолейцин; 47 — норлейцин; 48 — этаноламин; 49 — а-метил-а-аминомасляная кислота; 51 — 1-метилгистидин; 52 — пролин; 54 — карнозин; 55 — ε-аминогексановая кислота; 56 — аргинин; 57— δ-аминовалерьяновая кислота; 58 — лизин; 59 — гистамин.
Полезен способ определения тирозина и триптофана, основанный на измерении поглощения ими ультрафиолетовых лучей [160]. У тирозина максимум поглощения расположен при 275 мμ, у триптофана — при 280 мц. Фотометрию в ультрафиолете используют также для определения содержания этих аминокислот в белках [160]. По интенсивности поглощения в ультрафиолетовой части спектра можно измерять концентрацию белка в растворе [161—165] (поглощение обусловлено в основном присутствием в белке остатков тирозина, триптофана и, в меньшей степени, фенилаланина). При этом обычно требуется поправка на поглощение в ультрафиолете за счет нуклеиновых кислот (их учитывают по величине оптической плотности при 260 мμ) [165].