Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Синтез пептидных связей
Включение аминокислот в белки
Первые доказательства включения аминокислот в белки были получены Шёнхаймером и его сотрудниками [73—80]. Эти авторы показали, что меченые аминокислоты при введении их крысам с пищей в течение нескольких дней включаются в белки различных тканей. Шёнхаймер учитывал, что наблюдаемое им включение могло являться результатом либо синтеза белка de novo, либо реакции замещения, либо обоих этих процессов. Хотя аналогичные эксперименты проведены и многими другими исследователями, природа реакций, с которыми связано включение, остается еще неясной. Последующие работы показали, что вопрос действительно весьма сложен и что исследуемый процесс связан с множеством факторов. Найдено, что ряд тканей (например, слизистая кишечника, печень, почки, селезенка) включают аминокислоты очень быстро, тогда как в некоторых других (например, в ткани кожи, мышц, мозга) наблюдается лишь медленное включение. Кроме того, степень включения в данную ткань нередко меняется в зависимости от периода времени, истекшего после введения изотопа. На включение метки влияет, естественно, как количество введенных аминокислот, так и степень их разведения свободными аминокислотами тканей.
В многочисленных опытах этого рода не было сделано попыток выделить индивидуальные белки. Однако разные белки одной и той же ткани, несомненно, воспринимают различные количества меченой аминокислоты. Появилось множество исследований об обновлении белков. Обстоятельные обзоры этих данных опубликованы Тарвером [582, 583]. У крыс мышечные белки, по-видимому, обновляются значительно медленнее, чем белки внутренних органов; установлено также, что отдельные белки мышечной ткани обновляются с различной скоростью [584]. Скорость оборота коллагена крайне низка у взрослых особей и несколько более высока у молодых животных [585—589]. У различных белков сыворотки крови эта величина также неодинакова [582]. Альбумин обновляется относительно медленно по сравнению с глобулинами и фибриногеном.
Имеются данные о том, что белки плазмы находятся в равновесии с белками тканей; иначе говоря, тканевые белки могут быть использованы для образования белков плазмы, и наоборот [590, 591]. Вероятно, это использование в том и другом случае связано с распадом исходного белка и ресинтезом нового белка [592—594]. Согласно этим представлениям, белки плазмы могут служить источником аминокислот для синтеза белков тканей. Не исключена возможность использования при этом пептидных фрагментов. Белки плазмы используются тканями весьма эффективно; это можно объяснить, по крайней мере отчасти, тем, что эти белки легко проникают через клеточные мембраны. Альбумин, фибриноген и значительная часть фракции глобулинов, вероятно, синтезируются в печени. Опыты с введением меченых аминокислот лактирующим животным показали, что белки плазмы не являются прямыми предшественниками белков молока [595, 596], поскольку степень включения метки в белки молока значительно превышает степень ее включения в белки плазмы. Подобное же заключение можно сделать относительно синтеза яичного альбумина у кур [597, 598]. Найдено также, что включение меченых аминокислот в антитела имеет место у активно иммунизированных животных, тогда как при введении меченых аминокислот в организме пассивно иммунизированных животных включение метки в антитела отсутствует [599].
Очевидно, что обновление белков отражает совокупность процессов синтеза и распада; до сих пор исследования процессов обновления не дали однозначного ответа на вопрос о том, могут ли аминокислоты включаться в белки при отсутствии реального синтеза de novo. Эти исследования мало чем обогатили наши познания о механизме процессов анаболизма и катаболизма белков.
Часто высказывалось предположение, что все внутриклеточные и внеклеточные белки животных тканей подвергаются непрерывному распаду и синтезу. Однако фактически не получено однозначных данных, показывающих, что все внутриклеточные белки обновляются. Описанные явления включения меченых аминокислот и обновления белка можно истолковать и как результат распада клеток и секреции белков клетками. Опыты с применением меченых аминокислот показали, что, как правило, в тканях, у которых скорость смены клеток и скорость секреции белков невелики (например, в мышцах), оборот белка происходит относительно медленно, тогда как ткани, которым свойственны быстрая смена клеток и активная секреция белка (например, ткани печени и слизистой кишечника), характеризуются высокой скоростью обновления. Возможно, что молекулы внутриклеточных белков остаются стабильными до тех пор, пока они не секретируются клеткой или пока клетка не разрушается. Включение изотопа во внутриклеточный блок, согласно этой концепции, происходит лишь в связи с синтезом молекулы белка. Такой синтез может происходить во время активного роста ткани или представлять функцию процесса «изнашивания» ткани.
Представление о стабильности внутриклеточных молекул белка, противопоставляемое идее о том. что эти молекулы пребывают в состоянии динамического равновесия, находит подтверждение в исследованиях, проведенных на некоторых бактериальных системах. Моно и сотрудники [600, 601] исследовали индуцированный синтез ß-галактозидазы в растущих клетках Escherichia coli. При выращивании на сравнительно простой среде, содержащей соли и янтарную кислоту, эти микроорганизмы не синтезируют заметных количеств ß-галактозидазы. Если же добавить к растущей культуре соответствующее индуцирующее соединение (например, галактозид, который не обязательно является субстратом ß-галактозидазы), то клетки начинают синтезировать ß-галактозидазу в таком количестве, что ее можно выделить в очищенном виде. Клетки метили, выращивая их в среде, содержащей S35-сульфат и не содержащей индуцирующих соединений. Затем меченые клетки отмывали от среды и суспендировали в немеченой среде, содержавшей индуцирующее соединение. Выделенная в этих условиях ß-галактозидаза не обладала сколько-нибудь заметной радиоактивностью.
В других опытах было показано, что после предварительного накопления меченой ß-галактозидазы в клетках Е. coli распад меченого фермента не превышал 0,4% в условиях, при которых масса бактерий увеличилась на 900%. Эти данные отчетливо показывают стабильность молекулы фермента, а также других белков в растущих клетках Е. coli. Ротман и Шпильгельман [602] провели аналогичные опыты с С14 и также не получили данных, подтверждающих наличие оборота белков. Кох и Леви [603], работая с Е. coli, тоже нашли, что скорость распада белка в растущих культурах очень невелика. Таким образом, работы, проведенные различными методами, показывают, что оборот белка в клетках Е. coli во время роста чрезвычайно мал. Совершенно очевидно, что между бактериями и животными объектами имеются значительные различия. Сложность строения животных тканей, в которых содержатся клетки различных типов, затрудняет выполнение исследований, подобных тем, которые были проведены на бактериях. Без сомнения, скорость синтеза белка в растущих клетках Е. coli намного выше, а скорость расщепления белка — значительно ниже, чем в тканях животных. Уместно, однако, напомнить, об исследованиях Шимина и Риттенберга, в которых было найдено, что в эритроцитах человека гемоглобин не подвергается обновлению в течение всей жизни этих клеток; меченые клетки не теряли изотопную метку до тех пор, пока не наступал их распад [604, 605]. Подобные результаты получены и другими авторами [606, 607].
Найдено, что скорости включения меченых аминокислот в различные белки мышц кролика не одинаковы [608]. Эти данные можно объяснить либо различиями в скорости оборота белков, либо различной скоростью их синтеза. Поэтому такие опыты не позволяют решить вопрос о наличии внутриклеточного оборота белков. Результаты недавних исследований на животных объектах подтверждают гипотезу о динамическом состоянии внутриклеточных белков. Так, например, при инкубировании клеток асцитного рака Эрлиха, меченных in vivo С14-аланином, лизином или глицином, наблюдался выход аминокислот из клеток без сопутствующей общей убыли белка [711, 712].
Для решения вопроса о включении аминокислот в белки были проведены многочисленные исследования in vitro с применением меченных изотопом С14-аминокислот и препаратов различных тканей [609, 613]. Обычно препараты тканей инкубировали в течение короткого периода времени с мечеными аминокислотами, после чего белки осаждали и промывали раствором трихлоруксусной кислоты для удаления аминокислот и других низкомолекулярных соединений. Появление свободных меченых аминокислот при действии протеолитических ферментов на меченый белок и отсутствие образования меченой углекислоты при действии нингидрина на белок (в тех случаях, когда были использованы аминокислоты, меченные по карбоксилу) свидетельствует о включении аминокислот в пептидную связь [614— 617]. Описано также выделение радиоактивных пептидов из продуктов частичного гидролиза меченого белка [618]. Однако возникают связи и другого рода. Например, цистин может включаться в белок путем образования дисульфидных связей [619], а меченный по тиометильной группе метионин может превращаться в метилмеркаптан, который связывается с белком [620]. К числу трудностей, возникающих при толковании этих исследований, относится тормозящее действие D-компонента рацемических аминокислот, использованных в ряде опытов [621], а также превращение аминокислот в другие аминокислоты или иные соединения. Большие затруднения при такого рода исследованиях связаны и с тем, что исследуемые меченые продукты представляют собой обычно неопределенную смесь белков и, вероятно, других соединений.
В одном из исследований было найдено, что включение аминокислот в дезоксирибонуклеогистоны зависит от продолжительности инкубирования, pH и концентрации аминокислот [622]. Включенные аминокислоты были прочно связаны, и карбоксил аминокислот не освобождался при действии нингидрина. Это включение, которое, возможно, не было обусловлено образованием пептидных связей, усиливалось при повышении температуры до 100°. Другой необычный тип включения наблюдали в опытах с лизином [623, 624, 714], который, по-видимому, образует связи с белком через ε-аминогруппы.
В большинстве исследований включение аминокислот продолжалось в течение нескольких часов и затем прекращалось. Количество включенной аминокислоты составляло от 0,5 до 10 μмолей на 1 г белка. По-видимому, включались лишь L-аминокислоты; в тех случаях, когда исследования проводили с D-изомерами, последние оказывались неактивными. За исключением, быть может, этионина [625, 626] и n-фторфенилаланина [627], включались лишь аминокислоты, свойственные белкам (стр. 139). Различия в скорости поглощения аминокислот могут зависеть как от самой ткани, так и от метода ее обработки. Заслуживает внимания, что фактически все исследованные ткани в той или иной мере проявляли способность включать аминокислоты. В нескольких случаях отмечено, что ингибиторы фосфорилирования и дыхания тормозят включение. Диализ бесклеточных препаратов также вызывает инактивирование [615, 628]; реактивирование таких систем достигается добавлением аминокислот и адениннуклеотидов [628—630]. Недавно было отмечено, что в асцитной опухоли Эрлиха включение аминокислот подавляется в анаэробных условиях [631]. Однако такого подавления при анаэробиозе не наблюдали, если в системе поддерживался активный гликолиз. Торможение включения динитрофенолом объясняется, очевидно, его влиянием на процессы, доставляющие энергию [632]. Опыты с бесклеточным препаратом из печени крыс, содержащим большое количество микросом, показали, что для включения аминокислот необходимо наличие микросом, системы, образующей АТФ, и растворимого фактора из печени (термостабильного и недиализуемого) [618]. Дальнейшее исследование этой системы позволило установить, что для включения меченых аминокислот необходим гуанозинди- или гуанозинтрифосфат. Гуанозинтрифосфат не заменяет аденозинтрифосфата; пробы должны содержать АТФ и систему, образующую его [713]. Присутствие других аминокислот повышает включение не во всех системах. В некоторых опытах отмечали возможность одновременного включения нескольких аминокислот, причем величины их включения были аддитивны [623, 632].
Стимулирующее действие аденозинтрифосфата на включение аминокислот согласуется с данными об участии АТФ в процессе активирования аминокислот. Было найдено, что растворимая фракция, полученная из печени крысы, катализирует включение меченого пирофосфата в аденозинтрифосфат, зависящее в значительной мере от присутствия L-аминокислот [633, 634]. Та же белковая фракция катализирует образование гидроксаматов аминокислот в присутствии аденозинтрифосфата, смеси L-аминокислот и гидроксиламина в высокой концентрации. Аналогичная ферментная система обнаружена у некоторых бактерий [635].
Из результатов этих исследований сделан вывод о наличии процесса активирования аминокислот, при котором образуются соединения аминоацилов с адениловой кислотой, связанные с ферментом. Эти данные показали также, что для каждой из изученных аминокислот имеется отдельный фермент или участок фермента. Согласно этой гипотезе, соединения аминокислот с адениловой кислотой могут включаться в белки или превращаться в присутствии гидроксиламина в соответствующие гидроксамовые кислоты (см. также [715, 716]).
В тех случаях, когда животным вводили меченые аминокислоты и получали затем различные фракции из клеток печени путем дифференциального центрифугирования, наиболее активное включение аминокислот обнаруживали в микросомах [636]. К такому же результату привели опыты in vitro [637, 638]. Было отмечено, что из тканевых фракций наибольшее количество рибонуклеиновой кислоты содержат микросомы; этот факт имеет существенное значение в свете возможного участия нуклеиновой кислоты в синтезе белка. Кроме микросом, для включения аминокислот необходима еще растворимая белковая фракция [618, 637]. В недавних работах было найдено, что в мышце включение аминокислот происходит интенсивнее в митохондриях, чем в микросомах [639, 717].
Опубликованы также данные о наличии в некоторых клетках соединений, активирующих включение аминокислот. Например, включение аминокислот в белки ретикулоцитов кролика in vitro повышается при добавлении кипяченого водного экстракта из высушенной печени или фильтрата кипяченой плазмы крови. Активирующими соединениями являются, по-видимому, фруктозоаминокислоты, имеющие следующую структуру:
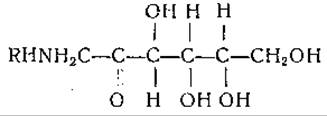
Фруктозоаминокислоты, например фруктозо-L-аланин и фруктозо-L-глутаминовая кислота, были выделены Борсуком и сотрудниками [640] из ткани печени. Отмеченное авторами активирование включения аминокислот в ретикулоциты, по-видимому, обусловливалось в основном соединениями этого типа в сочетании с железом; но не исключено существование и других активирующих факторов.
Роль нуклеиновых кислот в синтезе белка изучали многие исследователи, но, несмотря на большое количество экспериментов, она остается еще не выясненной. В ряде работ подчеркивалось, что синтез рибонуклеиновой кислоты и белка, как и включение аминокислот, связан с фракцией микросом [582, 637]. Исследование процессов включения в ядерных и безъядерных фрагментах ацетабулярии показало, что лишенные ядра фрагмента способны включать аминокислоты [641]. В общем данные, доказывающие участие дезоксирибонуклеиновой кислоты в синтезе белка, немногочисленны. Роль рибонуклеиновой кислоты не установлена, хотя высказан ряд предположений о том, что рибонуклеиновая кислота может участвовать каким-то образом в образовании «матрицы» для синтеза белка. Согласно этой гипотезе, нуклеиновая кислота необходима для синтеза белка. Взаимосвязь между белком и нуклеиновой кислотой проявляется также и в том, что некоторые белки необходимы для синтеза нуклеиновой кислоты [642].
Гейл [643], обстоятельно изучавший процессы включения аминокислот и синтез белка у бактерий, сообщил, что включение аминокислот в фрагменты разрушенных клеток стафилококка ускоряется рибонуклеиновой кислотой. Далее он установил, что некоторые продукты ферментативного расщепления рибонуклеиновой кислоты также стимулируют включение аминокислот. По-видимому, в таких продуктах гидролиза содержится ряд активирующих веществ, химическая природа которых еще не установлена1.
Относительно механизма биосинтеза белка сложились две основные гипотезы. Ввиду сложности структуры белков и необходимости для их биосинтеза одновременного наличия всех аминокислот, входящих в состав белка, возникло представление о существовании особых «матриц», на которых все участвующие в синтезе белка аминокислоты размещаются в порядке, соответствующем их последовательности в молекуле белка. Эта идея связана и с данными о том, что биосинтез белка осуществляется по принципу «все или ничего». Согласно другой точке зрения, синтез белка протекает в результате ступенчатого процесса, с промежуточным образованием пептидов или других производных аминокислот. Предложены различные варианты как «матричной», так и «пептидной» теории синтеза белка. Мы не имеем возможности подробно обсудить все теоретические и экспериментальные исследования в этой области, однако некоторые интересные подходы к данной проблеме заслуживают упоминания.
Теория «матрицы» подкрепляется множеством исследований, показавших, что для синтеза белка обязательно одновременное наличие всех необходимых аминокислот. Исследования по кормлению животных были уже рассмотрены выше (стр. 126). Шпигельман и сотрудники [644, 645], обстоятельно изучавшие адаптивное образование ферментов у бактерий, пришли к выводу, что а) «образование фермента неразрывно связано с использованием свободных аминокислот» и б) «первый устойчивый промежуточный продукт на пути образования фермента настолько сложен, что для его образования необходимо одновременное использование всех аминокислот». Изучение образования ß-галактозидазы у Escherichia coli и синтеза амилазы в срезах поджелудочной железы [646] вновь подтвердило, что для синтеза требуется присутствие всего набора аминокислот. При синтезе ферритина положение аналогично: экспериментальные данные говорят о том, что синтез ферритина происходит за счет свободных аминокислот [647].
1 В свете новейших исследований стало очевидным, что в опытах Гейла с фрагментами бактериальных клеток, как и во многих других изотопных опытах с микроорганизмами, меченые аминокислоты использовались для ферментативного синтеза мукопептидов клеточной стенки бактерий, т. е. «включение» их не имело отношения к процессам синтеза или обновления белка; активный «фактор включения», содержащийся в гидролизатах нуклеиновых кислот, был отождествлен с глицерином. — Прим. ред.
Хотя представление о матрицах совместимо с некоторыми фактическими данными, эту теорию, вероятно, нелегко будет доказать. По словам одного из авторов, поддерживающих ее, «одно из основных преимуществ матричной гипотезы состоит в том, что ее можно применять к любой из стадий процесса синтеза, с тем чтобы заполнить или обойти пробелы в наших знаниях, — до тех пор, пока новые данные не позволят ее отбросить (или подтвердить)» ([582]; см. также [648—650]).
В самом деле, весьма соблазнительно признать гипотезу, позволяющую относительно просто объяснить синтез чрезвычайно сложных молекул. Между тем имеются также данные, свидетельствующие в пользу ступенчатого характера процесса синтеза белка. Образование промежуточных пептидов не установлено, однако возможно, что их существование весьма мимолетно. В связи с этим нелишне отметить, что, например, синтез жирных кислот представляет собой ступенчатый процесс, хотя в течение многих лет промежуточные продукты этого синтеза обнаружить не удавалось. Отсутствие в тканях свободных жирных кислот с углеродной цепью промежуточной длины могло бы послужить доводом в пользу «матричного» механизма синтеза жирных кислот. Такая идея действительно одно время выдвигалась [651]. Следует отметить, что наши сведения о природных пептидах весьма неполны; кроме того, подлежит изучению распространение других типов аминокислотных соединений (например, нуклеотидов, содержащих аминокислоты).
Данные ряда исследований о стимулирующем влиянии пептидов на рост говорят о том, что использованию пептидов предшествует их гидролиз, однако возможно, что это верно не для всех случаев [128, 652—657]. В этом отношении значительный интерес представляют исследования пептидов типа стрепогенина [658—663] (см. также стр. 75). Отметим, что образование одного из природных пептидов — глутатиона — происходит путем ступенчатого синтеза (стр. 268).
В ряде лабораторий пытались получить экспериментальные данные, позволяющие отличить «ступенчатый» механизм синтеза от «матричного». Сюда относятся исследования Анфинсена и сотрудников [597, 598, 664], посвященные образованию яичного белка в яйцеводе курицы. Синтезированный в организме из С1402 яичный альбумин расщепляли при помощи субтилизина на пластинчатый альбумин (плакальбумин) и пептиды. Было найдено, что метка аспарагиновой кислоты в пептидах выше метки аспарагиновой кислоты плакальбумина. В аналогичных опытах с мечеными аминокислотами было отмечено неравномерное распределение метки в остатках глутаминовой кислоты, глицина, аланина и серина. Хотя эти данные можно истолковать в пользу ступенчатого механизма синтеза белка, предложены и другие объяснения [582]. Кроме того, в аналогичных опытах с другими биологическими системами были получены противоположные результаты. Так, например, после инъекции крысам меченого валина степень включения метки в концевые и неконцевые остатки валина в молекуле гемоглобина оказалась одинаковой [665]. В исследованиях Уорка и сотрудников, вводивших меченые аминокислоты в организм лактирующей козы, удельная активность аминокислотных остатков, выделенных из различных участков пептидной цепи казеина, была в общем эквивалентной [666]. Стайнберг указал на то, что в опытах с биосинтезом овальбумина неравномерная метка аминокислот наблюдается лишь при сравнительно кратковременных опытах; если инкубирование продолжается в течение 10 час. или более, то аминокислоты метятся равномерно [667].
Изящный опыт, посвященный этому вопросу, поставили Симпсон и Велик [608]. Они выделили альдолазу и дегидрогеназу глицеральдегид-3-фосфата из мышц кролика после однократной инъекции пяти радиоактивных аминокислот. Удельная активность каждой из аминокислот в альдолазе была в 1,8 раз выше, чем в триозофосфатдегидрогеназе. Это свидетельствует о том, что оба фермента синтезируются за счет одного и того же «котла» аминокислот. Такие же результаты получены при исследовании синтеза альдолазы и фосфорилазы у животных, которых забивали через различные промежутки времени (от 2 до 24 час.) после инъекции меченых аминокислот [668]. Совокупность опубликованных данных едва ли позволяет однозначно решить вопрос о наличии ступенчатого или матричного механизма синтеза белка. Даже данные тех исследований, в которых была обнаружена неравномерная метка аминокислот, объясняются с позиции матричной теории тем, что некоторые части матрицы могли оказаться более доступными для «экзогенных», чем для «эндогенных», аминокислот. Вместе с тем результаты опытов, согласно которым аминокислоты метятся равномерно, можно объяснить тем, что белки выделяли из биологической системы спустя слишком долгий промежуток времени после внесения в нее меченых аминокислот.
В заключение следует сказать, что многие основные вопросы, касающиеся включения аминокислот в белок, остаются пока без ответа. Природа этого процесса еще не ясна. Существует ли у животных внутриклеточный оборот белка? Каковы промежуточные продукты синтеза белка? Проведенные до сих пор исследования выявляют сложность всей этой проблемы и указывают на необходимость новых подходов к ее решению. Замечательно уже то, что в этой трудной области достигнуты некоторые успехи вопреки тому, что сама проблема структуры белка еще далеко не разрешена.