Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Флуоресценция и фосфоресценция
Молекула, находящаяся в электронно-возбужденном состоянии, может потерять свою энергию, вернувшись в основное состояние, несколькими способами. Один из них состоит в испускании молекулой кванта света (флуоресценция) [51—55]. Интенсивность и спектральные свойства флуоресцентного излучения определяют, осветив образец, который помещен в кювету с четырьмя прозрачными стенками, и установив фотоумножитель под прямым углом к возбуждающему световому пучку. Если в абсорбционной спектрофотометрии измеряют отношение интенсивностей падающего и прошедшего через образец световых пучков, то в флуоресцентной спектроскопии — абсолютную интенсивность испускаемого света. Несмотря на то что эта интенсивность мала, чувствительность метода значительно выше, чем при измерении поглощения света. Таким образом, флуоресцентная спектроскопия относится к числу Важных аналитических методов (см., например, гл. 2, разд. 3,5). Она оказывается также весьма ценным и чувствительным инструментом при изучении химических свойств электронно-возбужденных состояний. На рис. 13-15 приведены спектры возбуждения флуоресценции1) (почти совпадающие со спектрами поглощения) для двух соединений — флавина [56] и триптофана; здесь же приведены соответствующие спектры испускания. Последние нормированы так, чтобы высота максимума совпадала с таковой для спектров поглощения. Обратите внимание, что спектр флуоресценции сдвинут в сторону низких энергий относительно спектра поглощения и что эти спектры перекрываются лишь в незначительной степени. Далее, спектр испускания по форме близок к зеркальному отображению спектра поглощения. Чтобы понять, с чем это связано, обратимся к схеме, изображенной на рис. 13-16. Напомним, что при поглощении кванта света молекула обычно переходит на более высокие колебательные подуровни возбужденного электронного состояния, чем те, которые она занимала в основном состоянии. Однако, прежде чем произойдет испускание заметного количества света, избыток колебательной энергии диссипативно рассеется и возбужденная молекула окажется на низшем колебательном подуровне возбужденного электронного состояния. Именно отсюда молекула будет переходить в основное состояние, испуская основную часть света. Помимо этого, надо учесть, что до поглощения молекула обычно находится в низшем колебательном состоянии основного электронного состояния, тогда как ври флуоресценции происходит заселение многих возбужденных колебательных подуровней основного электронного состояния (рис. 13-16). Таким образом, как это следует из рисунка, спектр флуоресценции состоит из серии колебательных подполос с более низкими энергиями, чем полосы в спектре поглощения. Общей у этих двух спектров является лишь 0—0-полоса. На самом же деле, как можно видеть из рис. 13-15, даже 0—0-полосы в большинстве случаев не совсем совпадают: в спектре флуоресценции эта полоса немного сдвинута в сторону более низких энергий. Сдвиг обусловлен тем, что в процессе поглощения фотона или непосредственно вслед за этим событием происходит некоторая перестройка молекул растворителя вокруг поглощающей молекулы, принимающих энергетически более устойчивое положение. Аналогично диссипации избытка колебательной энергии в возбужденном состоянии релаксация молекул растворителя вокруг возбужденного хромофора приводит к более стабильному энергетическому состоянию. Подобный процесс релаксации происходит и в основном состоянии немедленно вслед за испусканием фотона, что дает свой вклад в смещение 0—0-полосы в спектре флуоресценции ([52], стр. 13).
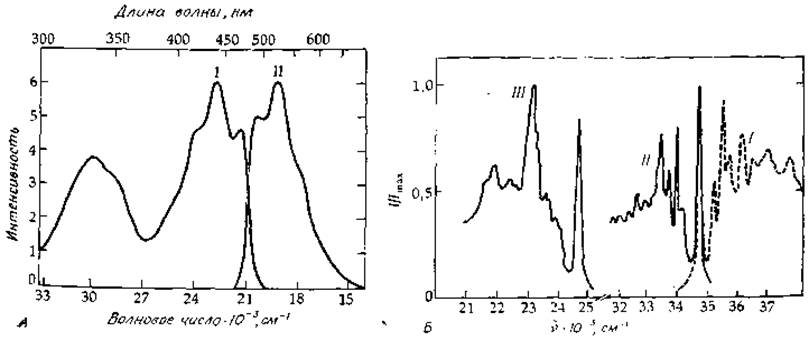
РИС. 13-15. А. Спектры испускания и возбуждения рибофлавинтетрабутирата в н-гептане (см. текст) [56]. Концентрация рибофлавинтетрабутирата ∼0,4 мг∙л-1. I — спектр возбуждения; испускание наблюдается при 525 нм. II — спектр испускания; длина волны возбуждающего света 345 нм. Б. Спектры индола в циклогексане при Т = 196°С 154]. I — спектр возбуждения; II — спектр флуоресценции; III — спектр фосфоресценции.
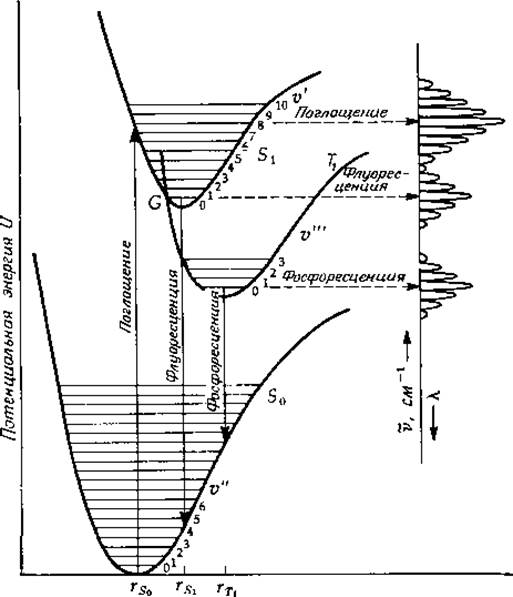
РИС. 13-16. Диаграммы потенциальной энергии органической молекулы в растворе в основном (S0), первом возбужденном синглетном (S1) и триплетном (T1) состояниях ([5]; стр. 274). G — точка пересечения кривых S1 и Т1. Для наглядности расстояния r выбраны так, что rs0 < rs1 < rT1, это приводит к растяжению спектров. В действительности для сложных и практически симметричных молекул rS0 ≃ rs1 < rT1, так что 0—0-полосы поглощения и флуоресценции почти совпадают и только полоса фосфоресценции сильно смещена в сторону больших длин волн.
1) Спектр возбуждения является одним из примеров спектров действия, представляющих собой зависимость какого-либо параметра системы от длины волны поглощаемого света. При очень низких концентрациях чистых соединений спектры действия практически совпадают со спектрами поглощения. Однако, поскольку значение параметра (в данном случае интенсивность флуоресценции) пропорционально количеству поглощенного света, спектры действия нужно сравнивать с графиками зависимости 1—Т от длины волны (Т — пропускание; см. разд. Б,1), а не с графиками зависимости ε от λ. При низких концентрациях указанные величины пропорциональны. Данный вопрос хорошо изложен в книге Клэйтона [51].
Рис. 13-16 иллюстрирует еще одну особенность возбужденных молекул, сказывающуюся на их реакционной способности. Они могут переходить из возбужденного синглетного состояния в более низкоэнергетическое триплетное состояние, характеризующееся наличием двух неспаренных электронов, благодаря чему молекула приобретает свойства, присущие бирадикалу. Триплетное состояние является очень долгоживущим и во многом определяет фотохимические свойства молекул. Переход из этого состояния в основное сопровождается фосфоресценцией — происходящим с некоторой задержкой испусканием света, что иллюстрируется тем же рисунком.
Пoчему одни молекулы флуоресцируют, а другие нет? Способность к флуоресценции в значительной мере определяется радиационным временем жизни тr, которое, согласно уравнению (13-13), связано с константой скорости процесса первого порядка, каким является экспоненциальное уменьшение числа возбужденных молекул за счет флуоресценции:
![]()
Радиационное время жизни зависит от длины волны и от силы осциллятора для соответствующего перехода. Для молекул, поглощающих в ближней УФ-области, часто используют следующее приближение:
![]()
Так, при ε =10 000 радиационное время жизни (время, за которое интенсивность флуоресценции уменьшается в ε раз от исходного значения) равно ~ 10-8 с (10 нс). Чем больше поглощение, тем меньше Радиационное время жизни, и наоборот. Помимо флуоресценции существуют и другие пути снятия возбуждения; поэтому чем меньше радиационное время жизни, тем с большей вероятностью будет наблюдаться флуоресценция.
К числу процессов, конкурирующих с флуоресценцией, относятся внутренняя конверсия, интеркомбинационная конверсия (в результате последней молекула переходит в триплетное состояние), а также фотохимические реакции, в которые может вступать молекула, находясь в синглетном возбужденном состоянии. Внутренняя конверсия представляет собой процесс, в ходе которого молекула переходит с низшего колебательного подуровня одного из более высоких электронно-возбужденных состояний на один из высоких колебательных подуровней основного состояния. Этот процесс служит главным каналом, по которому снимается электронное возбуждение, и прямо конкурирует с флуоресценцией. Поэтому время жизни молекулы в возбужденном состоянии1) (т) обычно меньше тr. Эффективность флуоресценции по определению равна
![]()
Для сильно флуоресцирующих молекул, таких, как рибофлавин, φf иногда превышает 0,25 [58].
Число безызлучательных переходов можно увеличить путем добавления тушителей. Механизм тушения флуоресценции бывает разным; чаще всего оно обусловлено столкновением возбужденного хромофора с молекулой тушителя. Известны вещества, являющиеся особенно эффективными тушителями (например, иодид-ионы). Эффективность флуоресценции в отсутствие тушителя можно выразить через константы скорости флуоресценции (kf), безызлучательного перехода (kd) и фосфоресценции (kp):
![]()
В присутствии тушителя Q скорость перехода молекулы из возбужденного состояния в основное увеличивается. Отношение эффективностей флуоресценции в отсутствие тушителя (φ0f) и в его присутствии дается уравнением Штерна — Вольмера
![]()
Константа К известна под названием константы тушения Штерна— Вольмера.
Примером применения тушения флуоресценции для исследования белков могут служить эксперименты по определению доступности боковых цепей триптофана для растворителя, в которых в качестве тушителя используется акриламид [59, 60].
1) Непосредственно измеренное время жизни возбужденного состояния для рибофлавин-5'-фосфата (εmах = 12 200 при 450 им) при 25 °С равно ~ 5 нс [57].