БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 14. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
14.5. Сопряжение окисления и фосфорилирования осуществляется протонным градиентом
Рассмотрим теперь поток электронов от NАDН к O2, представляющий собою экзергонический процесс:
NADH + 1/2O2 + Н+⇄ Н2O + NАD+
∆G0' = — 52,6 ккал/моль.
Эта свободная энергия окисления используется для синтеза АТР:
ADP + Рi + Н+⇄ АТР + Н2O
∆G0' = + 7,3 ккал/моль.
Рис. 14.7. Электронная микрофотография двухмерной кристаллической структуры цитохром-с-оксидазы

Синтез ATP осуществляется молекулярными ансамблями во внутренней митохондриальной мембране. Соответствующий ферментный комплекс (разд. 14.8) назван митохондриальной AТРазой, потому что он был открыт благодаря способности катализировать гидролитические реакции.
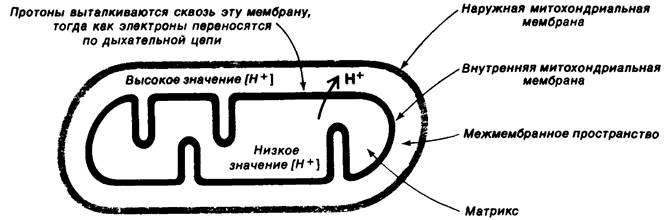
Рис. 14.8. При переносе электронов по дыхательной цепи происходит генерирование протонного градиента и мембранного потенциала на внутренней митохондриальной мембране
Каким образом осуществляется сопряжение между окислением NADH и фосфорилированием ADP? Вначале предполагалось, что при переносе электронов происходит образование ковалентного высокоэнергетического промежуточного продукта, являющегося предшественником АТР. Эта гипотеза химического сопряжения основывалась на механизме субстратного фосфорилирования, примером которого служила глицеральдегид-3-фосфат - дегидрогеназная реакция, приводящая к образованию 1,3-БФГ - высокоэнергетического промежуточного продукта (разд. 12.14). Высказывалось и другое предположение, а именно что свободная энергия окисления улавливается белком, находящимся в активированной конформации, что затем стимулирует синтез АТР. Исследователи во многих лабораториях в течение десятилетий пробовали выделить эти предполагаемые высокоэнергетические промежуточные продукты, но все предпринятые попытки оказались безуспешными.
Совершенно иной механизм, хемиосмотическую гипотезу, постулировал Питер Митчелл (Peter Mitchell) в 1961 г. Он предположил, что сопряжение переноса электронов и синтеза АТР обеспечивается протонным градиентом, а не высокоэнергетическим ковалентным промежуточным продуктом или активированным белком. Согласно этой модели, перенос электронов по дыхательной цепи приводит к выбросу протонов из матрикса на цитоплазматическую сторону внутренней митохондриальной мембраны, где таким образом возрастает концентрация ионов Н+. В результате происходит генерирование мембранного потенциала с положительным зарядом на цитоплазматической стороне мембраны (рис. 14.8). Эта протонодвижущая сила, постулирует автор, запускает синтез АТР АТРазным комплексом. В описанной модели взаимодействие между цепью переноса электронов и АТР- синтезирующим комплексом осуществляется лишь благодаря наличию мембранного потенциала. Модель требует, чтобы переносчики электронов в дыхательной цепи и АТРаза имели векторную организацию, т. е. чтобы они были определеннным образом ориентированы по отношению к двум поверхностям внутренней митохондриальной мембраны. Далее, внутренняя митохондриальная мембрана должна быть совершенно непроницаема для протонов, поскольку для существования протонного градиента необходимо наличие замкнутого компартмента. Основной смысл предложенного механизма состоит в том, что первичным запасающим энергию актом является перенос протонов через внутреннюю митохондриальную мембрану.
Гипотеза Митчелла о сопряжении окисления и фосфорилирования протонным градиентом получила к настоящему времени множество подтверждений.
1. Протонный градиент через внутреннюю митохондриальную мембрану создается во время переноса электронов. pH с наружной стороны на 1,4 единицы ниже, чем с внутренней, и мембранный потенциал составляет 0,14 В, причем наружная сторона несет положительный заряд. Общий электрохимический потенциал ∆р (в вольтах) складывается из мембранного «потенциала (∆![]() ) и градиента концентрации ионов Н+ (∆рН). В приведенном ниже уравнении R-газовая постоянная, Т-абсолютная температура, F- число Фарадея.
) и градиента концентрации ионов Н+ (∆рН). В приведенном ниже уравнении R-газовая постоянная, Т-абсолютная температура, F- число Фарадея.
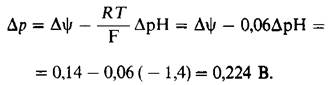
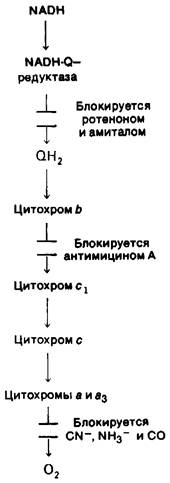
Рис. 14.9. Пункты действия некоторых ингибиторов транспорта электронов
Эта общая протонодвижущая сила в 0,224 В соответствует свободной энергии 5,2 ккал в расчете на 1 моль протонов.
2. При создании градиента pH в митохондриях или хлоропластах (разд. 19.13) в них происходит синтез АТР в отсутствие переноса электронов.
3. Белок пурпурных мембран галобактерий при освещении перекачивает протоны (разд. 19.21). Синтетические пузырьки, содержащие этот бактериальный белок и очищенную АТРазу из митохондрий сердца крупного рогатого скота, синтезируют АТР при освещении. В этом опыте белок пурпурных мембран заменяет дыхательную цепь; следовательно, дыхательная цепь и АТРаза-биохимически отдельные системы, связываемые только протонным градиентом.
4. И дыхательная цепь (разд. 14.7), и АТРаза (разд. 14.8) имеют векторную организацию во внутренней митохондриальной мембране.
5. Для окислительного фосфорилирования существенное значение имеет замкнутость компартментов. В растворимых препаратах или в мембранных фрагментах, лишенных хорошо отграниченных внутренних и внешних компартментов, не происходит синтеза АТР, сопряженного с переносом электронов.
6. Вещества, переносящие протоны через внутреннюю митохондриальную мембрану, разрушают протонный градиент и таким образом вызывают разобщение окисления и фосфорилирования (разд. 14.14).
14.6. Протонный градиент генерируется в трех пунктах
Выброс протонов происходит в трех пунктах потока электронов по дыхательной цепи от NADH к О2 (рис. 14.9): 1-й пункт -это NADH-Q-редуктазный комплекс; 2-й пункт - QН2-цитохром-с - редуктазный комплекс; 3-й пункт-цитохром-с-оксидазный комплекс. Протонный градиент, генерируемый в каждом из пунктов при переносе пары электронов от NADH, используется для синтеза одной молекулы АТР. Для идентификации этих пунктов применялись различные экспериментальные подходы.
1. Сравнение выхода АТР при окислении нескольких субстратов. Окисление NADH дает три АТР, тогда как окисление сукцината дает два АТР. Электроны от FADH2 поступают в цепь переноса электронов на уровне кофермента Q, который находится на более низком энергетическом уровне, чем 1- й пункт фосфорилирования. При окислении нефизиологического субстрата аскорбата образуется только одна молекула АТР, потому что электроны аскорбата поступают на цитохром с, находящийся на более низком энергетическом уровне, чем 2-й пункт фосфорилирования. Окислительное фосфорилирование часто характеризуют отношением Р: О-число молей неорганического фосфата, включающегося в органическую форму, в расчете на один атом потребляемого кислорода. Отношения Р : О для окисления NADH, сукцината и аскорбата составляют соответственно 3, 2 и 1.
2. Термодинамические измерения. Значение ∆G0’ для переноса электронов от NADH на находящийся на более низком энергетическом уровне Fe-S-центр в NADH-Q-редуктазе составляет — 12 ккал/моль; для переноса электронов от цитохрома δ к с1 в QH2-цитохром-c -редуктазе 10 ккал/моль и от цитохрома а к О2 в цитохром-с-оксидазе-24 ккал/моль. Эти окислительно-восстановительные реакции являются в достаточной степени экзергоническими для запуска синтеза АТР при стандартных условиях (∆G0' = — 7,3 ккал/моль). Значения ∆G0' для других реакций переноса электронов, опосредуемых кофермснтом Q и цитохромом с, слишком малы для поддержания синтеза АТР.
3. Специфическое ингибирование тока электронов. Ротенон и амитал специфически ингибируют перенос электронов в NADH-Q-редуктазном комплексе и таким образом предотвращают генерирование протонного градиента в 1-м пункте (см, рис, 14.9). В то же время указанные ингибиторы не нарушают окисления сукцината, поскольку электроны этого субстрата поступают в цепь переноса электронов после блока кофермента Q. Антимицин А тормозит ток электронов между цитохромами b и с1, предотвращая синтез АТР, сопряженный с генерированием протонного градиента во 2-м пункте. Этот блок можно обойти добавлением аскорбата, который непосредственно восстанавливает цитохром с. Электроны затем пойдут от цитохрома с к О2 с одновременным синтезом АТР, сопряженным с протонным градиентом в 3-м пункте. Наконец, ток электронов может быть блокирован между цитохромоксидазным комплексом и О2 под действием CN-, N-3 и СО. Цианид и азид реагируют с ферриформой этого переносчика, тогда как оксид углерода ингибирует ферроформу. В присутствии этих ингибиторов из-за блокирования тока электронов не происходит фосфорилирования, сопряженного с генерированием протонного градиента в 3-м пункте.
Места действия этих ингибиторов были установлены с использованием метода перекреста. Бриттон Чанс (Britton Chance) предложил изящный спектроскопический метод для определения соотношения окисленной и восстановленной форм каждого переносчика. В основе метода лежит тот факт, что окисленная и восстановленная формы каждого переносчика имеют свои характерные спектры поглощения. Добавление ингибитора переноса электронов изменяет соотношение этих форм. Например, добавление антимицина А вызывает переход переносчиков, локализованных в электронтранспортной цепи между NADH и цитохромом Ь, в более восстановленное состояние, а переносчиков между цитохромом с и О2 - в более окисленное состояние. Отсюда можно заключить, что антимицин А подавляет превращение цитохрома b в цитохром c1, потому что этот этап является пунктом перекреста.
4. Синтез системы пузырьков, содержащих лишь один пункт выброса протонов. Каждый из трех участков выброса протонов был воспроизведен в синтетических фосфолипидных пузырьках, содержащих АТРазу. Добавление к таким пузырькам окисляемого субстрата приводит к генерированию протонодвижущей силы, достаточной для синтеза одной молекулы АТР на пару электронов.