Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Ингибирование ферментов
Ингибирование, т.е. полное или частичное подавление активности ферментов при сохранении их первичной и пространственной структуры, — один из важнейших путей регуляции биохимических процессов и в то же время продуктивный способ изучения биокатализа. Различают обратимые и необратимые ингибиторы.
К необратимым относят такие ингибиторы, которые инактивируют фермент, образуя с ним связь, достаточно устойчивую и практически не диссоциирующую в условиях, типичных для его действия. Обычно это ковалентная связь с одной из функциональных групп каталитического центра.
Заметим, что нередко удается подобрать такие условия, при которых инактивирующая группировка отщепляется и фермент реактивируется, однако поскольку эти условия принципиально отличны от тех, при которых происходило ингибирование, последнее все же считается необратимым.
Для примера рассмотрим ингибирование протеолитического фермента папаина, имеющего в каталитическом центре тиоловую группу цистеина, соединениями ртути. Реакция иона двухвалентной ртути с этой тиоловой группой приводит к образованию труднодиссоциирующего меркаптида:
![]()
Фермент утрачивает в результате этой реакции активность, и ингибирование в данных условиях необратимо. Однако в присутствии избытка других тиоловых соединений, например меркаптоэтанола, происходит перераспределение ионов ртути между ними и цистеином в активном центре папаина, вследствие чего последний высвобождается и папаин полностью восстанавливает свою активность:
![]()
Такую последовательность превращений используют на практике как способ хранения папаина, предотвращающий его саморасщепление, автолиз. Тем не менее ингибирование папаина ионами ртути рассматривают как необратимое.
С возможностью действия необратимых ингибиторов следует считаться, в частности, при выделении ферментов. Так, ионы ртути свинца, меди и ряда других тяжелых металлов, блокируя сульфгидрильные группы некоторых ферментов, могут их инактивировать, что требует тщательного их удаления из растворов, а иногда применения комплексонов.
Среди необратимых ингибиторов выделяются специфические реагенты на функциональные группы каталитического центра ферментов. Избирательность их действия повышается, если они содержат структуры, способствующие их связыванию в активном цент ре или, что еще эффективнее, воспроизводят строение переходного фермент-субстратного комплекса. Например, при действии диизопропилфторфосфата на трипсин или другие сериновые протеиназы ингибитор ацилирует активную гидроксильную группу серина в активном центре фермента, однако образующееся соединение, будучи структурным аналогом переходного состояния, устойчиво к дальнейшему гидролизу, поэтому фермент не может регенерироваться и оказывается необратимо ингибированным. Диизопропилфторфосфат необратимо ингибирует также холинэстеразы, что делает его сильным ядом.
Необратимое ингибирование встречается и в природе. Именно так пенициллины инактивируют D,D-карбоксипептидазу — фермент, вовлеченный в биосинтез муреина — полимера, который входит в структуру стенок бактериальных клеток. Пенициллины, в известной мере имитирующие строение субстрата этого фермента, связываются с ним и ацилируют с раскрытием ß-лактамного цикла гидроксильную группу серина в активном центре фермента, что вызывает его необратимое ингибирование.
Взаимодействие обратимых ингибиторов с ферментом по схеме
![]()
описывается константой ингибирования Кi, которая представляет собой константу диссоциации комплекса фермент-ингибитор ЕI:
![]()
Очевидно, что Ki численно равна концентрации ингибитора, при которой половина молекул фермента оказывается связанной в комплекс фермент-ингибитор.
Обратимые ингибиторы в свою очередь подразделяют на конкурентные и неконкурентные. К конкурентным относятся ингибиторы, взаимодействующие с той же зоной поверхности фермента, которая связывает субстрат, а следовательно, способные конкурировать с ним за фермент. Впрочем, участки связывания субстрата и конкурентного ингибитора вовсе не обязательно совпадают — для конкурентных отношений достаточно их частичного перекрывания. Ввиду этого ингибитор химически может быть и не похож на субстрат, поскольку зоны связывания нередко поливалентны. Так, индол и ß-нафтол конкурентно ингибируют протеиназу а-химотрипсин, хотя в них трудно усмотреть какую-либо аналогию с пептидами. Речь, видимо, идет об использовании в обоих случаях одного и того же гидрофобного участка химотрипсина.
Уравнение скорости ферментативной реакции в присутствии конкурентного ингибитора несколько сложнее уравнения Михаэлиса—Ментен:
![]()
Введение «кажущейся» константы Михаэлиса К'm = Кm(1 + [I]/ [Ki]) приводит уравнение к канонической форме уравнения Михаэлиса-Ментен. Таким образом, присутствие в системе конкурентного ингибитора эквивалентно увеличению константы Михаэлиса, причем степень этого увеличения определяется величиной отношения концентрации ингибитора к константе ингибирования, т.е. к параметру, характеризующему прочность взаимодействия данного ингибитора с ферментом.
Понятно, что максимальная скорость и соответствующая константа kкат характеризуют скорость превращения в продукт уже образовавшегося фермент-субстратного комплекса, поэтому на них присутствие конкурентного ингибитора повлиять не может. Изменение же кажущейся константы Михаэлиса учитывает снижение эффективной концентрации фермента, поскольку комплекс фермент—конкурентный ингибитор с субстратом не взаимодействует:
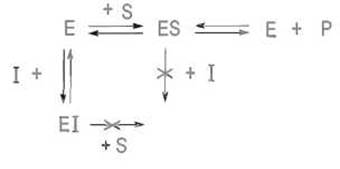
Конкурентное ингибирование распространено в природе; его используют в практических целях для регулирования активности ферментов. По этому механизму действуют, например, природные ингибиторы протеиназ и амилаз, комплементарность которых соответствующим активным центрам так велика и связывание столь сильно, что их действие нередко выглядит как практически необратимое ингибирование из-за очень малых величин констант диссоциации комплексов фермент-ингибитор. Многие лекарственные препараты, нацеленные на подавление нежелательной активности фермента, конструируются как конкурентные ингибиторы, причем подбираются такие их структуры, которые максимально соответствуют строению зоны связывания фермента, чтобы понизить Кi. Так, аналоги субстратов ренина — протеиназы, вовлеченной в регуляцию давления крови, — которые вместо расщепляемой ферментом пептидной связи — СО—NH— содержат устойчивую к гидролизу структуру, например —СО—СН2—, имеют Кi порядка 1 ∙ 10-9 М и могут иметь терапевтическое значение.
Неконкурентное ингибирование принципиально отличается от конкурентного: в этом случае ингибитор не затрагивает зону связывания субстрата, а присоединяется к ферменту по иному пути, вызывая инактивацию каталитического центра. Поскольку ингибитор и субстрат связываются в таком случае различными участками фермента, ингибитор может присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу, в обоих случаях инактивируя фермент. Именно независимость зон связывания делает невозможной конкуренцию между субстратом и ферментом; следовательно, неконкурентное ингибирование не может быть снято избытком субстрата.
Итак, для неконкурентного ингибирования справедлива следующая схема:
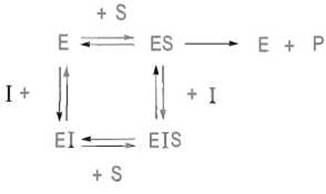
Уравнение скорости ферментной реакции в присутствии неконкурентного ингибитора выглядит следующим образом:
![]()
Как уже говорилось, характер связывания субстрата ферментом в присутствии неконкурентного ингибитора не изменяется, отсюда и сохранение Кm. Напротив, величина Vmах корректируется множителем Кi/([I] + Ki), величина которого тем меньше, чем больше концентрация ингибитора по сравнению с константой ингибирования. Здесь снова концентрация действующего вещества, в данном случае ингибитора, сравнивается с характерной для него константой ингибирования. Уменьшение эффективной максимальной скорости соответствует снижению активности каталитического центра при связывании неконкурентного ингибитора.
Неконкурентное ингибирование может быть следствием нескольких способов взаимодействия фермента и ингибитора. Возможно, ингибитор, связывающийся с функциональными группами каталитического центра, настолько мал, что не мешает связыванию субстрата. Так, например, могут вести себя ионы водорода, протонирующие функциональные группы, которые участвуют в катализе.
Ингибитор может связываться на участке, примыкающем к каталитическому центру, и перекрывать последний, практически не затрагивая зоны связывания субстрата. Такие ситуации особенно вероятны для ферментов с несколькими субстратами, которые связываются каждый на своем участке. Наконец, возможно, в особенности для ферментов сложной структуры, что присоединение ингибитора к участку, отдаленному от каталитического центра, вызовет такие изменения в структуре фермента, которые передадутся в активный центр и нарушат его строение, приводящее к инактивации фермента. Это частный случай аллостерического ингибирования ферментов — весьма распространенного механизма регуляции их активности.
Принципы функционирования, общие для всех ферментов, реализуются в каждом случае в свойственный данному ферменту способ связывания субстрата и каталитический механизм. Если связывание субстратов и обусловленная им специфичность ферментов достаточно подробно описаны в последние годы, то способ действия каталитического центра практически ни в одном случае не может считаться окончательно установленным, хотя для ряда ферментов предложены механизмы, весьма близкие к реально существующим. Мы рассмотрим данные о механизме функционирования некоторых ферментов, уделяя особое внимание чертам, имеющим общее значение и типичным для биологических катализаторов различной природы.